氧化还原反应的微课
- 格式:doc
- 大小:21.00 KB
- 文档页数:2






第二章化学物质及其变化第三节氧化还原反应——氧化还原反应的电子转移数目的计算一、教学目标1、了解氧化还原反应的本质与特征2、记住常见元素在化合物中表现出的化合价态3、学会用双线桥法标出得失的电子数,建立电子守恒的思想二、核心素养【证据推理与模型认知】在学习氧化还原反应基础知识上;学会运用形象生动的实物、模型、计算机课件等手段帮助学生理解氧化还原反应的中电子转移的数目;提高学生的兴趣,促使学生思考;培养学生的观察能力、实验能力、探究能力。
【科学探究与创新意识】通过氧化还原反应电子转移的学习,培养学生准守恒的思想、加深对氧化还原反应概念的理解、增强计算能力。
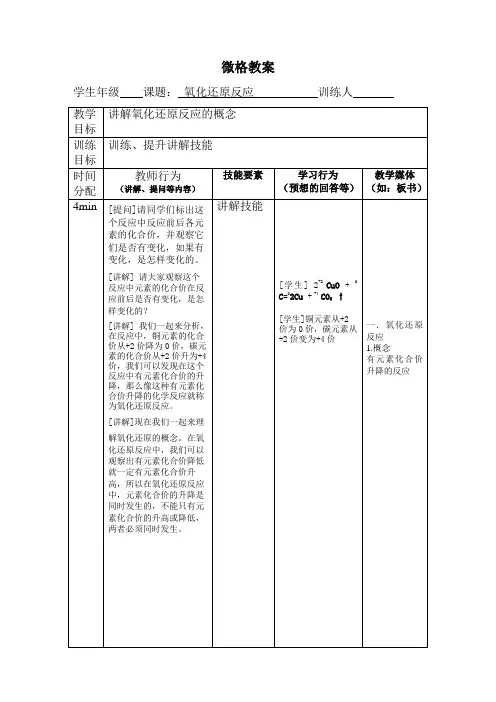
三、教学重点通过得失电子守恒的思想计算转移的电子数四、教学难点利用n(氧化剂)×N(变价原子数)×(高价-低价)= n(还原剂)×N(变价原子数)×(高价-低价)计算转移的电子数五、课时安排1课时六、教学过程【引入新课】同学们我们已经学完了《氧化还原反应》的这一章节的内容,请同学回忆一下氧化还原反应的本质与特征?【学生答题】本质:化学反应过程中,有电子的得失或者偏移特征:化学反应前后有化合价升降【老师陈述】在在氧化还原反应中,计算转移的电子数是一个难点,同时也+2 +3 +5 +3 1个Fe 2+失去e - 是一个常考的问题。
如果能把这个问题解决好了,接下来可以轻易的解决求氧化剂、还原剂物质的量之比或质量比,氧化产物与还原产物的物质的量之比,以及确定反应前后某一元素的价态变化等问题【衔接下文】一般解决氧化还原反应中电子转移数目的问题用两种方法化学方程式法和分析法,接下来我们结合例题来讲解。
【例题讲解】例题——化学方程式法FeO 溶于足量稀硝酸溶液,如果反应掉2mol 还原剂则转移的电子数 (用N A 表示).解析:3FeO+10H + + NO 3- = 3Fe 3++NO ↑+5H 2O依据化合价的升降,我们判断出FeO 做还原剂,它前面的计量数为3,从+2升高到+3一个失去1个e -,总共失去3 e -.3FeO ——3 e - 2molFeO ——2mol e -——2N A e -【例题讲解】例题——分析法FeO 溶于足量稀硝酸溶液,如果反应掉2mol 还原剂则转移的电子数 (用N A 表示).解析:需要你了解常见的还原剂及对应的氧化产物,常见的氧化剂及对应的还原产物。




氧化还原反应顺序认识微课教学设计宁波滨海国际合作学校李发顺教学目标:以Cl2通入FeI2溶液中实验现象为例,探究Fe2+和I-哪一种离子先被氧化,并与其还原性强弱比较,从中找出同一氧化剂(还原剂)与不同的还原剂(氧化剂)反应时的先后顺序问题,加深对氧化还原反应顺序的理解。
教学重难点:重点:实验结论与已知微粒还原性强弱Fe2+<Br-<I-之间的融合理解难点:实验的设计与操作,帮助学生理解不同还原性离子遇到同一氧化剂时反应的先后顺序,并进行推论。
教学过程:打扫卫生,先擦窗还是先擦桌椅?擦窗要踩在桌椅上,桌椅还得重擦。
氧化还原反应中也有这样一类先后反应顺序问题或者是反应后是否要重新消耗的问题要探讨。
问题:已知氧化性Br2>Fe3+>I2,还原性I->Fe2+>Br-。
将少量Cl2通入FeI2溶液中,是Fe2+先被氧化还是I-先被氧化呢?请同学提出可能假设:假设1:Fe2+先被氧化假设2:I-先被氧化假设3:两者同时被氧化实验:再在支试管中加入2mL0.5mol/LFeI2溶液,再加入1mLCCl4溶液,逐滴加入新制氯水,并不断振荡,观察试管中液体颜色变化并用KSCN溶液检验是否有Fe3+生成?在整个实验中我们发现上层的溶液浅绿色变成了黄色,而下层的CCl4层开始没有出现橙红色,直到后续再转为橙红色。
说明Cl2先将I-氧化后氧化Fe2+,假设2正确。
为什么会出现这样的现象呢?如果是Fe2+先被氧化成Fe3+,I-又会将Fe3+还原成Fe2+,而I-被氧化成I2,实验也证实如此,原因就是I-还原性比Fe2+强,所以I-在更高位如同要擦的“窗户”,而Fe2+在相当于低位的“桌椅”。
结论1:相同的氧化剂(微粒)氧化还原性不同的物质(微粒)时,还原性强的物质(微粒)先被氧化。
知识运用:若将少量Cl2通入FeBr2溶液中,是Fe2+先被氧化还是Br-先被氧化呢?这时我们要判断还原性谁更强?谁是我们要擦的“窗户”问题。
《氧化还原反应》一教材分析:氧化—还原反应是日常生活、工农业生产和现代科技中经常遇到的一类重要的化学反应。
它贯穿中学化学学习的全过程,是学习中学化学的主线和关键之一。
在已学的课程中,燃料的燃烧,金属的冶炼等都涉及到氧化—还原反应。
通过这一节内容的学习,了解化学反应有多种不同的分类方法,认识从反应中反应物元素化合价的升降和电子转移的角度来对化学反应进行分类就是从本质上对化学反应进行分类。
二学情分析:学生在初三的时候已经初步接触过氧化反应和还原反应,而且学生已经学过化学中的四大反应类型,对于化学反应的分类具有一定的认识,对这方面的知识总体来说不陌生,而氧化还原反应是建立在初中学过的知识之上的,因此学生学习起来上手应该不难,但需要教师做好导引工作,让学生明白氧化还原反应的实质,了解化学反应有多种不同的分类方法,认识从反应中反应物元素化合价的升降和电子转移的角度来对化学反应进行分类就是从本质上对化学反应进行分类。
三教学目标:知识与技能1.理解氧化还原反应的相关概念;2.学会用化合价变化观点来判断氧化还原反应;3.初步掌握根据化合价变化来分析氧化还原反应的方法。
过程与方法1.复习巩固初中四种基本反应类型以及从得氧、失氧角度划分氧化反应和还原反应,进一步了解化学反应的多种分类方法,并由此得出划分的依据不同而有不同分类方法和使用范围。
2.引导学生从元素化合价这一角度看化学反应方程式,让学生自己发现问题,通过学生之间的讨论解决问题,掌握氧化还原反应的本质。
情感态度价值观1. 通过交流、讨论,加强学生之间的合作学习;2.通过氧化还原反应概念的教学,培养学生准确描述概念、深刻理解概念、比较辨析概念的能力。
四教学重难点:教学重点:1学会用化合价升降观点理解氧化还原反应。
教学难点:1.理解氧化还原反应的表征。
五教学策略1.复习巩固初中四种基本反应类型以及从得氧、失氧角度划分氧化反应和还原反应,进一步了解化学反应的多种分类方法,并由此得出划分的依据不同而有不同分类方法和使用范围。
《氧化还原反应》
一教材分析:
氧化—还原反应是日常生活、工农业生产和现代科技中经常遇到的一类重要的化学反应。
它贯穿中学化学学习的全过程,是学习中学化学的主线和关键之一。
在已学的课程中,燃料的燃烧,金属的冶炼等都涉及到氧化—还原反应。
通过这一节内容的学习,了解化学反应有多种不同的分类方法,认识从反应中反应物元素化合价的升降和电子转移的角度来对化学反应进行分类就是从本质上对化学反应进行分类。
二学情分析:
学生在初三的时候已经初步接触过氧化反应和还原反应,而且学生已经学过化学中的四大反应类型,对于化学反应的分类具有一定的认识,对这方面的知识总体来说不陌生,而氧化还原反应是建立在初中学过的知识之上的,因此学生学习起来上手应该不难,但需要教师做好导引工作,让学生明白氧化还原反应的实质,了解化学反应有多种不同的分类方法,认识从反应中反应物元素化合价的升降和电子转移的角度来对化学反应进行分类就是从本质上对化学反应进行分类。
三教学目标:
知识与技能
1.理解氧化还原反应的相关概念;
2.学会用化合价变化观点来判断氧化还原反应;
3.初步掌握根据化合价变化来分析氧化还原反应的方法。
过程与方法
1.复习巩固初中四种基本反应类型以及从得氧、失氧角度划分氧化反应和还原反应,进一步了解化学反应的多种分类方法,并由此得出划分的依据不同而有不同分类方法和使用范围。
2.引导学生从元素化合价这一角度看化学反应方程式,让学生自己发现问题,通过学生之间的讨论解决问题,掌握氧化还原反应的本质。
情感态度价值观
1. 通过交流、讨论,加强学生之间的合作学习;
2.通过氧化还原反应概念的教学,培养学生准确描述概念、深刻理解概念、
比较辨析概念的能力。
四教学重难点:
教学重点:
1学会用化合价升降观点理解氧化还原反应。
教学难点:
1.理解氧化还原反应的表征。
五教学策略
1.复习巩固初中四种基本反应类型以及从得氧、失氧角度划分氧化反应和还原反应,进一步了解化学反应的多种分类方法,并由此得出划分的依据不同而有不同分类方法和使用范围。
2.引导学生从元素化合价这一角度看化学反应方程式,让学生自己发现问题,通过学生之间的讨论解决问题,掌握氧化还原反应的本质。
六教学过程
教师活动:各种各样的化学反应使我们的生活异彩纷呈,丰富了我们所生活的世界。
根据依据反应物和生成物的类别及反应前后物质种类的多少我们将化学反应分为了这四类,那么请同学们看这个化学反应属于四大反应类型中的哪种呢?播放一氧化碳还原氧化铜的化学方程式。
,
学生活动:分析判断。
得出不属于任何一种反应类型。
教师活动:不属于其中的任何一种,也就是说,在初中阶段我们所采取的分类方法并不能够包括所有的化学反应,我们需要一个更加全面的分类标准,能够囊括所有的化学反应。
同学们什么叫做氧化反应呢?什么叫做还原反应?
学生活动 :回答思考
教师活动:氧化反应是得到氧的反应,还原反应是失去氧的反应。
例如氢气还原氧化铜的反应,氢气得到了氧发生了氧化反应,在一个化学反应当中有得到氧的物质就会有失去氧的物质,氧化铜失氧发生了还原反应,也就是说在一个化学反应当中,氧化反应和还原反应是同时发生的,给这样的化学反应起了什么名字最合适呢?
学生活动:氧化还原反应。
教师活动:如果我们换一个角度来看氧化还原反应,从化合价的角度来看,有什么发现呢?同学们可以讨论交流你们的心得体会。
播放氧化还原反应的几个例子(都是得失氧的方程式)请同学标出反应前后各个元素的化合价。
学生活动:动手标出化合价。
教师活动:以氢气还原氧化铜为例,反应前氢气中的氢元素化合价是0价,反应后氢元素的化合价是+1价,氢气发生了氧化反应。
那么,在这些反应中发生氧化反应的物质它们有什么共同点呢?有元素的化合价升高了。
发生还原反应的物质呢?有元素的化合价降低了。
也就是说在发生氧化还原反应的时候,是要有元素化合价发生变化的。
从这个角度来分类,有元素化合价发生变化的化学反应就叫做氧化还原反应。
那什么是非氧化还原反应?
学生活动:回答问题
教师活动:(再回到之前四大类型概括不了的化学反应那)从新的角度来看,这个反应是什么反应呢?氧化还原反应。
请同学们来判断下列那些反应是氧化还原反应?播放ppt,让同学从化合价的角度来判断哪些是氧化还原反应。
(巩固练习)
学生活动:看元素的化合价,来判断哪些是氧化还原反应。
教师活动:有元素化合价升降的化学反应就是氧化还原反应,(讲每个方程式中的元素化合价变化)那同学们知道为什么在氧化还原反应中,会有元素的化合价发生变化吗?这个问题我们下节课再来讲解。
下课。