实验一 二茂铁的绿色合成
- 格式:doc
- 大小:39.00 KB
- 文档页数:4

二茂铁的合成和电化学性能研究实验目的:1.了解二茂铁这一典型金属有机化合物的合成方法和有关性质。
2.学会电化学电极的准备和操作。
3.熟悉常规的电化学测试方法(循环伏安法和交流阻抗法)以及数据的处理。
实验原理:1.二茂铁:二茂铁(Fe(C5H5)2, ferrocene, Fc)是一个典型的金属有机化合物 夹心型结构 G Wilkinson 和Woodward 在1952年确定了它的结构。
性质:熔点:172~173℃,400℃不分解,但在100℃开始升华。
能溶于乙醚、石油醚等非极性溶剂,不溶于水。
对碱和非氧化性酸稳定。
具有芳香性,在环上能进行酰化反应,烷基化反应等芳香环所具有的反应特性。
特别是它的带有手性的衍生物,可以作为手性配体,用于手性化合物催化合成的辅助配体。
2.二茂铁的制备二茂铁的合成方法很多,一般都是用绿化亚铁和环戊二烯的盐在碱的作用下得到。
例如:3.循环伏安法在一定扫描速率下,从起始电位正向扫描到转折电位期间,溶液中Red 被氧化生成Ox ,产生氧化电流;当负向扫描从转折电位变到原起始电位期间,在指示电极表面生成的Ox 被还原生成Red ,产生还原电流。
从循环伏安图上读取以下数据: 可逆性判断: 计算电极面积和扩散系数: Fe FeCl 2 +C 5H 6三乙胺Fe(C 5H 5)2FeCl 2 + MC 5H 5(M=Na, K)Fe(C 5H 5)2FeCl 2 + C 5H 5MgBr Fe(C 5H 5)2i —E 曲线pc ϕpa ϕpcpa 0'()2ϕϕϕ+=pa i pc i pa pc 1i i ≈pc pa 0.059nϕϕϕ∆=-=53/21/21/2p 2.6910i n ACD v =⨯4.交流阻抗:也叫做电化学阻抗谱(Electrochemical Impedance Spectroscopy,简写为EIS),早期的电化学文献中称为交流阻抗(AC Impedance)。

预习报告实验名称绿色铁化合物的制备一、实验目的和要求1、了解并掌握铁化合物的制备方法及组成测定方法;2、掌握水浴加热、非水溶剂洗涤的方法;3、进一步熟练滴定操作方法;4、掌握实验结果数据的处理方法。
二、实验原理:1、绿色铁化合物K x Fe y(C2O4)z·wH2O的制备原理:Fe x(C2O4)y·zH2O+K2C2O4·H2O+H2O2 ==== K d Fe a(C2O4)b·cH2O+ H2O K d Fe a(C2O4)b·cH2O + H2C2O4·2H2O ====KxFey(C2O4)z·wH2O2.分析铁化合物有关反应原理:①在酸性条件下,高锰酸钾可同时氧化草酸根和二价铁离子:5C2O42-+8H2SO4+2KMnO4=K2SO4+2 Mn2++7 SO42-+ 10CO2+8H2O5Fe2+ + MnO4-+8H2+=5Fe3+ + Mn2++ 4H2O②用锌片或锌粉还原高价铁成低价铁:Fe3+ +Zn ==== Fe2++Zn2+③用硫氰酸铵来检测三价铁离子:Fe3++SCN- ==== Fe (SCN )3(血红色)三、仪器、试剂仪器:电子天平、水浴锅、循环水泵、抽滤装置、烧杯、烘箱、电炉、滴定管、称量瓶;试剂:(NH4)2Fe(SO4)2·6H2O、H2C2O4、K2C2O4 、KMnO4、H2O2、KSCN、锌粉锌片、H2SO4、乙醇、丙酮。
四、实验步骤2g 黄色化合物313K 保温10ml1:1乙醇亮绿溶液一次洗涤 亮绿晶体悬浮液棕色沉淀10mlH 2O 25mLH 2O3.2g K 2C 2O 4·H 2O1.2gH 2C 2O 48ml95%乙醇一次洗涤丙 酮绿色铁化合物。

二茂铁的制备实验报告
实验目的:掌握两步法合成二茂铁的实验方法,理解二茂铁的结构及其化学性质。
实验原理:二茂铁是一种具有很强的磁性和光学性质的五元环化合物。
其制备方法一般采用两步法,第一步是通过铁冠醚与钠反应得到二茂铁钠,第二步是通过盐酸将其酸化得到二茂铁。
实验步骤:
1.准备实验所需的器材和试剂,清洗干净,并在通风橱中进行。
2.将10.0 g钠粒用手指拿出5个,然后还原分散在无水乙醇中。
3.将10.0 g铁二甲酸根铵溶于50 mL蒸馏水中,滴加6.0 mL10%水合肼溶液,搅拌均匀至铁二甲酸根铵充分溶解。
然后将适量液氨加入溶液,调节PH至10-11。
此时,加入磁力搅拌子。
4.滴加钠乙醇溶液至观察到溶液变为棕色,此时可以停止反应。
5.过滤棕色溶液,沉淀放置至室温下压榨液体垫干。
6.加入10 mL无水乙醇,使沉淀完全颗粒化,然后抽滤并压干。
7.将压榨的样品加入烷基苯(或氯仿)中,进行提纯,得到二茂铁粉末。
用甲苯或丙酮洗涤干净,然后烘干。
8.将得到的二茂铁样品称量,计算收率。
实验结论:通过本次实验,成功地制备了二茂铁,并得到了80.5%的收率。
实验的过程严谨,结论可靠。

二茂铁的实验原理二茂铁是一种有机金属化合物,由两个茂环与一个铁原子组成。
它是一种具有特殊化学性质和应用潜力的化合物。
在这篇回答中,我将介绍二茂铁的实验原理,并探讨其在有机合成和催化反应中的应用。
实验原理:二茂铁可以通过不同的实验方法制备得到。
其中,最常用的方法是二茂铁钠与无水铁(Ⅲ)氯化合物在乙醇或甲醇中反应。
这一反应可以由下面的化学方程式表示:Na(C5H4FeC5H5) + FeCl3 →Fe(C5H4FeC5H5) + NaCl这个反应是一个氧化还原反应,二茂铁钠被氧化为二茂铁,而无水铁(Ⅲ)氯化物被还原为铁(Ⅱ)氯化物。
这个反应通常在室温下进行。
一旦制备得到二茂铁,可以通过多种方法对其进行纯化和表征。
其中,最常用的方法是通过扫描电子显微镜(SEM)和能量散射X射线光谱(EDX)来研究二茂铁的形貌和组成。
此外,紫外-可见光谱(UV-Vis)和核磁共振(NMR)等方法也广泛运用于对二茂铁的性质进行研究。
应用:二茂铁在有机化学合成中有广泛的应用。
它可以作为催化剂来促进多种有机反应的进行。
例如,二茂铁可以催化烯烃的环化反应、[4+2]环加成反应等。
此外,利用二茂铁催化剂,可以实现对键合与解离反应、催化氧化反应、重氮化反应等的控制。
这些反应在有机合成中扮演着重要的角色。
另外,二茂铁还可以用作一种研究材料和电化学材料。
它可以用于制备具有特殊功能的分子材料和聚合物材料。
例如,二茂铁可以用作电池电极材料,以实现高效的电荷转移和储存。
此外,由于二茂铁中的铁离子易于被氧化和还原,它也可以用于制备电解质材料和传感器材料。
此外,二茂铁还在医药领域有一定的应用。
二茂铁可以作为抗癌药物的组成部分,与肿瘤细胞发生相互作用,促进肿瘤细胞的死亡。
此外,二茂铁还可以用于制备抗菌和抗氧化剂,用于治疗炎症和神经退行性疾病。
综上所述,二茂铁是一种具有广泛应用潜力的化合物。
通过了解其实验原理和应用,我们可以更好地理解和利用二茂铁在有机合成、材料科学和医药领域的重要性。

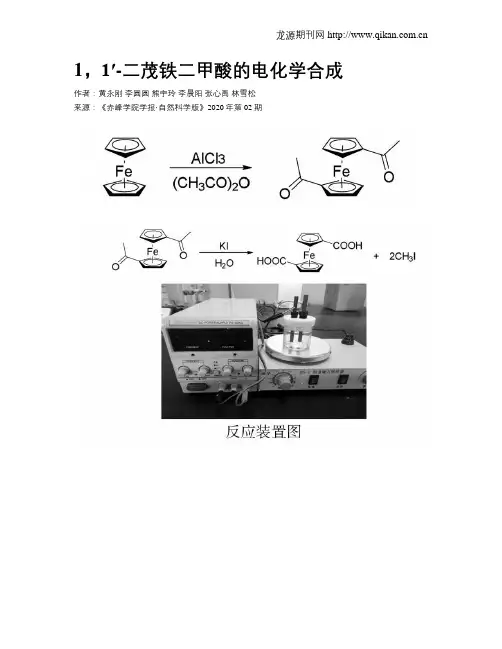
1,1′-二茂铁二甲酸的电化学合成作者:黄永刚李圆圆熊宇玲李晨阳张心禹林雪松来源:《赤峰学院学报·自然科学版》2020年第02期摘要:有机电化学合成具有许多优点,是一种绿色的合成技术,所以本实验采用电化学合成法制备1,1′-二茂铁二甲酸,该方法具有操作简单等许多优点,有较好的发展前景.关键词:1,1′-二茂铁二甲酸;电化学合成;绿色化学中图分类号:O646; 文献标识码:A; 文章编号:1673-260X(2020)02-0015-02有机电化学合成是有机化学和电化学技术相结合的一门科学.与传统的有机合成方法相比,有机电化学合成具有污染小、反应选择性高、反应条件温和反应可随时停止等优点.因而在药物、香料、染料和有机高分子等精細化学品的合成中得到了广泛应用[1-2].随着环境污染的加剧,有机电化学合成作为一种绿色的化学合成技术受到了化学工业界的密切关注[3-4].电化学合成的发展非常迅速,而且电化学合成所需设备简单,操作费用低,是名副其实的“绿色可持续化学”.近年来二茂铁及其衍生物在材料化学、电化学、不对称合成化学中的应用引起了人们极大的兴趣,其应用前景也越来越广泛[5-6].其中1,1′-二茂铁二甲酸是合成二茂铁Schiff碱衍生物的重要原料,其在有机合成中占有重要的地位.1,1′-二茂铁二甲酸的合成主要有两条路线:一种是先将二茂铁转变为1,1′-二乙酰基二茂铁,然后通过卤仿反应制备1,1′-二茂铁二甲酸;另一种是将二茂铁制备成金属有机化合物,然后让其与二氧化碳作用.前者通常使用次氯酸钠氧化法来制备,但该方法时间久,收率较低.而通过后一种方法所得产物纯度较差,对操作环境要求高.鉴于有机电化学合成具有流程短,反应条件温和等优点,故本实验采用电化学合成法制备1,1′-二茂铁二甲酸,而且该方法反应装置简单,操作简便,是一种有应用前景的合成方法.实验部分1 主要试剂和仪器试剂:二茂铁、碘化钾、二氯甲烷、乙酸酐、无水三氯化铝均为分析纯,未做进一步提纯.仪器:电解池为定制,采用石墨电极,两电极之间距离为1cm;PS-305D数显直流稳压电源(香港龙威仪器有限公司);85-2恒温磁力搅拌器(常州国华电器).2 实验方法2.1 1,1′-二乙酰基二茂铁的合成文献已经报道的1,1′-二乙酰基二茂铁的合成方法主要有两种,一种为以乙酰氯为原料[7],另一种以乙酸酐为原料,虽然乙酸酐的活性较乙酰氯略低,但乙酸酐挥发性弱,易操作,所以,本实验以乙酸酐为酰化试剂进行反应,具体操作依照文献[8-9]进行.向带有温度计、滴液漏斗、回流冷凝管(带干燥管)的四口烧瓶中迅速加入20g(0.15mol)研细三氯化铝和60mL二氯甲烷,将烧瓶置于冰水浴中.一边搅拌一边缓慢滴加6.3mL(0.066mol)的乙酸酐,并连接可防倒吸的尾气吸收装置.乙酸酐滴加过程中,固体开始溶解,滴加过程中反应较剧烈,应缓慢控制滴加速度.待乙酸酐全部滴加完毕后.另将5.58g (0.03mol)的二茂铁溶于40mL的二氯甲烷,缓慢滴加进反应装置.大约需要0.5小时,加完后,继续反应2h,用TCL跟踪反应至原料点基本消失.将反应液倒入200mL冰水中,进行分液.水层用二氯甲烷洗涤3次,合并有机层,水层弃去,有机层用水洗3次.减压蒸干,得红黑色固体.产物经乙醇-水重结晶后,得1,1′-二乙酰基二茂铁3.49g,收率43.09%.2.2 1,1′-二茂铁二甲酸的电化学合成1,1′-二茂铁二甲酸的电化学合成时,反应温度、pH值、电流密度等参数未进行进一步探索,均参考文献[10]进行:向带有磁力搅拌的电解池中加入60mL蒸馏水,3.98g(0.024mol)碘化钾,1.08g(0.004mol)的1,1′-二乙酰基二茂铁.以石墨为电极,接通电源,将电流调整到1A,尽量保持电流恒定.随反应的进行电压由12V增加到17V,在阳极周围会有晶体析出.通电77min后(电量已达到理论值)切断电源,继续反应.反应结束后,抽滤,弃去滤渣,滤液用HCl调节pH为3-4,溶液中析出棕红色晶体,再次抽滤,得到棕红色物质1,1′-二茂铁二甲酸,产品用乙醇-水为溶剂进行重结晶,称重.化合物的红外光谱数据为ν(cm-1):3447,1682,1489, 1301,1169,1032,918.与文献值[11]吻合.3 结果与讨论1.电解池为定制电解池,通过反复的探索发现,电极的距离对实验结果影响较大.电极距离远,造成电导率下降,影响反应效果;电极距离过近,有短路的风险,所以电极距离以1cm 为宜.2.实验收率的计算,本实验以通过的电流为标准计算收率.电解过程中,流过电解池的电量和电极上氧化还原产物数量之间的关系,可从反应过程中的半反应导出.Q=It其中Q为通电电量,单位为库伦(C);I为电流,单位为安培(A);t为时间,单位为秒(s).根据半反应方程式可得:本实验生成1molCHI3需要6mol电子.一个电子的电量为1.602×10-19C,1mol电子所带的电量为:6.023×1023×1.602×10-19C≈96500C本实验原料为0.004mol,理论上可产生0.008mol CHI3,共需要0.048mol电子,0.048mol×96500C/mol=4632C带入到上述公式中可计算出反应时间为77分钟.但是由于1,1′-二乙酰基二茂铁水溶性较差,反应在两相中进行,导致反应速率较低.所以为了提高反应收率可以在通电结束后适当增加反应时间.77分钟以后的产率计算按实际得到的产品进行计算.3 反应时间对收率的影响下表列出了电化学合成与传统合成[8-9]的收率比较可以看出,电化学的收率在各时间段均明显高于传统的化学合成,有较强的应用价值.结束语本文利用有机电化学合成的理论基础和应用,提出了制备1,1′-二茂铁二甲酸的新方法.与传统方法相比,工艺简单易于控制,对其他有机化合物的制备也有应用价值.参考文献:〔1〕Horn, E. J.; Rosen, B. R.; Chen, Y.; Tang, J.; Chen, K.; Eastgate, M. D.; Baran, P. S. Scalable and sustainable electrochemical; allylic; C-H oxidation[J].; Nature, 2016,533, 78-81.〔2〕Abdulcabbar Yavuz et al; Electrochemical synthesis of CoOOH–Co(OH) 2 composite electrode on graphite current collector for supercapacitor applications[J]. Journal of Materials Science: Materials in Electronics, 2019, 30 (20), 18413-18423.〔3〕党伟荣,陈西波,白晨龙.电化学合成技术在精细化工绿色化的作用[J].化工管理,2019(8):172-173.〔4〕张新胜,曾程初.第十五届全国有机电化学与电化学工业学术会议专辑序言[J].电化学,2017,23(3):247-249.〔5〕汪徐春,等.二茂铁基非线性光学材料研究进展[J].安徽大学学报(自然科学版),2017,41(3):28-34.〔6〕郭鸿旭,邹雪珍,黄尊行.应用前景广阔的二茂铁及其衍生物[J].福州大学学报,2002,5(30):597-603.〔7〕王倩,侯学会,徐翠莲,等.1,1′-二茂铁衍生物的合成研究[J].河南农业大学学报,2006,40(2):213-215.〔8〕吴平,任帅.1,1'-双羧基二茂铁的合成及性质研究[J].吉林化工学院学报,2017,34(7):15-17.〔9〕汪洋,等.1,1′-二茂铁二甲酸的制备[J].当代化工,2015, 44(8):1774-1777.〔10〕薛文華.电化学法制备碘仿的研究[J].广州化工,2003,31(1):48-50.〔11〕Sonoda A, Moritani I .Reactions of ferrocenylcarbede Ⅳ .Thesynthesis of [ 3]-ferroceophan-2-one to syllhydrazone and the thermal decomposition of its sodium salt[J]. J . Organometal.Chem., 1971, 26(1): 133-140.〔12〕李英俊,等.电化学合成碘仿装置的改进及反应条件的探索[J].实验技术与管理,2007,24(3):49-51.。


二茂铁合成工艺
1 什么是二茂铁?
二茂铁是一种含有铁和茂基的有机金属化合物,具有独特的结构
和性质。
由于其分子内部包含一个铁原子,它有着极强的氧化还原特性,因此被广泛应用于催化、电子、磁性材料等领域。
2 二茂铁的合成工艺
二茂铁的合成方法有很多种,其中最为常见的是费歇尔-Tropsch
方法,也称为煤制油法。
该方法是利用煤炭等碳质物质在高温高压下,在催化剂作用下,生成含有碳氢化合物的混合物。
通过加热和压缩等
工艺,可将这些混合物分离,从中得到二茂铁。
此外,还有其他的合成方法,如烷基铁法、金属-有机溶剂法等。
这些方法通常需要较为复杂的催化剂和反应条件,但它们均能实现二
茂铁的高效合成。
3 工艺优化
为了提高二茂铁的产量和纯度,近年来研究人员对二茂铁的合成
工艺进行了改进和优化。
例如,将反应溶液加入无水氨中反应可以有
效地提高产率和纯度;引入新型催化剂也可以提高反应效率和选择性等。
此外,研究人员还在不断探索有机-无机杂化材料、电化学合成等新方法,以进一步优化二茂铁的合成工艺,为二茂铁的应用带来更广阔的发展前景。
4 总结
二茂铁是一种经典的有机金属化合物,具有重要的应用前景。
其合成工艺方便、可行性强,因此被广泛应用于催化、电子、磁性材料等领域。
为了提高其产量和纯度,近年来研究人员对二茂铁的合成工艺进行了改进和优化,这将为二茂铁的应用带来更广阔的发展前景。

二茂铁的合成和电化学性能研究实验目的:1.了解二茂铁这一典型金属有机化合物的合成方法和有关性质。
2.学会电化学电极的准备和操作。
3.熟悉常规的电化学测试方法(循环伏安法和交流阻抗法)以及数据的处理。
实验原理:1.二茂铁:二茂铁(Fe(C5H5)2, ferrocene, Fc)是一个典型的金属有机化合物 夹心型结构 G Wilkinson 和Woodward 在1952年确定了它的结构。
性质:熔点:172~173℃,400℃不分解,但在100℃开始升华。
能溶于乙醚、石油醚等非极性溶剂,不溶于水。
对碱和非氧化性酸稳定。
具有芳香性,在环上能进行酰化反应,烷基化反应等芳香环所具有的反应特性。
特别是它的带有手性的衍生物,可以作为手性配体,用于手性化合物催化合成的辅助配体。
2.二茂铁的制备二茂铁的合成方法很多,一般都是用绿化亚铁和环戊二烯的盐在碱的作用下得到。
例如:3.循环伏安法在一定扫描速率下,从起始电位正向扫描到转折电位期间,溶液中Red 被氧化生成Ox ,产生氧化电流;当负向扫描从转折电位变到原起始电位期间,在指示电极表面生成的Ox 被还原生成Red ,产生还原电流。
从循环伏安图上读取以下数据: 可逆性判断: 计算电极面积和扩散系数: Fe FeCl 2 +C 5H 6三乙胺Fe(C 5H 5)2FeCl 2 + MC 5H 5(M=Na, K)Fe(C 5H 5)2FeCl 2 + C 5H 5MgBr Fe(C 5H 5)2i —E 曲线pc ϕpa ϕpcpa 0'()2ϕϕϕ+=pa i pc i pa pc 1i i ≈pc pa 0.059nϕϕϕ∆=-=53/21/21/2p 2.6910i n ACD v =⨯4.交流阻抗:也叫做电化学阻抗谱(Electrochemical Impedance Spectroscopy,简写为EIS),早期的电化学文献中称为交流阻抗(AC Impedance)。


题目:二茂铁的绿色合成姓名:学号:20 课件密码:13693 单位:第7组一、前言1、实验目的①了解二茂铁以及衍生物的应用,特别是作为一种优良的燃料助燃催化剂,其重要的经济价值不环保价值;②掌握利用氧弹卡计测量油品燃烧所产生的热量的操作技术,应用CACE系统评价油品的燃烧效率。
2、实验意义随着化石燃料的使用,地球上的资源问题、环境问题等越来越突出。
寻找新能源,开发新能源是当今比较热门的一个课题。
本实验用二茂铁作为添加剂,利用氧弹量热计测定燃油在是否有添加剂存在下的燃烧热,了解和比较添加二茂铁对柴油燃烧效率和速率的影响以及二茂铁的节能助燃效应。
同时,学习和掌握甲醛法和盐酸萘乙二胺分光光度法分别测定SO2和NO2气体的浓度,并应用于柴油燃烧后尾气成分的测定。
3、文献综述与总结二茂铁与芳香族化合物化学性质相似,具有独特的芳香性,甚至在一些情况下,其芳香性能大于苯环。
二茂铁为 18 电子构型,具有良好的稳定性,其中心铁原子和环戊二烯基都具有一定的活性,从而可以进行一系列的有机反应。
在二茂铁的环上容易发生亲电取代反应,可进行金属化、氯化、酰基化、烷基化、磺化、甲酰化以及配合体交换等反应,从而可制备一系列用途广泛的衍生物。
二茂铁衍生物具有疏水性,这使其能够顺利地通过细胞膜,与细胞内物质相互作用,此外它还具有良好的稳定性、低毒性,因而可作为治疗某些疾病的药物,如抗癌药物等。
由于二茂铁及其衍生物还具有氧化还原可逆性,可在酶的作用下参与代谢作用,所以它们还可用来制造植物生长调节剂、杀虫剂等。
二茂铁衍生物具有良好的电导特性,当二茂铁与共轭体系衔接时,可以形成性能良好的分子导线。
第一个含二茂铁代表性的分子导线是 1,1′- 双(三甲基甲硅烷乙炔基)二茂铁。
二茂铁的热稳定性、氧化还原性、结构可变性和金属特性,使得其在液晶材料方面的应用前景也十分广阔。
此外,二茂铁衍生物还被广泛地应用到抗菌剂,聚合物、纳米材料、电化学元件、生物化学、分析化学等邻域,对其的开发利用成为金属有机化学界的热议话题。
华南师范大学实验报告实验一二茂铁的绿色合成课程名称:综合化学实验指导老师:郑盛润姓名:XXX 学号:20092501148 班级:10化一课件密码:70750一、前言1、实验目的①掌握用微型合成装置合成、提纯二茂铁的操作技术。
②学会通过熔点的测定、红外光谱等手段来分析鉴定二茂铁。
③了解一些易对环境造成污染的化合物的绿色合成方案,力求把对环境的影响降到最低限度,培养在从事科研与生产活动中的绿色、环保理念。
2、实验意义与综述二茂铁又叫双环戊二烯基铁,学名二环戊二烯基铁,是由两个环戊二烯基阴离子和一个二价铁阳离子组成的夹心型化合物。
其分子式为(C5H5)2Fe,分子量为186,外观为橙黄色针状或粉末状结晶,具有类似樟脑的气味,不溶于水,溶于甲醇、乙醇、乙醚、石油醚、汽油、煤油、柴油、二氯甲烷、苯等有机溶剂。
其分子呈极性,具有高度热稳定性、化学稳定性和耐辐射性,溶于浓硫酸中,在沸腾的烧碱溶液和盐酸中不溶解,不分解。
在化学性质上,二茂铁与芳香族化合物相似,不容易发生加成反应,容易发生亲电取代反应,可进行金属化、酰基化、烷基化、磺化、甲酰化以及配合体交换等反应,从而可制备一系列用途广泛的衍生物。
[1] 目前,二茂铁的制备方法主要可分化学合成法和电解合成法两大类。
[2-3]化学合成法:化学合成法主要有环戊二烯钠法、二乙胺法、相转移催化法、二甲基亚砜法等。
电解合成法:在直流电的作用下,用恒电流法或恒电压法,以铁板和镍板作电极。
随着各种合成技术的出现,其衍生物也多达数百种,因此其用途越来也越来越广。
二茂铁及其衍生物在生活的应用非常广泛,概括的来讲,主要有以下几个方面[3-4]:作燃料的添加剂,将二茂铁加到燃料中可能起到助燃、消烟以及抗震的作用;作催化剂,二茂铁可作为合成氨以及高分子过氧化物分解的催化剂;在生化和分析上的应用,二茂铁可用于银、钒、汞、铅、金等元素的安培滴定法分析中;作塑料、橡胶等高分子聚合物的添加剂,将二茂铁加到聚乙烯中可以改善聚乙烯电稳定器涂层的效果;此外, 二茂铁还可用于农业、机械等。
有机合成与制备实验实验一乙酰二茂铁的合成1.一、实验目的:2.通过乙酰二茂铁的合成, 了解用Friendel-Crafts酰基化反应制备非苯芳酮的原理和方法。
3.学习用薄层色谱跟踪反应进程和检测产品纯度的方法。
二、实验原理:二茂铁, 又称二环戊二烯合铁、环戊二烯基铁, 是一种具有芳香族性质的有机过渡金属化合物。
二茂铁是最重要的金属茂基配合物, 也是最早被发现的夹心配合物, 包含两个环戊二烯环与铁原子成键。
常温下为橙黄色粉末, 有樟脑气味。
熔点172°C-174°C, 沸点249°C, 100°C以上能升华;不溶于水, 易溶于苯、乙醚、汽油、柴油等有机溶剂。
与酸、碱、紫外线不发生作用, 化学性质稳定, 400°C以内不分解。
其分子呈现极性, 具有高度热稳定性、化学稳定性和耐辐射性, 其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。
二茂铁是火箭固体燃烧过程的加速剂、柴油的消烟节能添加剂、汽油抗爆助燃剂等。
目前约90%的二茂铁是作为燃烧添加剂消耗的。
二茂铁具有类似苯的一些芳香性, 比苯更容易发生亲电取代反应, 例如Fridel-Crafts反应:由于二茂铁分子中存在亚铁离子, 对氧化的敏感限制了它在合成中的应用, 如不能用混酸对其硝化。
一般认为, 如用无水三氯化铝为催化剂, 酰氯或酸酐为酰化剂, 当酰化剂与二茂铁的摩尔比为2:1时, 反应物以1,1’-二元取代物为主。
以乙酸酐为酰化剂, 三氟化硼、氢氟酸或磷酸为催化剂, 主要生成一元取代物。
在此反应条件下, 主要生成单乙酰二茂铁, 双乙酰二茂铁很少, 但同时有未反应的二茂铁, 利用层析分离法可以在混合物中分离这几种配合物, 先使用薄层层析探索分离这些配合物的层析条件, 然后利用这些条件在柱层析中分离而得到纯的配合物。
薄层层析是将吸附剂均匀地铺在一块玻璃板表面形成薄层(其厚度一般为0.1~2mm), 在此薄层上进行色谱分离的方法。
二茂铁的合成实验报告
实验报告:二茂铁的合成
1. 实验目的
本实验旨在通过高温煅烧法合成二茂铁。
2. 实验原理
二茂铁是由铁和茂基环戊二烯反应生成的。
实验中将茂基环戊二烯与氯化铁在高温下进行反应生成二茂铁。
3. 实验步骤
(1)将茂基环戊二烯溶解在无水乙醇中,制备出约0.1 mol/L 的茂基环戊二烯乙醇溶液。
(2)将氯化铁粉末称取0.01 mol,并与少量无水乙醇混合均匀。
(3)将茂基环戊二烯乙醇溶液缓慢滴加到氯化铁溶液中,并同时用磁力搅拌。
(4)溶液反应完成后,将其转移至砂浴加热器中,并将温度升至200℃,持续反应1小时。
(5)反应结束后,将溶液冷却至室温,并用乙醚进行萃取,得到底物二茂铁。
4. 结果与讨论
实验中,成功合成了二茂铁。
实验过程中,采用茂基环戊二烯乙醇溶液逐滴加入氯化铁溶液,可以控制反应速率和产物的纯度。
砂浴加热器的使用使得反应温度可以达到较高,有利于产物的生成。
乙醚的萃取使得可以将产物从溶液中进行分离。
最终得到的产物为深红色晶体,与二茂铁的特征颜色相符。
5. 结论
本实验成功合成了二茂铁,合成产物的颜色、形态与二茂铁相符。
实验结果表明,高温煅烧法是一种较好的合成二茂铁的方法。
6. 实验总结
本次实验通过高温煅烧法成功合成了二茂铁。
实验过程中需注意控制反应速率和温度,以及实验中溶液的操作,以获得较高的产物纯度。
通过本次实验的实践,对二茂铁的合成方法有了更深的了解。
实验1二茂铁的绿色合成题目: 实验1二茂铁的绿色合成姓名: 学号:课件密码:1 前言1.1实验目的通过二茂铁的绿色合成,不但使学生了解一些易对环境造成污染的化合物的绿色合成方法,力求把对环境的影响降到最低限度,培养学生在从事科研与生产活动中绿色、环保理念,掌握用微型合成装置合成、提纯二茂铁的操作技术,并且学会通过熔点的测定来分析鉴定二茂铁。
1.2实验意义二茂铁又名双环戊二烯基铁,学名二环戊二烯基铁,属于金属有机化合物,它是由两个环戊二烯基阴离子和一个二价铁阳离子组成的具有夹心形状的化合物(如图1),其分子式为(C5H5)2Fe。
二茂铁易溶于甲醇、乙醇、乙醚、石油醚、汽油、二氯甲烷、苯等常用有机溶剂,溶于浓硫酸,在沸腾的烧碱和盐酸溶液中不溶解、不分解;二茂铁具有高度热稳定性、化学稳定性和耐辐射性;二茂铁具有芳香性,100℃以上能升华,不容易发生加成反应,易发生取代反应;此外二茂铁还有低毒性,在溶液中两个环可以自由旋转等特点。
正是基于二茂铁的这种稳定性、芳香性、低毒、亲油性、富电性、氧化还原性和易取代等特点,使得自二茂铁出现以来就引起了广大科研工作者极大的兴趣,对于二茂铁及其衍生物的合成、结构及性质和应用的研究一直以来都是大家所关注的热点。
二茂铁的出现极大的推动了金属有机化学的发展,被认为是近代化学发展的里程碑。
图11.2.1 二茂铁及其衍生物的应用[1-2]1.2.1.1用作燃料添加剂将二茂铁及其衍生物添加到固体、液体或气体燃料中,能发挥其助燃、消烟和抗爆等作用,尤其是对燃烧时产生大量烟尘的烃类,效果更为显著。
添加到火箭的固体燃料中,能促进燃料的充分燃烧和起到消烟作用。
在柴油中加入0.1%(质量分数)的二茂铁,能起到消烟助燃作用,降低柴油发动机的排烟量和尾气中一氧化碳的含量,可减轻排放气体对环境的污染,增强发动机的功率。
二茂铁还能清除柴油机引擎燃烧室表面的沉积炭,并能沉积一层氧化铁膜,该膜能有效地防止炭粒子的重新沉积。
实验1-二茂铁的绿色合成实验目的1.了解有机合成反应的基本规律和条件。
2.学习并掌握二茂铁的合成方法。
3.通过实验验证反应产物的真实性质和结构。
实验原理二茂铁是一种重要的有机金属化合物,其结构如下所示:H|H----C----H|┌───Fe───┐| |H----C C----H| |H H二茂铁在一定条件下可以进行绿色合成反应。
其反应方程式如下所示:H H| |H----C----H H----C----H| |┌───Fe───┐ ┌───Fe───┐| | | |H--C C----H → H--C C----H| | | |H H H H该反应可以使用氯化二茂铁与碘环丙烷在有机溶剂中反应而成。
实验步骤1.准备氯化二茂铁和碘环丙烷的适量容量。
2.将氯化二茂铁和碘环丙烷放置在装有回流冷凝水器的圆底烧瓶中。
3.在装有反应物的烧瓶中加入适量的有机溶剂,如甲醇。
4.通过加热和回流进行反应,在一定时间后,取出反应液。
5.通过合适的蒸发和结晶技术,得到反应产物。
实验结果对得到的反应产物进行红外光谱分析和核磁共振分析,确定反应产物的结构和性质。
反应产物应为绿色固体,其结构与二茂铁类似,并具有一定的物理和化学性质。
实验注意事项1.反应过程中应避免氧气、水分和其他杂质的干扰。
2.反应后的产物需要进行充分的干燥和纯化处理。
3.在实验过程中如有不懂之处,应及时向实验室老师、工作人员或同学询问。
实验实用性二茂铁的合成是有机化学研究的重要内容之一。
本实验通过简单的实验步骤和方法,展示了二茂铁的绿色合成过程,并通过实验结果和分析,验证了反应产物的结构与性质,为有机化学研究提供了有用的参考和指导。
同时,本实验也可以为化学教育提供一种生动有趣、易操作的实验内容。
华南师范大学实验报告
实验一二茂铁的绿色合成
课程名称:综合化学实验指导老师:郑盛润
姓名:XXX 学号:20092501148 班级:10化一课件密码:70750
一、前言
1、实验目的
①掌握用微型合成装置合成、提纯二茂铁的操作技术。
②学会通过熔点的测定、红外光谱等手段来分析鉴定二茂铁。
③了解一些易对环境造成污染的化合物的绿色合成方案,力求把对环境的影响降到最低限度,培养在从事科研与生产活动中的绿色、环保理念。
2、实验意义与综述
二茂铁又叫双环戊二烯基铁,学名二环戊二烯基铁,是由两个环戊二烯基阴离子和一个二价铁阳离子组成的夹心型化合物。
其分子式为(C5H5)2Fe,分子量为186,外观为橙黄色针状或粉末状结晶,具有类似樟脑的气味,不溶于水,溶于甲醇、乙醇、乙醚、石油醚、汽油、煤油、柴油、二氯甲烷、苯等有机溶剂。
其分子呈极性,具有高度热稳定性、化学稳定性和耐辐射性,溶于浓硫酸中,在沸腾的烧碱溶液和盐酸中不溶解,不分解。
在化学性质上,二茂铁与芳香族化合物相似,不容易发生加成反应,容易发生亲电取代反应,可进行金属化、酰基化、烷基化、磺化、甲酰化以及配合体交换等反应,从而可制备一系列用途广泛的衍生物。
[1] 目前,二茂铁的制备方法主要可分化学合成法和电解合成法两大类。
[2-3]化学合成法:化学合成法主要有环戊二烯钠法、二乙胺法、相转移催化法、二甲基亚砜法等。
电解合成法:在直流电的作用下,用恒电流法或恒电压法,以铁板和镍板作电极。
随着各种合成技术的出现,其衍生物也多达数百种,因此其用途越来也越来越广。
二茂铁及其衍生物在生活的应用非常广泛,概括的来讲,主要有以下几个方面[3-4]:作燃料的添加剂,将二茂铁加到燃料中可能起到助燃、消烟以及抗震的作用;作催化剂,二茂铁可作为合成氨以及高分子过氧化物分解的催化剂;在生化和分析上的应用,二茂铁可用于银、钒、汞、铅、金等元素的安培滴定法分析中;作塑料、橡胶等高分子聚合物的添加剂,将二茂铁加到聚乙烯中可以改善聚乙烯电稳定器涂层的效果;此外, 二茂铁还可用于农业、机械等。
如二茂铁作为铁肥料, 能使作物较快生长, 并增加其铁含量。
二茂铁的衍生物可
作为杀虫剂。
二茂铁可作润滑油抗负荷添加剂, 耐磨材料的促进剂等。
总之. 二茂铁的用途极为广泛, 开发二茂铁产品, 对燃料、高分子、催化、生化等领域都有很重要的意义。
二、实验部分
1、实验原理
二茂铁的合成方法可分为电解合成法和化学合成法。
电解合成法能连续操作,但产率低,操作复杂,污染大。
化学合成法的应用较多,国内主要有醇钠法、有机胺法,但存在试剂要求多、反应时间长和有污染等方法自身的缺点,不利于大规模工业生产。
本实验采用以二甲基亚砜为溶剂,以环戊二烯、氯化亚铁和氢氧化钾为原料进一步反应得到粗产物,然后用石油醚萃取混合液来提纯二茂铁。
8NaOH+2C2H6+FeCl2·4H2O=(C2H5)2Fe+2NaCl+6NaOH·H2O
该方法的有点是简化了环戊二烯脱质子步骤。
在本法中,氢氧化钠不仅用作脱质子试剂,还可作为干燥剂脱去原料中的水。
2、仪器与试剂
(1)仪器:
微型实验装置一套、熔点仪、氮气袋、磁力搅拌子、磁力加热搅拌器、真空干燥箱(2)试剂:
氮气钢瓶、乙二醇二甲醚(C.P)、二甲基亚砜(DMSO)(C.P)、氢氧化钾(A.R)、环戊二烯、FeCl4·H2O(A.R)、HCl(A.R)
3、实验步骤
(1)二茂铁的制备
安装好实验装置后,在25ml三颈烧瓶里放入磁子,一侧与氮气袋相连,另一侧与装有硅油的锥形瓶相连。
现在烧瓶中加入10ml乙二醇二甲醚和4.5g研磨细的KOH粉末,在通入氮气并缓慢搅拌的情况下加入1.3ml环戊二烯。
继续通入氮气,并控制氮气的通入量(硅油中氮气泡一个接一个匀速放出),以赶走烧瓶中的空气,同时将1.5g四水合氯化亚铁在5ml 二甲基亚砜,并转入分液漏斗中。
将混合物猛烈搅拌10min后,打开分液漏斗,控制适当的滴加速度使氯化亚铁的DMSO 溶液在45min左右加完。
滴加完毕后,关闭分液漏斗,在氮气保护下继续搅拌反应30min。
(2)二茂铁的分离与提纯
将混合液倒入100ml烧杯内,缓慢加入15ml 1:1(体积比)HCl,再加入20ml水,继续搅拌悬浮液15min,然后用玻璃砂漏斗抽滤产物,并用少量水洗涤产物3—4次,收集产物,铺在表面皿上,置于真空干燥器内干燥。
(3)产物的熔点测定
用熔点仪测定产物二茂铁的熔点。
4、实验现象与结果
三、结果与讨论
1、本实验所合成的二茂铁产量少,这与文献中使用该方法所合成的二茂铁产率为75-90%相比,本次实验产率较低,分析整个实验操作步骤,造成产率低的原因可能是:
(1).环戊二烯单体挥发损失;在实验中,通过加热环戊二烯二聚体分解得到环戊二烯单体,由而环戊二烯单体沸点仅为41℃,由于取用环戊二烯单体时间过早,导致挥发了一部分。
因为为了保证实验顺利开展,应当在完全准备好KOH等药品的情况下再取用环戊二烯单体;
(2). FeCl2·H2O部分被氧化;在本次实验中,取用的FeCl2·H2O相对于环戊二烯单体来说是过量,但由于FeCl2·H2O存放已久,同时在FeCl2·H2O研磨及溶解过程中也十分容易被空气所氧化,因此实际参与反应的二价铁的量并没有达到预算的量;
(3).氮气袋中途漏气;在实验中由于接口不良,发生漏气,在一段时间内没有使硅油中氮气气泡一个接一个冒出。
并且在加入环戊二烯后,其强烈的腐蚀性将橡皮管腐蚀,导致空气中氧气将较多的产品氧化。
2、纯度的检验
根据文献可知,其分子式为(C5H5)2Fe,分子量为186,外观为橙黄色针状或粉末状结晶,具有类似樟脑的气味,熔点173~174℃。
本实验中测得合成的二茂铁产物为土黄色的粉末,熔点为132-158℃,产物的外观和熔点都与文献有一定的差距,原因可能是:1.产物杂质较多,而造成杂质多的原因应该是在通氮气时,橡皮管被腐蚀,使氧气进入了反应体系,有副反应发生等,也有可能产物在洗涤时为洗净。
当然,测定熔点是对固体有机物质纯度检验的一种重要标准,但由于熔点测定时有很多因素会影响实验的结果,如升温速度、仪器响应速度、测试样品颗粒大小及用量等。
2.可能与反应的条件有关系,因为该反应需在无水无
氧的条件下进行,无水是因为反应中有KOH,会很快与水反应,而本身KOH又很容易吸潮,比较难控制,3.在加入四水合氯化亚铁溶于二甲基亚砜时,由于一开始溶解得很慢,因为加入的的固体本身比较大块,用了一定的时间去溶解它,在这个过程中,有不少的氧气已经把氯化亚铁氧化掉了,使得该颜色本来为绿色变为了橙色,并且在加入分液漏斗后出现了分层,这些细节方面都对该实验产生了一定的影响。
另外,文献当中也提到了,二茂铁在100℃时容易发生升华,必须在石蜡密封的管子里面测定,而这个实验条件是当时没有给的,因此在测定熔点的时候,发现薄的地方熔得较快,而稍微厚点的地方则一直保持着未能在一定温度范围内熔完,所以实验中熔点测定有所误差。
四、结论
本实验在氮气氛围、碱性条件下,用DMSO法合成二茂铁,制得产物的熔点为138-150℃。
五、参考文献
[1]徐兆瑜. 二茂铁的合成与应用. 杭州化工. 2001, 31(4): 34-38.
[2]崔小明. 二茂铁的合成及应用. 化学工业与工程技术. 2000, 21(6): 21-23.
[3]赵宏升. 二茂铁的合成. 四川化工与腐蚀控制. 1998, 1(3): 46-47.
[4]吴海霞, 朱晓苓. 二茂铁的合成与应用. 现代化工. 1993, 4: 34-35.。