国家创新医疗器械特别审批的项目45页PPT
- 格式:ppt
- 大小:5.82 MB
- 文档页数:45

XXXXX检测试剂盒(XXXXX法)4. 产品研发过程及结果的综述XXXXX有限公司目录4.1立项依据 (4)4.1.1背景介绍 (4)4.1.1.1全球的发病情况 (4)4.1.1.2中国的发病情况 (4)4.1.1.3临床现状 (4)4.1.1.4目前现有的检测技术 (4)4.1.1.5需要解决的关键点 (4)4.1.2项目概况 (4)4.2研发过程 (4)4.2.1项目设计开发策划阶段 (4)4.2.1.1必要性分析 (5)4.2.1.2可行性分析 (5)4.2.2项目设计开发输入阶段 (6)4.2.1.1依据的法律法规和标准 (6)4.2.1.2预期用途与技术原理 (6)4.2.1.3方法的选择 (6)4.2.1.4技术设计 (6)4.2.1.5工艺设计 (7)4.2.1.6性能要求设计 (7)4.2.1.7研发进度安排 (8)4.2.3项目设计开发输出阶段 (9)4.2.3.1小试阶段 (9)4.2.3.2中试阶段 (12)4.2.3.3试生产阶段 (15)4.2.4项目设计开发验证阶段 (16)4.2.5项目设计开发确认阶段 (17)4.2.5.1临床试用 (17)4.2.5.2临床试验 (1)4.3结果综述 (2)4.4参考文献 (3)4.1立项依据4.1.1背景介绍(介绍相关疾病情况如临床表现、发病机理、我国每年发病率等、检测技术或手段的临床现状、目前的检测手段存在的问题、需要解决的关键点等。
)4.1.1.1全球的发病情况4.1.1.2中国的发病情况4.1.1.3临床现状4.1.1.4目前现有的检测技术4.1.1.5需要解决的关键点4.1.2项目概况(简单介绍本项目的一些基本情况,如项目来源,立项背景,将来规划,临床意义等。
)4.2研发过程XXXXXX试剂盒的临床前研究从20XX年X月开始,至今已完成的研究工作分成如下五个阶段:●项目设计开发策划阶段●项目设计开发输入阶段●项目设计开发输出阶段●项目设计开发验证阶段●项目设计开发确认阶段4.2.1项目设计开发策划阶段4.2.1.1必要性分析(综述)4.2.1.2可行性分析(从技术可行性、临床可行性、市场可行性进行介绍。



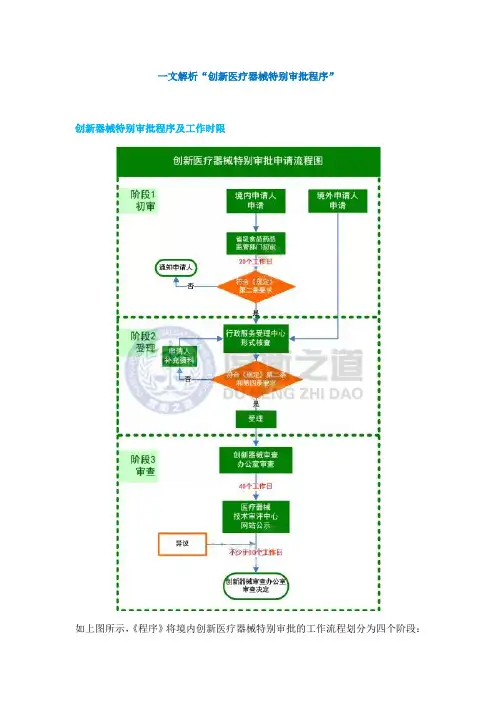
一文解析“创新医疗器械特别审批程序”创新器械特别审批程序及工作时限如上图所示,《程序》将境内创新医疗器械特别审批的工作流程划分为四个阶段:初审、受理、审查、公示;境外创新医疗器械特别审批的工作流程仅包含三个阶段:受理、审查、公示。
《程序》限定初审应于20个工作日内完成,审查应于40个工作日内完成,公示应≥10个工作日。
据此是否可以估算境内创新器械特别审批申请应在≤70个工作日内获得审查结果;境外创新医疗器械特别审批申请应在≤50个工作日内获得结论呢?可能还需考虑申请人提供信息有欠缺或进行补充资料的情况。
依据法规事务经验,在初审、受理、审查这三个环节,企业均面临补正资料或补充资料的可能。
但《程序》并未明确提及资料的补充、期限和复审期限。
其中,补充资料时间企业必须根据材料的缺失程度和补正所需周期估算。
此外,在《程序》中并未对受理以及资料流转给予时间限定。
依据现有要求,受理与流转时限为8个工作日。
但是由于这部分时间涉及到多个部门之间的交接问题,在同类情形中也出现过超出时限、难以推进的情况。
提请各位注意,对于境内创新医疗器械还需估算企业所在地省级食品药品监督管理部门的受理及结转的时限。
具体可参照当地的相关配套文件。
“创新特别审批”将给与企业哪些优待?我们将创新产品的上市划分为两个阶段:创新医疗器械特别审批申请阶段和创新医疗器械注册申请阶段。
第二阶段是建立在第一阶段基础上的。
这两个阶段《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)(以下简称《程序》)究竟为企业创造了哪些便捷和优待?请参见下图(以境内创新产品为例)。
此处要提请广大会员注意的是:在第一阶段中,《程序》给予企业最大的优待政策是在产品注册申请受理前以及技术审评过程中,指定专人,应申请人的要求及时沟通、提供指导,共同讨论相关技术问题。
沟通交流应形成记录,供该产品的后续研究及审评工作参考。
沟通内容至少涉及两个方面:一方面是审查产品的创新性;另一方面,也是创新企业的沟通重点,是在指定专人的条件下,就重大技术、安全、临床方案问题与技术审评中心在产品最终定型注册申请前进行充分的沟通和分步确认。

第二类医疗器械创新医疗器械特别审批中的体现临床应用价值的资料摘要:一、第二类医疗器械的定义和分类二、创新医疗器械特别审批的背景和意义三、临床应用价值在特别审批中的体现四、临床应用价值资料的具体要求和审查标准五、案例分析:某第二类创新医疗器械特别审批过程正文:一、第二类医疗器械的定义和分类根据我国《医疗器械监督管理条例》规定,医疗器械分为三类,其中第二类医疗器械是指对人体具有潜在危险,需要严格控制其安全性、有效性的医疗器械。
这类医疗器械包括心脏起搏器、人工关节、人工晶体等。
二、创新医疗器械特别审批的背景和意义为了鼓励医疗器械研究和创新,支持新技术的推广和应用,国家食品药品监督管理局(CFDA)于2014 年发布了《创新医疗器械特别审批程序》。
该程序旨在加快创新医疗器械的审批速度,缩短患者等待治疗的时间,提高患者的生活质量。
三、临床应用价值在特别审批中的体现在第二类医疗器械创新医疗器械特别审批中,临床应用价值是重要的评审依据。
具体体现在以下几个方面:1.产品能否解决临床急需,提高疾病诊断、治疗或预防效果;2.产品是否具有显著的临床优势,如安全性、有效性、便利性等;3.产品是否有助于推动医疗器械产业发展和技术进步。
四、临床应用价值资料的具体要求和审查标准在申请创新医疗器械特别审批时,申请人需要提交临床应用价值的资料,包括:1.产品的临床应用背景和需求;2.产品的临床研究方案和已完成的研究成果;3.产品的临床效果和安全性评估;4.产品的市场前景和临床推广策略。
审查标准方面,CFDA 主要从临床急需、显著临床优势、推动产业发展和技术进步等方面进行评估。
五、案例分析:某第二类创新医疗器械特别审批过程以某公司研发的人工心脏瓣膜为例,该产品通过特别审批程序,成功获得了上市许可。
在审批过程中,该公司充分展示了产品的临床应用价值,包括:1.人工心脏瓣膜能够有效替代受损心脏瓣膜,治疗心脏瓣膜疾病;2.产品具有优良的生物相容性和耐久性,降低了患者术后并发症风险;3.产品采用了创新的设计理念和技术,提高了手术成功率。





【创新医疗器械特别审查公示总结】一、引言创新医疗器械是指具有创新性、独特性、高技术含量和高风险的医疗器械产品,因此在审查上也具有一定的特殊性。
近期,国家药监局发布了一批创新医疗器械特别审查公示,这些产品涉及到多个领域,包括医疗影像、介入治疗、体外诊断、植入材料等。
本文将就此进行全面评估和总结,以期深入了解创新医疗器械特别审查的相关内容。
二、创新医疗器械特别审查内容概述根据公示内容,这批创新医疗器械产品涉及的技术创新点较为突出,包括但不限于:新的设计理念、新的材料应用、新的技术手段等。
这些创新点在一定程度上带来了医疗器械在临床应用中的效果提升和安全性增强,对患者的治疗和康复产生了积极的影响。
三、创新医疗器械特别审查公示部分产品总结1. 医疗影像领域在医疗影像领域,一些创新医疗器械产品在影像成像清晰度、对比度以及辐射剂量等方面有了明显改进。
其中,部分产品采用了先进的影像重建技术,使得影像在诊断上更加精准可靠,极大地提升了临床影像诊断的准确性。
2. 介入治疗领域在介入治疗领域,一些创新医疗器械产品在操作便捷性和治疗效果上取得了显著突破。
对于某些疾病,这些产品能够实现微创、精准治疗,大大降低了手术风险和患者的痛苦,也提高了治疗的成功率。
3. 体外诊断领域在体外诊断领域,一些创新医疗器械产品在检测灵敏度和特异性上有了显著提升。
新型的检测技术不仅能够提供更为准确的诊断结果,还能够缩短检测时间,为临床诊断提供更为及时的依据。
4. 植入材料领域在植入材料领域,一些创新医疗器械产品在生物相容性和植入效果上取得了明显进展。
这些新型材料不仅能够更好地与人体组织相融合,还能够释放药物以实现更好的治疗效果,为患者的康复带来了更多的希望。
四、个人观点和理解共享在我看来,创新医疗器械的特别审查十分重要。
创新医疗器械产品的推出可以为医疗行业注入新的活力,带来更多更好的治疗选择;另专门的审查机制也能够确保这些创新产品的安全性和有效性,为患者提供更多的保障。