过渡金属钯、镍催化的碳-碳键偶联反应
- 格式:pdf
- 大小:98.57 KB
- 文档页数:2

碳碳键偶联人名反应一、引言碳碳键偶联人名反应是有机化学中的一种重要反应,它可以将两个碳原子通过共价键连接起来。
该反应在有机合成中具有广泛的应用,可以用于构建复杂的分子结构,如天然产物和药物。
本文将介绍碳碳键偶联人名反应的基本概念、机理和实际应用。
二、基本概念碳碳键偶联人名反应是指通过催化剂促进两个烷基或芳香族基之间形成新的碳-碳键的化学反应。
这种反应可以在不同的条件下进行,如常温下或高温下,在溶液中或固体中。
常见的催化剂包括钯、铜、镍等金属催化剂,以及硼酸类和亚磷酸类配体。
三、机理1. 钯催化剂钯催化剂是最常用的催化剂之一,它可以促进烷基或芳香族基之间形成新的碳-碳键。
钯催化剂通常与亚磷酸配体或氧杂环丁烷配体一起使用,以增强其活性和选择性。
反应的机理包括以下几个步骤:(1)钯催化剂与亚磷酸配体或氧杂环丁烷配体形成活性物种;(2)活性物种与底物发生配位作用,形成中间体;(3)中间体发生还原消除,生成新的碳-碳键;(4)催化剂再次被氧化,回到起始状态。
2. 铜催化剂铜催化剂也可以促进烷基或芳香族基之间形成新的碳-碳键。
铜催化剂通常与二甲基亚磷酸钠或三甲基膦一起使用,以增强其活性和选择性。
反应的机理包括以下几个步骤:(1)铜催化剂与二甲基亚磷酸钠或三甲基膦形成活性物种;(2)活性物种与底物发生配位作用,形成中间体;(3)中间体发生还原消除,生成新的碳-碳键;(4)催化剂再次被氧化,回到起始状态。
四、实际应用碳碳键偶联人名反应在有机合成中具有广泛的应用,可以用于构建复杂的分子结构,如天然产物和药物。
以下是一些实际应用的例子:1. Suzuki偶联反应Suzuki偶联反应是一种常见的碳碳键偶联反应,它可以将芳香族卤化物与有机硼酸酯或有机硼酸盐在钯催化下发生交叉偶联反应,生成新的芳香族化合物。
该反应在药物合成中广泛应用。
2. Heck偶联反应Heck偶联反应是一种将芳香族或烷基卤化物与烯烃在钯催化下发生偶联反应的方法。


钯催化构筑天然产物【摘要】过渡金属钯在金属有机化学方面具有丰富的反应性, 用作催化剂具有高效率、用量少、选择性高等优点, 钯催化剂在有机合成中的应用有着举足轻重的地位, 由于钯催化剂的新应用, 有机合成领域出现了很多新的合成工艺、合成产物等[1]。
本文在查阅文献的基础上,对钯催化C-C, C-N键偶联构筑天然产物进行了概述。
【关键词】钯催化C-C, C-N键偶联1.钯催化C-C偶联构筑天然产物钯催化的交叉偶联反应金属钯催化的交叉偶联反应是最有效的形成C-C键的方法之一。
经过30多年来的发展,已经实现了各种卤代芳烃及酚类衍生物与各种有机金属试剂及不饱和烃类化合物的交叉偶联反应,如Heck偶联反应,Negishi偶联反应,Stille偶联反应,Kumada偶联反应,Ullmann 偶联反应,以及Suzuki-Miyaura偶联反应。
这类偶联反应已广泛应用于天然产物、生理活性化合物以及有机电子材料的合成中,并已实现了产业化应用。
基于该方法学在有机合成及材料合成领域的杰出贡献,Heck,Suzuki和Negish等三位科学家获得了2010年诺贝尔化学奖。
虽然金属钯催化的交叉偶联反应得到了蓬勃的发展,但在提高催化反应的催化活性、降低催化剂用量、实现温和的反应条件、扩大反应原料的适用性等方面仍是具有挑战性的研究课题。
1.1.1 Mizoroki-Heck反应Mizoroki和Heck分别于1971和1972年发现了一类重要的形成与不饱和双键相连新的C-C 键的反应,故称作Mizoroki-Heck反应。
此类反应在过去的40多年中已经逐渐发展成为一种应用日益广泛的有机合成方法,Heck反应机理如下(Scheme 1)。
Mizoroki-Heck反应是合成具有各种取代基的不饱和化合物最为有效的方法之一。
由于它具有广泛的底物适用性和对许多官能团有好的兼容性,因此,被广泛的应用于新药合成、染料以及有机发光料等领域。

有机合成反应的催化剂和方法有机合成反应是有机化学中的重要内容,它涉及到合成有机化合物的方法和催化剂选择。
催化剂在有机合成反应中起着至关重要的作用,能够加速反应速率、提高产率和选择性。
本文将介绍几种常见的有机合成反应的催化剂和方法。
一、金属催化剂金属催化剂在有机合成反应中应用广泛。
其中,过渡金属催化剂是最常见的一类。
它们能够通过配位或氧化还原反应参与反应过程,并提供一个活性中心,促进反应进行。
常见的过渡金属催化剂包括钯、铑、铂、铜等。
以钯催化的反应为例,钯催化的氢化反应是有机合成中的重要反应之一。
钯催化的氢化反应可以将不饱和化合物转化为饱和化合物,常用于合成药物、香料和高分子材料等。
此外,钯催化的交叉偶联反应也是有机合成中的重要方法之一,可以将两个不同的有机物通过碳-碳键的形成连接在一起。
二、酶催化酶是一类具有生物催化活性的蛋白质,能够在温和条件下催化特定的有机反应。
酶催化在有机合成中具有很高的选择性和效率。
例如,脱氢酶可以催化醇的氧化反应,将醇转化为酮或醛。
这种反应在合成药物和香料中广泛应用。
另外,酶催化的不对称反应也是有机合成中的研究热点,可以合成具有手性的有机分子。
三、非金属有机催化剂除了金属催化剂和酶催化外,还有一类非金属有机催化剂也在有机合成中发挥重要作用。
它们通常是有机小分子化合物,能够通过氢键、离子键或共价键与底物反应,催化反应进行。
非金属有机催化剂具有底物广泛性、高效性和可重复使用性的优点。
例如,有机碱是一类常见的非金属有机催化剂。
它们可以催化酯的加成反应、酰基转移反应和酯的酯交换反应等。
此外,有机酸也是一类常用的非金属有机催化剂,可以催化醇的酯化反应和酸催化的环化反应等。
四、辅助剂的应用在有机合成反应中,还常常使用一些辅助剂来提高反应效率和选择性。
辅助剂可以改变反应体系的酸碱性、溶剂极性和反应条件等,从而促进反应进行。
常见的辅助剂包括溶剂、碱和还原剂等。
溶剂的选择对反应速率和产率有很大影响。

卤代芳烃的c-c键耦合反应
卤代芳烃的C-C键耦合反应是一种在有机合成中构建新的碳碳键的重要方法。
这类反应通常涉及到过渡金属催化,尤其是钯催化剂,在卤代芳烃或卤代烯烃与另一分子(如烯烃、炔烃、硼酸或有机锌试剂等)之间形成新的C-C键。
以下是几种常见的卤代芳烃C-C键耦合反应:
1. Heck反应:这是一种卤代芳烃或卤代烯烃与烯烃在碱和钯催化下生成取代烯烃的反应。
2. Suzuki偶联反应:在这个反应中,卤代芳烃与活化的硼酸在钯催化剂作用下发生偶联,生成联苯类化合物。
这个反应对水不敏感,可以容忍多种活性官能团存在,并且副产物无毒且易于除去,适合工业化生产。
3. Negishi偶联反应:这是卤代芳烃与有机锌试剂在钯催化剂作用下进行的偶联反应,适用于一些其他方法难以偶联的底物。
4. 亲电交叉偶联反应:这种反应可以在两个不同亲电试剂间发生,通常是在电化学条件下,通过阴极还原生成碳负离子,然后与另一亲电试剂发生偶联。
此外,在选择耦合反应时,需要考虑底物的活性、位阻效应以及电子效应。
一般来说,碘代和三氟甲磺酸盐的活性较高,溴代次之,氯代最低。
对于贫电子的卤代芳烃,可能需要过量使用以提高反应效果。
总的来说,这些耦合反应由于条件温和、效率高,已经成为有机合成中不可或缺的工具,广泛应用于药物合成、材料科学等领域。


钯催化的反应总结引言钯(Palladium,Pd)是一种常见的过渡金属催化剂,它在有机合成中有着广泛的应用。
由于钯具有良好的催化活性、选择性和功能多样性,钯催化反应已成为有机合成领域备受关注的重要研究方向之一。
本文将对钯催化的一些重要反应进行总结,以便更好地了解和应用这些反应。
催化剂的选择在钯催化反应中,催化剂的选择起着至关重要的作用。
常见的钯催化剂包括[Pd(PPh3)4]、Pd(PPh3)2Cl2、Pd(OAc)2等,这些催化剂具有良好的催化性能和稳定性。
此外,还可以通过对催化剂进行配体修饰来改变其催化性能,如引入膦配体、氨基配体等。
钯催化的碳-碳键形成反应1. Heck反应Heck反应是钯催化的一个重要的碳-碳键形成反应,它通过亲电性或亲核性的烷基化试剂与不饱和化合物间的交叉偶联,在构建碳-碳键的同时保留官能团的特点。
通常情况下,该反应需要碱的存在,并在乙酸盐氛围中进行。
Heck反应适用于合成各类芳香烃、乙烯烃、酮类等化合物。
2. Suzuki-Miyaura偶联反应Suzuki-Miyaura偶联反应是钯催化的另一个重要的碳-碳键形成反应。
该反应利用有机硼酸酯与卤代化合物在碱的存在下进行交叉偶联,生成对应的芳香烃。
Suzuki-Miyaura偶联反应具有底物宽容性和功能团兼容性高的优点,被广泛应用于有机合成中。
钯催化的碳-氮键形成反应1. Buchwald-Hartwig氨基化反应Buchwald-Hartwig氨基化反应是钯催化的一种重要的碳-氮键形成反应,可以将芳香或烯丙基溴化物与氨或胺类化合物发生反应,生成相应的胺化物。
该反应具有反应条件温和、底物宽容性好的特点,被广泛应用于药物合成和天然产物的合成等领域。
2. Sonogashira偶联反应Sonogashira偶联反应是钯催化的一种重要的碳-氮键形成反应,它通过芳香溴化物或卤代烯烃与炔烃发生偶联反应,生成相应的炔烃衍生物。
Sonogashira偶联反应具有底物宽容性好、反应条件温和的特点,被广泛应用于有机合成中。

不对称还原偶联综述
不对称还原偶联是一种重要的有机合成方法,它在有机化学领
域具有广泛的应用。
该反应通过催化剂的作用,将两种不同的有机
物分子进行偶联,生成对称或不对称的有机产物。
这种反应通常涉
及到过渡金属催化剂的运用,如钯、铑、镍等。
不对称还原偶联反
应可以实现对手性化合物的合成,因此在医药和农药等领域具有重
要意义。
不对称还原偶联反应的机理通常涉及到催化剂与底物的配体结合,形成一个活性的过渡金属催化剂,然后通过还原和偶联的步骤,将底物分子连接起来,生成目标产物。
这种反应的优势在于可以高
效地构建碳-碳、碳-氮、碳-氧等键,从而实现复杂有机分子的合成。
从应用角度来看,不对称还原偶联反应在药物合成、天然产物
合成、材料科学等领域都有重要的应用。
通过该反应,可以高效合
成具有生物活性的化合物,从而为药物研发提供了重要的手段。
同时,该反应也被广泛用于合成手性配体、农药、光电材料等领域。
此外,不对称还原偶联反应也面临着一些挑战,如催化剂的设计、反应条件的优化、底物的选择等方面的问题。
因此,对该反应
的研究仍然具有重要的意义,可以进一步拓展其在有机合成领域的
应用。
总的来说,不对称还原偶联反应作为一种重要的有机合成方法,具有广泛的应用前景和研究价值,对其进行深入研究和探索将有助
于推动有机合成化学领域的发展。

金属钯催化的碳-碳偶联反应中文在有机化学中,C-C键的形成是有机合成研究的重要内容,而纳米过渡金属催化的偶联反应则是形成C-C键的一种有效手段。
在经典的纳米过渡金属催化的C-C偶联反应的基础上,我们不断寻找新的催化剂,优化反应体系,以期使传统的C-C偶联反应达到更好的效果。
本文中,我们采用一种新的磁性纳米Pd/Fe3O4/s-G催化剂,利用一锅法从芳胺衍生物出发,通过对反应条件的优化,分别采用亚硝酸叔丁酯和BF3•Et2O为重氮化试剂和添加剂,在甲醇溶剂中保持60 ℃反应5小时,经过重氮化/Suzuki偶联反应,成功实现了芳胺与芳基硼酸衍生物的交叉偶联反应。
该反应是对经典Suzuki反应的有益补充,同时也为联芳基类化合物的形成提供了新的论文方法。
与此同时,我们对新的磁性纳米Pd催化剂的循环实验进行了研究,结果表明,该催化剂能够重复使用4次并且保证催化效率基本不变,且易于通过磁性分离进行回收。
近几年来,非活性的C-H键官能化反应一直是有机化学中的研究热点。
虽然在C-H活化方面各国的研究学者已经取得了很大进展,但是将C-H键直接转化成C-C、C-X、C-N、C-O、C-S 键等,仍然是具有挑战性的课题。
虽然已有多种官能团被用于导向的C-H键活化,但Pd催化的以乙酰基为导向基团的C-H活化反应目前仅有过一例报道。
在本文中,我们以芳香酮类化合物和烯烃为底物,以Pd(OAc)2为催化剂,Cu(OAc)2•H2O为氧化剂,完成了酰基邻位sp2 C-H键活化氧化Heck反应。
该反应是导向的氧化C-H官能化反应的一个新的发展。
译文In the field of organic chemistry, the formation of C-C is an important content of organic synthesis, while the nano transition-metal-catalyzed cross-couplings are the effective measures of the formation of C-C. In the basement of classical C-C cross-couplings, we keep looking for new catalysts and optimizing reaction systems in order to make traditional C-C cross-couplings to achieve better effect. In this article, a new, magnetic Pd/Fe3O4/s-G-catalyzed one-pot diazotization/cross-coupling of anilines and arylboronic acids has been developed. Through the on-going optimation of our reaction, we at last choose tBuONO as diazo reagent and BF3•Et2O as the additive. The experiments are conducted in MeOH at sixty degrees celsius and the reaction time is five hours. This process complemented the traditional Suzuki cross-couplings and provided a more economic approach for the preparation of biaryl products. At the same time, we have also studied the cycle test of our new catalyst. It turned out that this kind of catalyst can be reused four times and the effect is largely unchanged. The recycling of the catalyst is very convenient through magnetic separation. In recent years, the activation of inact C-H has been the researchfocus of organic chemistry. Although there has been great progress on the activation of C-H around the world, we still face huge challenges in transforming C-H to C-C, C-X, C-N, C-O, C-S directly. There is only one case of Pd-catalyzed reactions about the activation of C-H with acetyl as the directing group though a lot of functional groups have been used in directed C-H activation. In this article, Pd(OAc)2 and Cu(OAc)2•H2O are served as the catalyst and oxidant separately. We use aromatic ketone derivatives and olefins as our reaction substrates and achieve the ortho-activation of sp2 C-H and oxidative Heck reaction smoothly. This is a new development of directed and oxidative functionalization of C-H.。

有机合成新反应(过渡金属催化的偶联反应、有机催化)新型有机合成反应的发展是有机化学研究领域的热点之一。
随着近年来对过渡金属催化的偶联反应和有机催化反应的探索与发展,不断涌现出一系列高效、可持续、绿色的有机合成新反应。
本文将介绍其中两个典型的有机合成新反应,并探讨它们的机理和应用前景。
过渡金属催化的偶联反应是有机化学领域中一类重要的反应,通过过渡金属催化剂的介入,实现两个或多个不同化学结构的有机物分子之间的反应。
这种反应常常具有高效、高选择性和原子经济性等优点,已经成为合成复杂有机分子的重要工具。
首先介绍一种近年来备受关注的偶联反应——钯催化的C-C键形成反应。
这种反应常常通过活化碳-碳或碳-氢键,并以钯为催化剂,实现亲核试剂与电子缺陷位的有机物之间的偶联。
这种反应以其高效率和广泛的底物适用性而闻名。
例如,钯催化的Suzuki偶联反应和Heck反应是两个具有重要实用价值的反应,它们广泛应用于药物合成、天然产物合成和材料科学等领域。
钯催化的Suzuki偶联反应是以有机硼酸酯和有机卤化物为底物的偶联反应。
在催化剂的作用下,有机硼酸酯与有机卤化物发生交叉偶联,生成C-C键连接的偶联产物。
这种反应具有选择性高、反应底物适应性强和底物制备容易等特点。
例如,通过Suzuki偶联反应合成的芳香化合物广泛应用于药物和农药的制备。
Heck反应则是以有机酸为底物的偶联反应。
在钯催化剂的作用下,有机酸与烯烃发生偶联反应,生成具有新的碳-碳键连接的产物。
Heck反应具有反应条件温和、底物适应性广和反应效率高等特点。
该反应在合成天然产物和制备有机光电器件上具有重要应用。
与过渡金属催化的偶联反应相比,有机催化反应则更多地利用了有机小分子作为催化剂,实现有机物分子之间的转化。
有机催化反应以其高立体定向性、高效率和低成本等优点备受关注。
近年来,有机催化领域中的不对称催化反应是一个研究的热点。
这类反应通过立体选择性催化剂的介入,实现底物不对称转化。
交叉偶联反应的类型1.引言1.1 概述交叉偶联反应(Cross-coupling reaction)是一类重要的有机合成反应,它可以在两个或更多的有机分子之间建立键合,形成新的混合物。
在交叉偶联反应中,通常会使用过渡金属催化剂来引发反应,并使反应发生在选择性、高效的条件下。
交叉偶联反应源于20世纪70年代的发现,由于其广泛的应用领域和高度的化学选择性,成为了有机合成领域中的重要工具之一。
不仅可以构建碳-碳键,还可以构建碳-氮键、碳-氧键等重要的化学键。
它不仅可以用于药物合成、材料化学、天然产物合成等多个领域,还可以通过调整反应条件和催化剂选择,实现对底物的高度选择性修饰。
交叉偶联反应的类型繁多,常见的包括苯基-锌、叠氮-钯、硼基-钯、锡基-钯等反应类型。
每种类型的反应都有其独特的特点和应用领域,具体选择哪种类型的反应也需要根据具体的研究目的和底物结构来确定。
本文将详细介绍交叉偶联反应的各种类型,并重点阐述它们的反应机理、优缺点以及在有机合成中的应用。
通过对不同类型交叉偶联反应的比较和分析,有助于读者更好地理解和掌握这一重要的有机合成工具。
为了更好地组织内容,下文将根据各个类型的交叉偶联反应进行分类和详细介绍。
1.2 文章结构文章结构部分的内容可以按照以下方式编写:文章结构本文共分为引言、正文和结论三个部分。
引言部分概述了交叉偶联反应的背景和意义,介绍了文章的结构和目的;正文部分详细阐述了两种交叉偶联反应类型的要点;结论部分对全文进行总结,并对未来的研究方向进行展望。
正文部分按照交叉偶联反应类型分为两个小节,分别介绍了交叉偶联反应类型1和类型2。
每个小节中又分别列出了要点1和要点2,以便更好地说明交叉偶联反应的特点和应用。
通过以上结构的安排,本文能够完整而清晰地呈现交叉偶联反应的类型及其相关要点,使读者能够更好地理解和掌握这一研究领域。
目的部分的内容可以按照以下方式进行撰写:1.3 目的本文的目的是探讨交叉偶联反应的类型。
ni催化c-c键活化反应
催化C-C键活化反应是一种重要的有机反应,用于将两个碳原子之间
的C-C键进行断裂或变换。
这种反应通常由催化剂催化或促进。
目前有许多催化剂被发现可以催化C-C键活化反应,包括过渡金属催
化剂、有机催化剂和生物催化剂等。
过渡金属催化剂通常是有机金属化合物,可以通过形成过渡态来降低
反应活化能,从而促进C-C键的活化。
其中一些常用的过渡金属催化
剂包括钯、铜、铂、铁等。
有机催化剂是一类能够提供亲电中心或亲核中心的有机分子,可以通
过中间体的形成来催化C-C键活化反应。
例如,路易斯酸、路易斯碱、质子酸等都可以用作有机催化剂。
生物催化剂是一类来源于生物体的酶或其他催化剂,可以在温和的条
件下实现C-C键活化。
其中一些常见的生物催化剂包括酮酸还原酶、
羟酸脱氢酶、巴比妥酸羧化酶等。
催化C-C键活化反应可以实现一系列有机化合物的转化和合成,具有
重要的应用价值。
例如,通过C-C键活化反应可以实现碳骨架的构建、功能团的引入等,从而提供了合成有机化合物的新途径。
钯-铜催化偶联反应构建C-C、C-N键的新体系研究钯/铜催化偶联反应构建C-C、C-N键的新体系研究近年来,催化偶联反应成为合成有机化学领域的热点研究课题之一。
催化偶联反应可以构建C-C键和C-N键,为合成复杂有机分子提供了有效的方法。
然而,传统的偶联反应常常存在底物限制、选择性差和废物产生等问题。
因此,寻找新的高效、高选择性的催化剂成为当今有机合成领域的迫切需求。
近年来,钯/铜催化体系引起了广泛的关注。
钯是一种重要的过渡金属催化剂,具有良好的活性和选择性。
然而,由于其高价格和有毒性,通过钯/铜催化体系可以减少钯用量,降低成本,并且更环保。
因此,钯/铜催化体系被广泛应用于构建C-C、C-N键的偶联反应中。
研究人员在钯/铜催化体系中设计了多种有机反应,成功地构建了C-C、C-N键。
其中,一种常用的催化体系是钯催化芳香碳氢键的交叉偶联反应,也称为Suzuki-Miyaura偶联反应。
这种反应以芳香卤代烃和芳香硼酸酯为底物,通过钯催化降解和重构的过程,实现了C-C键的构建。
该反应具有宽广的底物适用性和高度的官能团容忍性,在有机合成中得到了广泛应用。
除了C-C键的构建,钯/铜催化体系还可用于C-N键的偶联反应。
其中一种典型的反应是钯催化的碱性氧化还原反应。
该反应以芳香硝基化合物和芳香胺为底物,经过钯催化的氧化还原过程,实现了C-N键的构建。
这种反应也被广泛应用于有机合成中,可以高效合成各种含氨基的有机分子。
近年来,研究人员还开发了一系列新的钯/铜催化体系,用于合成具有药物活性的复杂有机分子。
例如,钯/铜催化的碘化合物的交叉偶联反应可用于合成具有抗肝癌活性的小分子化合物。
此外,钯/铜催化体系还可用于合成手性分子,用于药物合成中的不对称合成,具有重要的应用前景。
总之,钯/铜催化体系在构建C-C、C-N键的偶联反应中发挥着重要的作用。
该体系具有高效性、高选择性和底物广泛适应性等优点,为合成复杂有机分子提供了一种可行的方法。
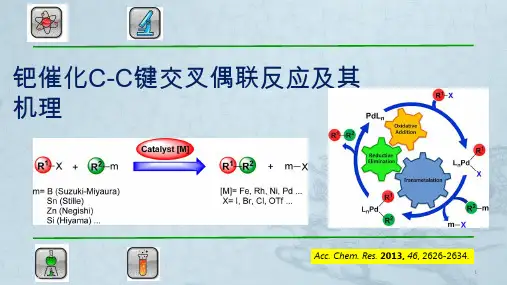
钯催化的碳—碳偶联反应研究简介作者:陶凤来源:《科技创新与应用》2016年第15期摘要:在有机化学中,C-C键的形成是有机合成研究的重要内容,而过渡金属钯催化的偶联反应则是形成C-C键的一种有效手段。
目前钯催化的偶联反应已在科研、医药生产等领域得到广泛应用。
偶联反应的种类较多,文章主要内容是简单介绍过渡金属钯在以下几种碳碳偶联反应以及合成中的应用。
关键词:钯催化;碳-碳键;偶联反应前言与一般催化剂相同,过渡金属催化的有机反应也只是改变了化学反应的速度,降低了反应的活化能,使原来难于发生的反应变得容易进行。
过渡金属催化的有机反应常常具有很高的选择性,这种选择性决定了其在未来的偶联反应中具有更广阔的发展空间,概括其选择性主要有以下几点:包括化学选择性、区域选择性和立体选择性。
文章以下便针对常用的几种偶联反应进行简要分析。
1 常用偶联反应简介1.1 Stille偶联反应Stille偶联反应是有机锡化合物和不含β-氢的卤代烃(或三氟甲磺酸酯)在钯催化下发生的交叉偶联反应。
其机理最初就是由Stille根据转金属复合物的决速步骤而提出的四步循环机理。
四(三苯基膦)合钯(0)是最常用的钯催化剂。
对于Stille交叉偶联反应还有一个有趣的现象就是添加物对这个反应有很大的影响,尤其是铜的添加物,对反应起着很大的作用,在反应过程中Cu与反应媒介生成了更加活泼的铜媒介,使得反应更易发生。
1.2 Negishi偶联反应Negishi交叉偶联反应有机锌试剂与卤代烃在钯配合物的催化下发生偶联反应,生成新的碳-碳键。
最早的报道见于1977年,这个反应可以进行Csp3-Csp2,也可以进行Csp3-Csp3之间进行的碳-碳键偶联。
反应整体上经过了卤代烃对金属的氧化加成、金属转移与还原消除这三步。
这个反应的卤代物的活性顺序为Zn>Mg>>Li。
对于锌试剂在温和条件下就能发生反应。
与格式试剂相比,锌试剂在官能团容忍度上更胜一筹。
钯催化的碳氢活化反应进展[摘要]:碳-碳键构筑是有机合成化学的重要研究内容。
过渡金属催化的有机合成反应是碳-碳键形成的重要方法,已经得到了深入研究并成为广泛被使用的构筑碳-碳键的有利工具。
例如,过渡金属催化的Heck反应、Suzuld-Miyaura偶联反应、Stille偶联反应和Sonogashira偶联反应等。
然而,这些反应都需要对底物进行卤化或金属化等预活化步骤,因此过渡金属催化的由C-H键直接构筑C-C 键的方法就成为高效构筑C-C键的有效途径,相关研究引起了人们的极大兴趣,成为当前有机合成的研究热点。
碳氢键的反应活性和反应选择性是相关研究的关键所在。
[关键词]:C-H键活化钯催化分子内分子间一、概述过渡金属催化的交叉偶联反应是现代有机合成的重要工具。
利用交叉偶联反应可以高效高选择性地构建碳-碳键、碳-杂键等化学键。
然而,这些传统偶联反应都是基于官能团之间的转化,参与反应的底物( 如有机金属试剂与芳基或烯基卤代物、拟卤代物等) 均需要经过预先制备或者预先活化,因此整个过程既不原子经济也不绿色。
碳-氢键是构成有机化合物的最基本化学键之一。
直接利用C-H键选择性地官能团化是有机化学家们长期追求的目标。
由于C-H键具有较高的键能、相对稳定且极性很小等基本结构特征,直接地官能团化遇到的第一个问题就是反应活性很低。
另外,同一个有机化合物分子内通常有很多种化学性质不同的C-H键,如何实现其中的某一类C-H键的转化而不影响分子中其它的C-H键和官能团,这就涉及到C-H键活化过程中的选择性问题。
C-H键活化,就是在一定的条件下,对一种有机化合物中的某一C-H键反应性增强或切断实现定向化学转化。
碳氢活化反应既可以发生在分子内进行,也可以发生在分子间。
分子内的碳氢活化反应由于体系对反应位置自由度的限制使得反应具有区域选择性(Scheme 1.1)。
分子间碳氢活化反应由于催化剂和C-H键反应的时候具有更大的自由度使得该类型反应有更大的挑战性(Scheme 1.2)。