钯催化反应中的人名反应
- 格式:ppt
- 大小:621.50 KB
- 文档页数:59

人名反应1氧化:1・Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯〉甲基〉氢2・Corey-Kim氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3・Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4・Criegee臭氧化:烯烃臭氧化后水解成醛酮5・Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6・Dess—Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7・Fleming氧化•硅烷经过酸化,过酸盐氧化,水解以后形成醇8・Hooker氧化:2—羟基一3烷基一1,4—醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9・Moffatt氧化(Pfitzner—Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10・Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11・Riley氧化:活泼亚甲基(羰基a位等)被SeO2氧化成酮12・Rubottom氧化:烯醇硅烷经过m—CPBA和K2CO3处理后a—羟基化KHCO3氧化成醇13・Sarett氧化:CrO3・Py络合物氧化醇成醛酮14・Swern氧化:用(COC1)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15・Tamao—Kumada氧化:烷基氟硅烷被KF,H2O2,16・Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1・・Barton—McCombie去氧反应:从相关的硫羰基体中间用n—Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2・Birch还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基:带吸电子基团的苯环,取代基在烯丙位。
)3・Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4・Cannizzaro歧化:碱在芳香醛,甲醛或者其他无a—氢的脂肪氢之间发生氧化还原反应给出醇和酸5・Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6・Corey—Bakshi—Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7・Gribble吲哚还原:用NaBH4直接还原会导致N—烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8・Gribble二芳基酮还原.用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9・Luche还原:烯酮在NaBH4—CeCl3下发生1,2—还原形成烯丙位取代烯醇10・McFadyen—Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein—Ponndorf—Verley还原:用Al(OPr')3/Pr'OH体系将酮还原为醇12・Midland还原:用B—3—a—蒎烯一9—BBN对酮进行不对称还原13・Noyori不对称氢化.羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14・Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15・Wolff—Kishner—黄鸣龙还原.用碱性肼将羰基还原为亚甲基成烯反应:1・Boord反应:B-卤代烷氧基与Zn作用生成烯烃2・Chugaev消除:黄原酸酯热消除成烯3・Cope消除:胺的氧化物热消除成烯烃4・Corey-Winterolefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5・Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6・Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7・Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8・Peterson成烯反应:从a-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9・Ramberg-Backlund烯烃合成:A-卤代砜用碱处理生成烯烃10・Witting反应:羰基用膦叶立德变成烯烃11・Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro—Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg—Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F—或者OH—之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind—Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry偶联•羰基用低价Ti,如TiC13/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille—Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和a—卤代酯和Zn反应得到B—酮酯Benzoin缩合:芳香醛经CN—催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为B—酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃》然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从a—卤代酯和羰基化合物生成a,B—环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evansaldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi—Thorpe缩合(2—吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2—吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对a,B-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki—Hiyama—KIshi反应:Cr—Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和B—酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应.有机Zn试剂(从a—卤代酯来)对羰基的亲核加成反应Reimer—Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正不稳定的叶立德和醛发生的Witting反应生成Z—烯烃,而改进的Schlosser反应可以得到E—烯烃Stetter反应(Michael—Stetter反应):从醛和a,B—不饱和酮可以得到1,4—二羰基衍生物。

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。

人名反应1氧化:1.Baeyer-Villiger 氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化: 醇在NCS/DMF 作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4 氧化成羰基化合物4.Criegee臭氧化: 烯烃臭氧化后水解成醛酮5.Dakin 反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin 过碘酸酯氧化: 仲醇由过碘酸酯氧化成酮7. Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8. Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4 氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt 氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO 氧化醇,形成醛酮10.Oppenauer氧化: 烷氧基催化的仲醇氧化成醛酮11. Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12. Rubottom氧化:烯醇硅烷经过m-CPBA 和K2CO3处理后α-羟基化13.Sarett 氧化: CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N 淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada 氧化:烷基氟硅烷被KF,H2O2,KHCO3 氧化成醇16.Wacker 氧化: Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie 去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na 单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro 歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble 吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN 在冰醋酸当中还原吲哚双键可以解决8.Gribble 二芳基酮还原:用NaBH4 在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9. Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley 还原:用Al(OPr')3/Pr 'O体H 系将酮还原为醇12.Midland 还原:用B-3-α-蒎烯-9-BBN 对酮进行不对称还原13. Noyori 不对称氢化:羰基在Ru(II)BINAP 络合物催化下发生不对称氢化还原14. Rosenmund还原:用BaSO4/毒化Pd 催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn 作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin 烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme 丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons 反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting 反应简单的多7.Julia-Lythgoe 成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α - 硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting 反应9.Ramberg-Backlund 烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting 反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联: 芳基炔合成,同Cadiot-Chodkiewicz 偶联Eglinton 反应:终端炔烃在化学计量 (常常过量) Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联: Cu 催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck 反应: Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck 反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck 反应Hiyama 交叉偶联反应:Pb 催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF 催化剂存在下发生的交叉偶联反应Kumada 交叉偶联( Kharasch交叉偶联) :Ni 和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd 催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4 产生的Ti(0) 处理得到双键,反应是一个单电子过程Negishi交叉偶联: Pd催化的有机Zn 和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应: Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille 偶联: Pd催化的有机Sn 和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki 偶联: Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann 反应:芳基碘代物在Cu 存在下的自偶联反应Wurtz 反应:烷基卤经Na或Mg 金属处理后形成碳碳单键Ymada 偶联试剂: 用二乙基氰基磷酸酯(EtO)2PO-CN 活化羧酸缩合反应:Aldol 缩合: 羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn 反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应: 羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合: 酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi 处理生成终端炔烃Darzen 缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann 缩合:分子内的Claisen缩合Evans aldol反应: 用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe 缩合(2-吡啶酮合成): 氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry 硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch 加成反应:过渡金属催化的CXCl3 对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich 缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael 加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama 醇醛缩合:Lewis 酸催化下的醛和硅基烯醇醚之间的Aldol 缩合Nozaki-Hiyama-KIshi 反应:Cr-Ni 双金属催化下的烯基卤对于醛的氧化还原加成Pechmann 缩合(香豆素合成):Lewis 酸促进的酸和β-酮酯缩合成为香豆素Perkin 反应:芳香醛和乙酐反应合成肉桂酸Prins 反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann 反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser 对Witting 反应的修正:不稳定的叶立德和醛发生的Witting 反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter 反应(Michael-Stetter 反应):从醛和α ,β-不饱和酮可以得到1,4-二羰基衍生物。

人名命名的化学反应
以下是一些以人名命名的化学反应的例子:
1. 阿尔多利反应(Aldol reaction),以俄国化学家阿尔多利(Aldol)的名字命名,描述了碳-碳键的形成,是有机合成中常用的反应之一。
2. 伯克利-哈特利反应(Berkeley-Hartley reaction),以美国化学家伯克利(Berkeley)和哈特利(Hartley)的名字命名,用于合成含有苯环的化合物。
3. 格里格纳德反应(Grignard reaction),以法国化学家格里格纳德(Grignard)的名字命名,该反应用于合成碳-碳键和碳-金属键,是有机合成中的重要工具。
4. 巴尔-温克勒反应(Balz-Schiemann reaction),以德国化学家巴尔(Balz)和温克勒(Schiemann)的名字命名,用于合成芳香胺的重要反应。
5. 诺贝尔反应(Nobel reaction),以瑞典化学家诺贝尔
(Nobel)的名字命名,描述了硝基化合物的还原反应。
这些人名命名的化学反应代表了不同领域中科学家的贡献,通过命名反应来纪念他们的工作。
这些反应在化学研究和有机合成中发挥着重要的作用,并且持续影响着化学领域的发展。

常见人名反应及其机理1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer-Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault-Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。

罕见有机人名反应之阿布丰王创作Beckman 贝克曼重排:酮肟在酸性条件下变酰胺的反应(己内酰胺)Cannizzarro 康尼查罗歧化:无α-H的醛在强碱下生成醇和羧酸的反应(苯甲醛)Claisen 克莱森酯缩合:酯在强碱下形成碳负离子对另一酯进行亲核加成消去的反应(有机合成最重要的反应之一)Clemmensen 克莱门森还原法:醛酮在锌汞齐和浓盐酸下还原为烃的反应(羰基变亚甲基)Cope 科浦消去反应:叔胺用过氧化氢处理后加热发生的消去反应(霍夫曼规则)Corey-House 科瑞-豪斯反应:卤代烃和二烷基铜锂试剂的偶联(重要的连接碳链的反应)Cram 克拉姆规则:亲核试剂优先从空间阻力小的一侧进攻Dickerman 狄克曼缩合:反应类似酯缩合,成环Diels-Alder 狄尔斯-阿德尔反应:一般为1,3-丁二烯的衍生物和乙烯的衍生物的反应(协同反应)Fehling 菲林试剂:新制氢氧化铜把醛氧化成酸Fisher 费歇尔投影式:把碳链投影,横键朝前,竖键向后Friedel-Crafts 傅-克反应:苯环上引入烃基或酰基的反应Gabriel 盖布瑞尔合成法:邻苯二甲酰亚胺盐和卤代烃反应制伯胺Gattermann-Koch 盖德曼-柯赫反应:芳烃和盐酸及一氧化碳反应生成芳醛的反应Grignard 格利雅试剂:有机合成最重要试剂之一,卤代烃和镁及乙醚可制得Haworth 哈武斯式:糖的立体投影式Hinsberg 兴斯堡反应:芳烃用于鉴别第一、第二、第三胺的反应,试剂苯璜酰氯Hofmann 霍夫曼消除:季胺碱加热后的消除反应,反应方向和查依采夫规则相反霍夫曼降解:酰胺在溴的碱溶液中生成少一碳的胺Hucker 休克尔规则:π电子数为4n+2时封闭环具有芳香性(有例外,还需考虑环内H的张力)Knoevernagel 克脑文盖尔反应:醛酮在弱碱下和有α-H的化合物的缩合反应Lindar 林德拉催化剂:钯用碳酸钙醋酸铅处理,使活性降低,部分加氢的试剂Lucas 卢卡斯试剂:无水氯化锌和浓盐酸的溶液,用于鉴别昆季叔醇Mannich 曼尼许反应:有α-H的酮和甲醛及铵盐的水溶液反应生成β氨基酮的反应Markownikoff 马尔科夫尼科夫规则:分歧错误称烯烃加成时氢加氢多的碳Meerwein-Ponndorf 麦尔外因-彭多夫还原法:异丙醇铝把醛酮还原成醇的反应,逆反应为Oppenauer 欧芬脑氧化Perkin 珀金反应芳香醛和酸酐在羧酸钠存在下发生的类似羟醛缩合的反应,可得到α,β不饱和芳香酸。
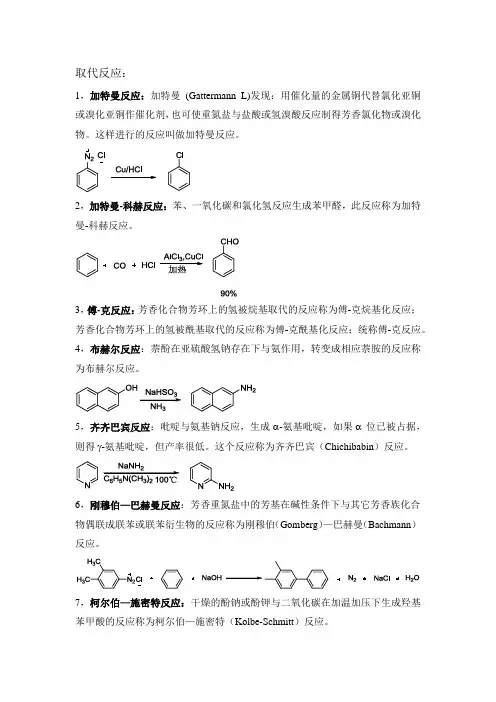
取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成α-氨基吡啶,如果α位已被占据,则得γ-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯—巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)—巴赫曼(Bachmann)反应。
7,柯尔伯—施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯—施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔—悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔—悌曼(Reimer —Tiemann)反应。


1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。


1. Aldol Condensation:羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
反应第一步为羟醛反应,第二部反应为脱水反应。
酸催化碱催化图例使用OCH3 做碱2.Baeyer –Villiger Oxidation酮在过氧化物如过氧化氢、过氧化羧酸等氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
2.Baylis –Hillman Reactionαβ-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。
催化剂一般采用DABCO(14-二氮双环222辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇1。
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael 加成反应启动的加成-消除反应历程4. Beckmann Rearrangement是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
α-二酮、α-酮酸、α-叔烃基酮反式、α-二烷基氨基酮、α-羟基酮和β-酮醚生成的肟在路易,又斯酸或质子酸的作用下断裂为腈及相应的官能团化合物。
这个反应称为―异常贝克曼重排‖称非正常贝克曼重排;二级贝克曼重排;贝克曼断裂反应等。
5. Benzoin Condensation 安息香缩合反应,又称苯偶姻缩合,是一个有机反应,是氰离子催化下两分子芳香醛进行缩合生成一个偶姻分子的反应。
由于生成物是安息香(Ph-CO-CHOH-Ph)的衍生物,故名??. Birch Reduction钠和醇在液氨中将芳香环还原成14-环己二烯的有机还原反应。
Birch 还原的重要性在于:尽管剩下的双键(非芳香性)更为活泼,该反应却能停留在环己双烯上,而不继续还原。
反应中的钠也可以用锂或钾取代,使用的醇通常是甲醇或叔丁醇。
有机化学人名反应取代反应:1,加特曼反应:加特曼(Gattermann L)发现:用催化量的金属铜代替氯化亚铜或溴化亚铜作催化剂,也可使重氮盐与盐酸或氢溴酸反应制得芳香氯化物或溴化物。
这样进行的反应叫做加特曼反应。
2,加特曼-科赫反应:苯、一氧化碳和氯化氢反应生成苯甲醛,此反应称为加特曼-科赫反应。
3,傅-克反应:芳香化合物芳环上的氢被烷基取代的反应称为傅-克烷基化反应;芳香化合物芳环上的氢被酰基取代的反应称为傅-克酰基化反应;统称傅-克反应。
4,布赫尔反应:萘酚在亚硫酸氢钠存在下与氨作用,转变成相应萘胺的反应称为布赫尔反应。
5,齐齐巴宾反应:吡啶与氨基钠反应,生成?-氨基吡啶,如果?位已被占据,则得?-氨基吡啶,但产率很低。
这个反应称为齐齐巴宾(Chichibabin)反应。
6,刚穆伯―巴赫曼反应:芳香重氮盐中的芳基在碱性条件下与其它芳香族化合物偶联成联苯或联苯衍生物的反应称为刚穆伯(Gomberg)―巴赫曼(Bachmann)反应。
7,柯尔伯―施密特反应:干燥的酚钠或酚钾与二氧化碳在加温加压下生成羟基苯甲酸的反应称为柯尔伯―施密特(Kolbe-Schmitt)反应。
8,威廉森合成法:在无水条件下,醇钠和卤代烷作用生成醚的反应称为威廉森(Williamson A W)合成法。
9,席曼反应:芳香重氮盐和氟硼酸反应,生成溶解度较小的氟硼酸盐,后者加热分解产生氟苯,这称为席曼(Schiemann)反应。
10,桑德迈耳反应:1884年,桑德迈耳(Sandmeyer T)发现:在氯化亚铜或溴化亚铜的催化下,重氮盐在氢卤酸溶液中加热,重氮基可分别被氯或溴原子取代,生成芳香氯化物或溴化物。
这一反应称为桑德迈耳反应。
11,普塑尔反应:一些重氮盐在碱性条件下或稀酸的条件下可以发生分子内的偶联反应。
这个反应是普塑尔(Pschorr R)在寻找合成菲环的新方法中首先发现的,故称为普塑尔反应。
12,瑞穆尔―悌曼反应:酚与氯仿在碱性溶液中加热生成邻位及对位羟基醛的反应称为瑞穆尔―悌曼(Reimer ―Tiemann)反应。
人名反应及常见反应(N-P)Nazarov环化反应在酸催化下由二烯基酮电环化制备环戊烯酮的反应。
此反应中常用的酸:质子酸(如硫酸、磷酸)或路易斯酸(如氯化铝、三氟甲磺酸钪)。
反应首先由苏联化学家伊凡·尼古拉耶维奇·纳扎罗夫报道,其中心步骤是一个五原子4π体系在加热情况下的电环化顺旋关环反应。
Neber重排反应1926年,在贝克曼重排反应的研究期间,P.W. Neber和A. Friedolsheim发表报道:甲苯磺酸酮肟在乙醇钾,乙酸和盐酸的作用下得到氨基酮的盐酸盐。
在碱诱导下由o-酰化酮肟重排生成相应的α-氨基酮的反应称为Neber重排。
此反应成为以氨基酮为前体的杂环化合物的合成的一个重要合成工具。
Nef反应1893年,M.Konovalov用稀酸(AcOH,H2SO4)处理1-苯基硝基乙烷的钾盐可以得到1-苯基硝基乙烷和苯乙酮。
而基本在同一时间的1894年,J.U.Nef独立地系统地研究了各种硝基烷钠盐的酸解反应,并发现此类反应的主要产物为相应的羰基化合物。
由于Nef独立地系统地对此类反应的研究,因此将硝基烷转化为相应的羰基化合物的反应被称为Nef反应。
Negishi 交叉偶联反应在镍或钯催化下有机锌试剂和各种卤代物或磺酸酯(芳基,烯基,炔基和酰基)进行交叉偶联的反应。
反应活性一般比较好、对烷基(sp3) 锌化合物也能使用,官能团兼容性好。
另外使用有机铝或有机锆的偶联反应也被称为根岸偶联反应。
利用有机锂化合物或格氏试剂的Kumada偶联反应,应用于复杂化合物的合成时,因为反应活性非常高,很少有不发生副反应的情况。
而有机锌试剂可以使反应在温和条件下平稳进行而减少副产生物。
Nenitzescu吲哚合成反应对苯醌和β-胺基巴豆酸酯缩合得到5-羟基吲哚的反应。
Newman-Kwart反应将苯酚先转化为O-芳基硫代氨基甲酸酯,加热重排为S-芳基硫代氨基甲酸酯,接着水解为相应的苯硫酚的方法。
人名反应全集(更新)下面对往期发布的反应进行汇总,方便小伙伴们查找,点击反应标题可以查看详细内容。
此文是比较全面的总结了此号长时间以来发布的反应,但每个反应的内容都不甚详细,此公众号会持续更新中。
下面的文章链接中有一些反应是非原创内容,如涉及版权问题,请联系公众号删除。
此文的反应排序大体上是按字母顺序排列的,可以按顺序查找。
1.[1,2]-Meisenheimer重排2.[1,2]-Wittig重排3.[2,3]-Meisenheimer重排4.[2,3]-Wittig重排5.1,2-1,3-二元醇的保护Protectionof1,2-1,3-diol6.1,3-二噻烷1,3-Dithiane7.1,3-偶极环加成反应(1,3-DipolarCycloaddition)8.2,4-二甲氧基苄基保护氨基9.Abiko-Masamune羟醛缩合反应10.Abramov膦酰化反应11.乙酰乙酸酯合成法(acetoacetic ester synthesis)12.Achmatowicz反应13.Acyloins缩合(酮醇缩合反应)14.Adler酚氧化反应15.Akabori-Momotani胺基醇合成反应16.Albright–Goldman氧化反应17.Alder烯反应18.Aldol condensation(羟醛缩合反应)19.Algar-Flynn-Oyamada氧化反应20.alkene (olefin) metathesis(烯烃交叉复分解反应)21.22.关环复分解反应【Ring-closing metathesis (RCM)】23.24.alkyne metathesis(炔烃复分解反应)25.Allan–Robinson反应26.Allen膦重排反应27.Alper羰基化反应28.Amadori重排反应29.Amii三氟甲基化(AmiiTrifluoromethylation)30.Andersen手性亚砜合成法( 安德森Chiral Sulfoxide Synthesis)31.Angeli-Riminia羟肟酸合成32.Appel反应33.Arens-van Dorp反应34.Arndt–Eistert同系化反应35.Asinger反应36.Atherton-T odd反应37.Auwers-Inhoffen二烯酮-苯酚重排反应38.Auwers黄酮合成反应39.aza-[2,3]-Wittig重排(氮杂-[2,3]-Wittig重排)40.aza-Claisen重排(氮杂Claisen重排)41.aza-Cope重排反应(氮杂-Cope重排)42.Aza-Henry反应43.aza-Wittig反应(氮杂Wittig反应)44.Baer-Fischer氨基糖合成反应45.Baeyer-Villiger芳环三苯甲基化反应46.Baeyer–Villiger氧化47.Baeyer吡啶合成反应48.Baeyer二芳基甲烷合成反应49.Baker-Venkataraman重排50.Bald win’s Rule(鲍德温规则)51.Balz-Schiemann反应52.Bamberger咪唑合成53.Bamberger重排54.Bamford-Stevens-Shapiro烯化反应55.Baran试剂56.Barbier反应57.Bargellini反应58.Barluenga试剂(Barluenga’sReagent)59.Bartoli吲哚合成反应60.Barton-Kellog烯化反应61.Barton-McCombie脱羟基反应62.Barton-Zard吡咯合成法(Barton-ZardPyrroleSynthesis)63.Barton–Zard吡咯合成反应64.Barton碘乙烯合成( 巴顿Vinyl Iodide Synthesis)65.Barton脱氨基反应66.Barton亚硝酸酯光解反应, Barton反应(巴顿Reaction)67.Barton自由基脱羧反应, Barton脱碳酸反应(BartonDecarboxylation)68.Batcho–Leimgruber吲哚合成反应69.Baylis-Hillman反应70.BBr3裂解醚反应71.Beayer-Drewson靛蓝合成反应72.Beckmann重排反应73.Beirut反应74.Benary共轭醛合成反应75.Benzoin安息香缩合(安息香Condensation)76.Berchtold烯胺扩环反应77.Bergman芳环化反应78.Betti反应79.Biginelli反应80.Bingel Reaction(宾格尔反应)81.Birch还原反应82.Bischler–Möhlau吲哚合成反应83.Bischler–Napieralski反应84.Blaise反应85.Blanc反应86.Blanc环化(BlancCyclization)87.Blomquist大环化反应88.Blum–Ittah氮杂环丙烷合成反应89.Bode多肽合成(Bode PeptideSynthesis)90.Bodroux-Chichibabin91.Boekelheide反应92.Boger吡啶合成反应93.Bohlmann-Rahtz吡啶合成94.Borch还原胺化反应95.Borsche-Beech反应96.Borsche–Drechsel环化反应97.Boulton–Katritzky重排98.Bourgel炔合成反应99.Bouveault-Blanc反应100.Bouveault-Locquin氨基酸合成反应101.Bouveault醛合成反应102.Boyer-Schmidt-Aube重排(Boyer-Schmidt-AubeRearrangement)103.Boyland–Sims氧化104.Bradsher反应105.Brandi-Guama螺环丙烷重排反应106.Breckport β-内酰胺合成107.Bredereck噁唑合成法(BredereckOxazoleSynthesis)108.Bredereck咪唑合成109.Bredereck试剂110.Brook重排反应111.Brown硼氢化氧化反应112.Brown炔基异构化反应113.Bruylants反应114.Bucherer–Bergs反应115.Bucherer反应116.Bucherer咔唑合成117.Büchner扩环反应118.Buchwald-Hartwig反应,Buchwald–HartwigC-N偶联反应简介119.Buchwald-Hartwig偶联反应中常见的配体120.Bunte盐~无气味含硫Building Block~121.Burgi-Dunitz轨道角122.Burgess试剂123.Burke硼酸试剂124.Burton三氟甲基化(BurtonTrifluoromethylation)125.Cadiot–Chodkiewicz coupling,Cadiot-Chodkiewicz偶联反应126.Cadogan–Sundberg吲哚合成127.Caglioti还原反应128.Camps喹啉合成(CampsQuinolineSynthesis)129.Cannizzaro反应130.CAN制备芳基砜131.Carroll重排132.Castro–Stephens偶联反应(Castro-StephensCoupling)133.Catellani反应134.Chan–Lam C–X偶联反应135.Chan炔还原反应(红铝炔还原反应)136.Chan酰氧基乙酸酯重排反应137.Chapman rearrangement138.Charette不对称环丙烷化(CharetteAsymmetricCyclopropanation)139.Chichibabin吡啶合成反应140.Chichibabin反应141.Chugaev消除反应142.C-H催化氧化反应(CatalyticC-HOxidation)143.Ciamician–Dennstedt重排144.Claisen缩合反应145.Claisen异恶唑合成146.Claisen重排反应147.非常规Claisen重排反应机理148.Clauson-Kaas吡咯合成反应149.Clemmensen还原150.Click ChemistryAzide-AlkyneCycloaddition151.Clive-Reich-Sharpless烯合成反应152.Cloke-Wilson环丙基酮重排反应153.Collman试剂(Collman’sReagent)154.Colvin炔合成反应bes喹啉合成反应ins三氟甲磺酸化试剂157.Concellon烯烃合成反应158.Conia-烯反应(Conia–EneReaction)159.Conrad–Limpach反应160.Cope 1,5-二烯重排反应161.Cope消除反应162.Cope重排反应163.Corey-Bakshi-Shibata还原反应164.Corey-Chaykovsky反应165.Corey-Fuchs炔合成反应166.Corey-Gilman-Ganem氧化反应167.Corey-Kim氧化反应168.Corey–Nicolaou大环内酯化反应169.Corey–Seebach反应170.Corey-Winter烯合成反应171.Cornforth Rearrangement康福斯重排反应172.Cr(η6-arene)(CO)3络合物(Cr(η6-arene)(CO)3Complex) 173.Crabbe´丙二烯合成反应174.Crabbe联烯合成(CrabbeAlleneSynthesis)175.Crabtree导向氢化催化剂176.Cram规则和Felkin-Anh规则177.Criegee臭氧化反应178.Criegee二醇氧化裂解179.Cristol-Firth脱羰卤代反应180.Cross-metathesis181.Curtius 重排182.Dakin-West反应183.Dakin氧化反应184.Danheiser成环反应185.Danheiser苯环化反应186.Danishefsky二烯187.Danishefsky-Kitahara双烯化反应(Danishefsky-KitaharaDiene)188.Darapski氨基酸合成189.Darzens-Nenitzescu烯烃酰基化反应190.Darzens缩水甘油酸酯缩合191.DAST192.Davidson恶唑合成反应193.David-Thieffry二醇单苯醚化反应194.Davies铁手性助剂195.Davis氧杂氮丙啶氧化反应196.De Kimpe氮杂环丙烷的合成197.de Mayo反应198.Debus-Radziszewski咪唑合成反应199.Delépine胺合成反应,Delépine反应,Delepine 反应(德尔宾Amine Synthesis)200.Delepine醛氧化反应201.Demjanov重排202.Dess-Martin高碘烷氧化203.DIBAL还原剂204.Dieckmann缩合反应,Dieckmann缩合反应狄克曼Condensation205.Diels-Alder-不对称Diels-Alder反应(AsymmetricDiels-AlderReaction)206.Diels-Alder反应(狄尔斯–阿尔德反应)207.Dimroth重排反应208.209.Di-π-methane重排(Di-π-methaneRearrangement)210.Doebner–von Miller反应211.Doebner喹啉合成反应212.Doering-LaFlamme丙二烯合成法213.Dondoni甲酰基化反应214.Dötz反应215.Dowd-Beckwith扩环反应216.Du Bois胺基化(DuBois Amination)217.Dudley reagent218.Duff反应219.Duthaler-Hafner对映选择性烯丙基化反应220.Dutt–Wormall叠氮化反应221.Dyotropic重排反应(dyotropicrearrangement) 222.Eaton试剂223.Eckert氢化催化剂224.Eglinton偶联225.Ehrlich-Sachs芳香亚胺合成226.Elbs稠环芳烃合成227.Elbs氧化228.Ellman亚胺(Ellman’sImine)229.Emmert还原缩合反应230.Enders SAMP/RAMP腙烷基化反应231.Erlenmeyer-Plöchl吖内酯合成232.Eschenmoser–Claisen酰胺缩酮重排233.Eschenmoser-Tanabe裂解反应234.Eschenmoser偶联(EschenmoserCoupling)235.Eschenmoser脱硫反应236.Eschenmoser烯化反应237.Eschenmoser亚甲基化(EschenmoserMethylenation) 238.Eschenmoser盐239.Eschweiler-Clarke反应(Eschweiler-ClarkeReaction) 240.Etard铬酰氯氧化241.Evans氨基酸合成242.Evans羟醛缩合反应243.Favorskii重排244.quasi-Favorskii(类Favorskii)重排反应245.Feist–Bénary呋喃合成反应246.Feldman烯烃环戊烷合成反应247.Felkin-Anh规则248.Feringa–Alexakis不对称迈克尔加成反应249.Ferrier碳环化反应250.Ferrier重排反应251.Fétizon氧化剂252.Fiesselmann噻吩合成253.Finkelstein反应254.Fischer-Speier酯化反应255.Fischer恶唑合成256.Fischer吲哚合成反应257.Fischer糖苷化反应258.259.Fleming-Kumada oxidation260.Forster重氮化合物合成反应261.Franchimond反应262.Frankel-Shibasaki烯丙胺重排反应263.Freunderberg-Schonberg硫酚合成264.265.Friedel-Crafts烷基化反应266.Friedel-Crafts酰基化反应267.Friedländer喹啉合成反应268.Fries重排269.Fritsch–Buttenberg–Wiechell重排反应270.Fujimoto-Belleau反应271.Fujiwara-Moritani Reaction(藤原-守谷反应) 272.Fujiwara镧系金属催化反应273.Fukuyama胺合成反应274.Fukuyama还原反应275.Fukuyama偶联反应276.Fukuyama吲哚合成反应277.Furstner吲哚合成反应278.Furst-Plattner规则279.Gabriel–Colman重排280.Gabriel反应281.Garegg-Samuelson二醇消除反应282.Garigipati脒合成反应283.Gassman羟吲哚合成反应284.Gassman吲哚合成反应285.Gattermann–Koch reaction286.Gattermann醛合成(GattermannAldehydeSynthesis)287.Gewald氨基噻吩合成288.Giese自由基加成反应(GieseRadicalAddition)289.Glaser - Hay偶联,Glaser偶联反应( 格拉泽Reaction) 290.Goldberg胺化(GoldbergAmination)291.Goldberg偶联反应292.Gomberg–Bachmann反应293.Gould–Jacobs反应294.Graham双吖丙啶合成295.Griesbaum共臭氧化反应296.Griess脱氨基反应297.Grignard反应(格氏反应)298.299.Gröbcke-Blackburn-Bienaymé胺基咪唑合成反应300.GROB裂解,Grob断裂反应(GrobFragmentation) 301.Guareschi–Thorpe缩合302.GUY–LEMAIRE–GUETTE氯化试剂303.Hajos–Wiechert反应304.Haller–Bauer反应305.Hammick吡啶烷基化反应306.Hanaoka-Wrobel喹诺里西啶合成307.Hantzsch 合成法308.Hantzsch吡咯合成法309.Hantzsch二氢吡啶合成法310.HASSNER–GHERA–LITTLE关环反应311.Hauser-Beak邻位锂化反应312.Hauser-Kraus环化反应313.Heck反应314.Hegedus吲哚合成反应315.Heine 反应316.Hell–Volhard–Zelinsky反应317.Henry反应318.319.Herz反应320.Hetero-Diels–Alder reaction(杂-Diels–Alder反应)321.Hilbert-Johnson反应322.Hill-Barrett钙催化的氢胺化反应323.Hinsberg噻吩合成反应324.Hiyama交叉偶联反应325.Hiyama偶联反应(桧山Cross Coupling)326.Hofmann–Löffler–Freytag反应327.Hofmann消除反应328.Hofmann(霍夫曼)规则329.Hofmann异腈合成反应330.Hofmann重排331.Horner–Wadsworth–Emmons反应Masamune–Roush 改进法332.Horner-Wadsworth-Emmons反应333.Hosomi Sakurai反应334.Houben-Hoesch反应335.336.休克尔规则(Hückel规则)337.Hunsdiecker-Borodin反应338.Hurd–Mori 1,2,3-噻二唑的合成339.IBX氧化反应IBX Oxidation340.Ing–Manske反应341.Ireland模型342.Iron-Catalyzed C-H Functionalization(铁催化导向碳氢官能团化)343.Ishikawa试剂344.Ivanov反应345.Jacobsen–Katsuki环氧化反应346.347.Jacobsen水解动力学拆分348.Japp–Klingemann腙合成反应349.Japp-Klingemann-Fischer吲哚合成反应350.351.Jocic反应352.Johnson–Claisen原乙酸酯重排353.Johnson-Corey-Chaykovsky反应354.Jones氧化反应(JonesOxidation)355.Julia-Bruylants环丙基甲醇重排356.Julia-colonna不对称环氧化反应357.Julia–Kocienski烯化反应358.Julia-Lythgoe烯化反应,Julia–Lythgoe烯化反应,Julia-Lythgoe烯烃合成359.Jung–Olah–Voronkov醚裂解反应360.Kabachnik-Fields反应361.Kagan-Horner-Knowle不对称氢化反应362.Kagan-Molander偶联反应363.Kahne 糖苷化反应, Kahne–Crich糖苷化反应364.Kaiser-Johnson-Middleton二腈环化反应365.Katada反应366.Keck不对称烯丙基化反应367.Keck大环内酯化反应368.Keck自由基烯丙基化反应369.Kennedy氧化环化反应370.Kinugasa β-内酰胺合成反应371.Kishi 还原372.Knoevenagel缩合反应373.Knorr喹啉合成反应374.Knorr吡咯合成375.Kolbe–Schmitt反应376.Kochi-Fürstner偶联反应(Kochi-FürstnerCrossCoupling) 377.Koch–Haaf羧基化反应378.Kochi脱羧氯代反应379.Koenigs-Knorr糖苷化反应380.Konaka镍氧化试剂381.Kondrat’eva吡啶合成反应382.Kornblum氧化反应383.Koser试剂384.Kostanecki反应385.Kotha–Schollkopf氨基酸合成反应386.Krapcho反应387.Kröhnke吡啶合成388.Kucherov反应389.Kulinkovich反应390.Kumada偶联反应denburg吡啶苄基化反应rock吲哚合成反应wesson试剂394.Lemieux-Johnson氧化反应395.Leuckart–Wallach反应396.Leuckart苯硫酚合成反应397.Ley-Griffith氧化反应398.李朝军三组分反应399.Lieben 卤仿反应400.Liebeskind–Srogl偶联反应401.Lindlar还原反应402.403.Lossen重排404.Luche还原405.Luche锌烯丙化反应406.Lu-Trost-Inoue反应407.麻生明氧化反应408.MacMillan催化剂409.Madelung吲哚合成反应410.Malaprade邻二醇氧化裂解反应411.malonic ester synthesis(丙二酸酯合成反应)412.Mamedov杂环重排反应413.Mander试剂414.415.Mannich反应416.Mann芳基醚脱烷基反应417.Markovnikov规则(马氏规则)418.Marshall硼氢化裂解419.Martin硫化物脱水试剂420.Masamune酯化反应421.McFadyen–Stevens还原422.McMurry偶联反应423.Meerwein 试剂424.Meerwein–Ponndorf–Verley还原425.Meerwein芳基化反应426.Meerwein盐427.Meisenheimer络合物428.Meth-Cohn喹啉合成反应429.Meyer–Schuster重排430.Meyers恶唑啉合成法431.Meyers醛合成反应432.Michaelis-Arbuzov膦酸酯合成433.Michaelis-Nylen吡啶膦酸化反应434.Michael加成反应435.Midland还原436.Migita-Sano邻苯醌二甲烷合成437.Minisci反应438.Minisci环氧化439.Mislow–Evans重排反应440.Mitsunobo-通过Mitsunobo反应由醇制备氨基化合物441.Mitsunobu反应442.Mitsunobu反应合成叠氮化合物443.Mitsunobu硫代反应444.Mitsunobu卤代反应445.Mitsunobu醚化反应446.Miyaura硼酸酯化反应447.MnO2 氧化448.Moffatt氧化反应449.Morgan–Walls反应450.Mori-Ban吲哚合成反应451.Mukaiyama Michael加成反应452.Mukaiyama羟醛缩合反应453.Mukaiyama试剂454.Mukaiyama氧化反应455.Mukaiyama水合反应456.Murahashi偶联反应457.Myers-Saito环化反应458.Myers不对称烷基化反应459.Narasaka-Heck环化反应460.Nazarov环化反应461.Neber重排反应462.Nef反应463.Negishi交叉偶联反应464.Nenitzescu吲哚合成反应465.Newman-Kwart反应466.Nicholas反应467.Nicolaou IBX 脱氢反应468.Niementowski喹啉合成反应469.Niementowski喹唑啉合成反应470.Noyori不对称氢化反应471.Nozaki–Hiyama–Kishi偶联反应472.Nysted试剂473.O’Donnell氨基酸合成反应474.Oppenauer氧化475.OsO4/NaIO4氧化合成醛476.Overman重排477.常用氧化剂Oxone的应用478.O-酰基异肽法(O-acylisopeptideMethod) 479.Paal–Knorr吡咯合成480.Paal–Knorr呋喃合成481.Paal噻吩合成482.Parham环化反应483.Parikh–Doering氧化484.Passerini反应485.Paternó–Büchi反应486.Pauson-Khand反应487.Pavorov反应488.Payne重排489.PCC(PyrindiumChlorochromate)氧化490.PDC(pyridinium dichromate)氧化491.Pechmann香豆素合成492.Pechman重氮烯烃环加成反应493.494.Perkin反应495.Perkow磷酸烯基酯的合成496.Petasis反应497.Petasis试剂498.Peterson烯化反应499.Pfitzinger反应500.Pfitzner-Moffatt氧化反应501.502.Pictet–Gams异喹啉合成503.Pictet–Spengler四氢异喹啉合成504.Piloty-Robinson Pyrrole Synthesis 505.Pinacol 偶联反应(频哪醇Coupling)506.Pinacol重排507.Pinner反应508.Pinnick氧化509.Plietker双羟化反应510.Plancher重排反应511.Polonovski–Potier反应512.Polonovski反应513.Pomeranz–Fritsch反应514.Povarov反应515.常用试剂----Prakash试剂516.Prévost反式双羟化反应517.Prilezhaev反应518.Prins反应519.Pschorr环化反应520.Pummerer重排521.Ramberg-Backlund重排522.常用试剂----Raney Ni 523.Reformatsky反应524.Regitz重氮化合物合成525.Reimer–Tiemann反应526.Reissert反应527.Reissert吲哚合成反应528.Remfry-Hull嘧啶合成反应529.Riley氧化530.Ritter反应531.Robinson–Gabriel反应532.Robinson-Schöpf反应533.Robinson关环反应534.Rosenmund-von Braun反应535.Rosenmund还原536.537.Roskamp-Feng反应538.Roush不对称烯丙基化反应539.Rubottom氧化反应540.Ruff–Fenton醛糖降解反应541.Rupe重排542.Saegusa氧化反应543.Sakurai烯丙基化反应544.Sandmeyer反应545.Sanford反应546.Sarett-Collins氧化(Sarett-CollinsOxidation) 547.Satoh-Miura 反应548.Sawada试剂549.Schiemann反应550.Schlittler–Müller反应551.Schmidt 三氯乙酰亚胺酯糖苷化反应552.Schmidt重排553.554.Scholl反应555.Schotten-Baumann反应556.Seyferth-Gilbert增碳反应557.Shapiro反应558.Sharpless不对称环氧化反应559.Sharpless不对称羟胺化560.Sharpless不对称双羟基化反应561.Sharpless烯合成反应562.Shiina大环内酯化反应563.成公明-Plietker双羟化反应564.Simmons-Smith环丙烷化反应565.Skraup喹啉合成566.Smiles重排反应567.Snieckus氨基甲酸酯重排568.Sommelet–Hauser重排569.Sommelet反应570.Sonogashira反应571.Staudinger还原572.Staudinger烯酮环加成反应573.Steglich酯化反应574.Stephen醛合成反应575.576.Sternbach苯二氮䓬合成577.Stetter反应578.579.Stevens重排580.Stieglitz N-卤代胺重排581.Stille-Kelly反应582.Stille羰基化偶联反应583.Stille偶联反应584.Still–Gennari反应585.Stobbe缩合反应586.Stoltz α-烯丙基酮不对称合成反应587.Stork–Danheiser反应588.Stork烯胺合成反应589.Stork-赵康烯化反应590.Strecker氨基酸合成反应591.Strecker降解反应592.Stryker试剂(Stryker’sReagent)593.【化学空间】菅沢反应 Sugasawa Reaction 594.Suzuki–Miyaura反应595.Suzuki-镍催化Suzuki偶联反应596.Swern氧化反应597.Takai反应598.Takemoto不对称Michael加成催化剂599.Tamao-Fleming 氧化(玉尾–弗莱明oxidation) 600.Tebbe试剂601.TEMPO氧化602.TEMPO氧化醇到醛酮603.Thorpe-Ziegler反应604.Tiffeneau–Demjanov重排605.Tishchenko反应606.TPAP (Ley-Griffith)氧化反应607.Trost环戊烷化反应608.Trost氧化(TrostOxidation)609.Truce-Smile重排610.Tsuji-Trost反应611.Tsuji-Wilkinson脱羰基612.Tsuji-Wilkinson脱羰基反应613.U. Schollkopf法合成手性氨基酸614.Upjohn双羟化反应机理图615.Ugi反应616.Ullmann醚合成(UllmannEtherSynthesis)617.Ullmann偶联反应618.Upjohn双羟化反应619.van Leusen噁唑合成反应620.Van Leusen反应621.van Leusen吡咯合成反应622.Van Leusen咪唑合成反应623.Vilsmeier-Haack甲酰化反应624.Vinylcyclopropane-cyclopentenerearrangement(乙烯基环丙烷-环戊烯重排)625.von Braun反应626.von Braun酰胺降解反应627.von Pechman重氮烯烃环加成反应628.von Pechmann反应 | 人名反应小课堂629.Vorbruggen糖苷化反应630.Wacker氧化反应631.Wagner–Meerwein重排632.Wallach重排反应633.Wallach咪唑合成反应634.常用试剂----Weinreb酰胺635.weinreb酰胺制备酮636.Weiss–Cook缩合反应637.Wenker反应638.Wharton反应639.White催化剂640.Widequist四氰基环丙烷合成641.Willgerodt–Kindler反应642.Williamson醚合成反应643.Wissner羟基酮合成644.Wittig-Schlosser反应645.Wittig反应646.Wohl–Ziegler反应647.Wolff–Kishner-黄鸣龙还原反应648.Wolff重排649.Woodward顺位双羟化反应650.Wurtz反应651.Yamaguchi酯化反应652.Yamamoto酯化653.Yamazaki鸟嘌呤合成反应654.Yamamoto 偶联655.余金权C−H活化反应656.俞氏糖苷化反应657.Zaitsev消除规则658.Zavyalov吡咯合成反应659.Zimmerman重排660.Zimmerman-Traxler过渡态模型661.Zincke-Suhl环己二烯酮合成662.Zincke反应663.Zinin联苯胺重排664.张绪穆烯炔环异构化反应665.666.α-氨基酸的重氮化取代反应667.苯甲醚利用LiCl脱甲基668.不对称丙烯基硼化AsymmetricAllylboration669.不对称环氧化合物的选择性开环670.氘氢标记反应(DeuteriumLabelingReaction)671.叠氮-炔环加成672.二苯乙醇酸重排反应673.二烯酮苯酚重排674.二氧化硒氧化(SeleniumDioxide)675.芳香环卤化反应Halogenation ofAromatic Ring676.芳香卤代烃在金属催化作用下的腈化反应677.芳香杂环Heck反应678.非均相催化还原(HeterogeneousHydrogenation)679.格氏试剂680.关环复分解反应【Ring-closingmetathesis(RCM)】681.硅烷氧化制备醇682.过氧化酮氧化(OxidationwithDioxirane)683.还原Weinreb酰胺制备醛684.还原缩醛法合成醚(EtherSynthesis by Reduction of Acetal)685.红铝氢化还原(Red-Al)686.环化异构化反应(Cycloisomerization)687.环氧化合物制备醇688.磺酰氯的制备689.活性二氧化锰氧化690.加氢金属化反应Hydrometalation691.交叉脱氢偶联反应(CrossDehydrogenativeCoupling (CDC))692.金属催化C-H活化(CatalyticC-H activation)693.金属卡宾的环丙烷化反应(CyclopropanationwithMetal Carbenoid)694.金属氢化物的还原反应695.均相加氢Homogeneous Hydrogenaton696.李朝军三组分反应697.联亚胺法还原(DiimideReduction)698.邻位金属化反应(DirectedorthoMetalation)699.面包酵母不对称还原酮700.偶氮偶合反应,重氮偶联反应(diazocoupling)701.钯催化的C-O键形成反应702.强酸脱甲基反应703.羟基的选择性氧化综述704.亲核环氧化反应(NucleophilicEpoxidationwith Peroxide)705.炔烃的环化三聚(CyclotrimerizationofAlkynes)706.炔烃复分解反应707.三甲基碘硅烷脱甲基反应708.三卤化铝脱甲基反应709.史氏不对称环氧化反应710.双活化底物的烷基化711.四氧化锇氧化712.羰基的选择性反应713.羰基化偶联反应CarbonylativeCross Coupling714.脱硫氟代反应715.脱羧偶联反应716.脱氧氟化Deoxyfluorination717.烯基加氢甲酰化反应Hydroformylation718.烯烃交叉复分解反应719.烯烃双羟化反应720.消除反应(EliminationReaction)721.硝酮的1,,3-偶极子环化(1,3-DipolarCycloaddition of Nitrone)722.亚砜/氧化硒的syn-β消除723.氧化加汞-脱汞还原724.乙硫醇钠脱甲基反应725.由醇制备烷烃726.由醛肟制备腈727.原子转移自由基聚合(AtomTransferRadical Polymerization)728.酯,酰胺,腈类的部分还原729.重氮盐参与的Heck反应。
药物合成反应重要人名反应整理1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
常见人名反应及机理 Document number:NOCG-YUNOO-BUYTT-UU986-1986UTBeckmann重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:Birch还原反应机理Cannizzaro反应反应机理Claisen酯缩合含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见反应机理乙酸乙酯的α-氢酸性很弱(,而乙醇钠又是一个相对较弱的碱(乙醇的pKa~),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
Claisen_Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用还原。
Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应()反应称为Cope 重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。