金属腐蚀的快慢速度共28页
- 格式:ppt
- 大小:2.45 MB
- 文档页数:14

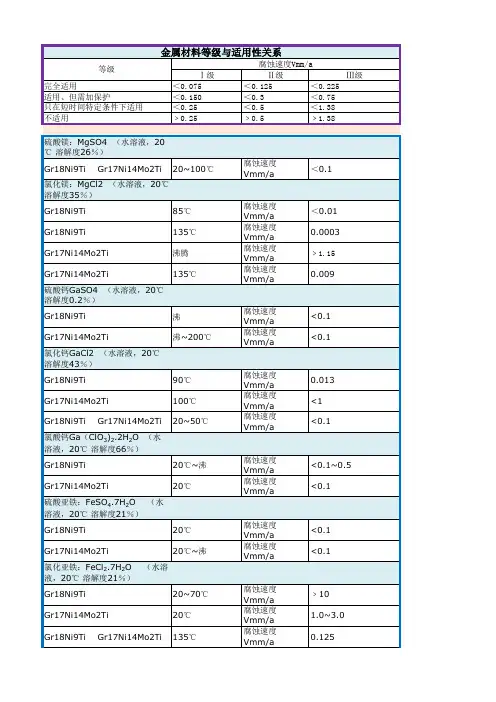
腐蚀速率如何计算金属材料的腐蚀速度常用金属腐蚀速度的重要指标、深度指标和电流指标表示。
金属腐蚀速度表示法是在要评价的土壤中埋设金属材料试样,经过一定时间后,测试出试样的重量变化或深度变化或电流变化,以此来评价土壤腐蚀性。
重量指标就是把金属因腐蚀而发生的重量变化,换算成相当于单位金属面积与单位时间内的重量变化的数值。
它又分为失重法和增重法两种。
用公式表示为:式中v-—失重时的腐蚀速度,克/米2.小时;v+—增重时的腐蚀速度,克/米2.小时;Wo-—金属的初始重量,克;W1—消除了腐蚀产物后金属的重量,克;W2—带有腐蚀产物的金属的重量,克;S—金属的面积,米2;T—腐蚀进行的时间,小时。
金属腐蚀速度的深度指标是把金属的厚度因腐蚀而减少的量,以线量单位表示,并换算成相当于单位时间的数值。
用公式表示为:式中vL—腐蚀的深度指标,毫米/年;p—金属的密度,克/厘米3。
金属腐蚀速度的电流指标是以金属电化学腐蚀过程的阳极电流密度的大小来衡量金属的电化学腐蚀速度的程度。
可由法拉第(Faraday)定律把电流指标和重量指标联系起来。
可用公式表示为:式中ia—腐蚀的电流指标,即阳极电流密度,安培/厘米2;A——原子量;N——化合价;列举几个常用的腐蚀速率计算方法:1、失重法失重法直接表示由于腐蚀而损失的材料重量,其过程为:对预先制备的试样测量尺寸,净准确称重后置于腐蚀介质中,实验结束后取出,清除产物后清洗、干燥、再称重。
试样的失重直接表征材料的腐蚀程度。
其腐蚀速率的计算方法:通常采用单位时间内单位面积上的重量变化表征平均腐蚀速率g*(m^-2)*(h^-1)。
v=(w0-w1)/(At);其中,W0:试样原始重量(g);w1:试样清除产物后的重量(g);A:试样面积(m^2);t:试验周期(h)但是这种表征方式仍然不能表示出浮士德损耗深度,为此可将腐蚀速度换算成单位时间内的平均腐蚀深度(如:mm/a),其换算关系为:B=(1/ρ)*v*[(365*24*10)/(100*100)]=8.76*v/ρ=8.76*(w0-w1)/(ρ*A*t)B:腐蚀速率(mm/a)v:按重量计算的腐蚀失重速度(g*(m^-2)*(h^-1)。
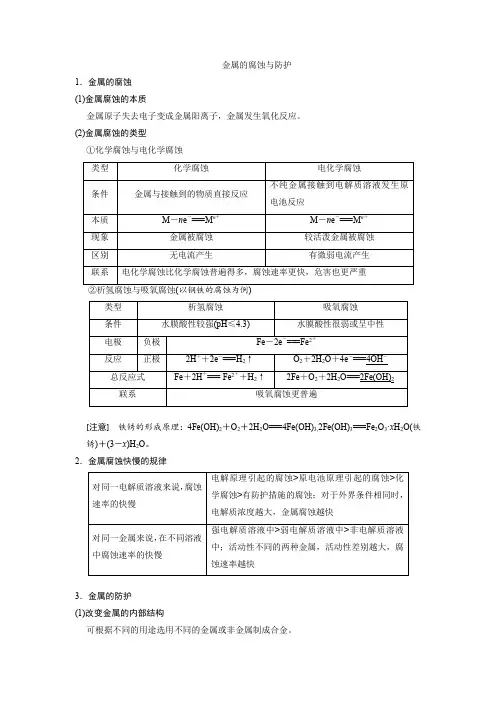
金属的腐蚀与防护1.金属的腐蚀(1)金属腐蚀的本质金属原子失去电子变成金属阳离子,金属发生氧化反应。
(2)金属腐蚀的类型①化学腐蚀与电化学腐蚀[注意]铁锈的形成原理:4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·x H2O(铁锈)+(3-x)H2O。
2.金属腐蚀快慢的规律3.金属的防护(1)改变金属的内部结构可根据不同的用途选用不同的金属或非金属制成合金。
(2)覆盖保护层可以通过喷油漆、涂油脂、电镀或表面钝化等方法使金属与介质隔离。
(3)电化学防护[细练过关]1.如图所示,各烧杯中盛海水,铁在其中被腐蚀的速度由快到慢的顺序为( )A .②①③④⑤⑥B .⑤④③①②⑥C .⑤④②①③⑥D .⑤③②④①⑥解析:选C ①是Fe 为负极,杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢,其电极反应式:负极Fe -2e -===Fe 2+,正极2H 2O +O 2+4e -===4OH -。
②、③、④均为原电池,③中Fe 为正极,被保护;②、④中Fe 为负极,均加快了Fe 的腐蚀,但Fe 和Cu 的金属活动性差别大于Fe 和Sn 的,故FeCu 原电池中Fe 腐蚀的较快。
⑤是Fe 接电源正极作阳极,Cu 接电源负极作阴极,加快了Fe 的腐蚀。
⑥是Fe 接电源负极作阴极,Cu 接电源正极作阳极,防止了Fe 的腐蚀。
根据以上分析可知铁在其中被腐蚀由快到慢的顺序为⑤>④>②>①>③>⑥。
2.(2020·莆田第一中学期中)研究金属桥墩腐蚀及防护是跨海建桥的重要课题。
下列判断中正确的是( )A .用装置①模拟研究时未见a 上有气泡产生,说明铁棒没有被腐蚀B .②中桥墩与外加电源正极连接能确保桥墩不被腐蚀C .③中采用了牺牲阳极的阴极保护法保护桥墩D .①②③中海水均是实现化学能转化为电能的电解质解析:选C ①是吸氧腐蚀,a 极是氧气得电子生成氢氧根离子,而铁是负极,发生氧化反应生成亚铁离子,铁被腐蚀,故A 错误;金属作电解池的阴极被保护,而铁与电源正极相连,是阳极,发生氧化反应,故B错误;锌比铁活泼,所以锌失电子,所以③中采用了牺牲阳极的阴极保护法保护桥墩,故C正确;海水是混合物,不是化合物,既不是电解质,也不是非电解质,故D错误。

金属腐蚀快慢的比较高考频度:★★★☆☆难易程度:★★☆☆☆典例在线下图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是A.④>②>①>③B.②>①>③>④C.④>②>③>①D.③>②>④>①【参考答案】A【试题解析】铁在海水中的腐蚀属于电化学腐蚀,当铁与比它活泼性差的Sn相连时,Fe被腐蚀的速率增大(比①大),与活泼性比其强的锌相连时,锌作负极,被腐蚀,铁被保护,其腐蚀的速率要比①小;④为电解装置,Fe为阳极,发生氧化反应,铁腐蚀的速率最快。
解题必备金属腐蚀快慢比较(1)在同一电解质溶液中:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在相同浓度不同介质中腐蚀由快到慢的顺序为强电解质溶液>弱电解质溶液>非电解质溶液。
(3)有无保护措施的腐蚀快慢顺序:无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀。
学霸推荐1.下列试管中的铁钉腐蚀最快的是A.B.C.D.2.下列四种金属制品的镀层损坏后,金属腐蚀速率最快的是A.镀铝铁扣B.食品罐头盒(镀锡)C.白铁水桶(镀锌) D.镀银铜制奖章3.如下图所示装置中都盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是A.③①④②B.①②④③C.①②③④D.②①④③4.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间。
下列对实验结束时现象的描述不正确的是A.装置Ⅰ左侧的液面一定会下降 B.左侧液面装置Ⅰ比装置Ⅱ的低C.装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀5.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:(1)A中反应的离子方程式是______________________________________。

金属腐蚀速率的实验观察与分析金属腐蚀是指金属在某种介质中与环境发生化学反应,导致金属表面的变化和破坏。
金属腐蚀的速率是一个重要的参数,可以用来评估金属的耐腐蚀性能。
本实验通过观察和分析金属腐蚀速率,探讨了不同条件下金属的腐蚀行为。
实验装置和材料:1. 镀锌钢板2. 研磨纸3. 砂纸4. 铁钉5. 酸性溶液(如盐酸、硫酸)6. 苏打水7. 清洁液(如醋)实验步骤:1. 将铁钉和镀锌钢板分别用研磨纸和砂纸进行打磨,使其表面变得光滑。
2. 分别将铁钉和镀锌钢板放入酸性溶液中,观察其腐蚀情况,并记录下时间。
3. 将铁钉和镀锌钢板放入苏打水中,再观察其腐蚀情况,并记录下时间。
4. 用清洁液清洁铁钉和镀锌钢板的表面,使其恢复原状。
实验结果:1. 在酸性溶液中,铁钉和镀锌钢板的腐蚀速率较快,表面会出现锈蚀现象。
腐蚀速率会随着时间的推移而增加。
2. 在苏打水中,镀锌钢板表面没有明显的腐蚀现象,而铁钉表面可能会有少量的腐蚀产物。
腐蚀速率较酸性溶液中慢。
3. 清洁液可以将铁钉和镀锌钢板的表面腐蚀产物清除掉,恢复原状。
实验分析:1. 金属腐蚀速率受到环境中的氧、湿度、温度和介质的酸碱度等因素的影响。
酸性溶液中腐蚀速率较快,可能是因为酸性溶液中含有较多的氢离子,可以与金属表面的电子发生反应,导致腐蚀加剧。
2. 镀锌钢板表面没有明显腐蚀的可能是因为镀锌层形成了一层保护性的氧化物膜,阻止了水和氧气的进一步接触,减缓了腐蚀速率。
而铁钉表面没有镀锌层的保护,容易被氧气和水直接接触,从而加速了腐蚀速率。
3. 清洁液可以去除金属表面的腐蚀产物,恢复原状,但并不能改变金属的耐腐蚀性能。
综上所述,本实验通过观察和分析金属腐蚀速率,揭示了金属在不同条件下的腐蚀行为。
了解金属腐蚀速率对于制定合理的防腐措施和选择适合的金属材料具有重要意义。
在实际应用中,我们可以根据金属所处的环境条件来选择合适的防护措施,延缓金属的腐蚀速率,提高金属的使用寿命。


金属腐蚀速度的测量分析一、金属腐蚀速度的测量方法 1、重量法重量法是根据腐蚀前后试件质量的变化来测定金属腐蚀速度的,分为失重法和增重法两种。
当金属表面上的腐蚀产物容易除净且不至于损坏金属本体时常用失重法;当腐蚀产物完全牢靠地附着在试件表面时,则采用增重法。
对于失重法可由下式计算腐蚀速度:式中 V 失——金属的腐蚀速度,g·m-2·h-1; m 0——试件腐蚀前的质量,g ; m 1——试件腐蚀后的质量,g ; S ——试件的面积,m 2; t ——试件腐蚀时间,h 。
对于增重法,即当金属表面的腐蚀产物全部附着在上面,或者腐蚀产物脱落下来可以全部收集起来时,可用下式计算腐蚀速度:式中 V 增——金属的腐蚀速度,g·m-2·h-1; m 2——带有腐蚀产物的试件质量,g ;对于密度相同的金属,可以用上述方法比较其耐腐蚀性能,对于密度不同的金属,尽管单位表面上的质量变化相同,其腐蚀深度却不一样,对此,应用腐蚀深度来表示更为合适。
应当指出,重量法也有其局限和不足。
首先,它只考虑均匀腐蚀的情况,而没有考虑局部腐蚀的情况。
其次,对于失重法很难将腐蚀产物完全除去,如果用重量法测定其腐蚀速度,肯定不能说明实际情况。
另外,失重法的实验周期较长,短则几小时,多则数年乃至数十年,对于重量法要想做出腐蚀速度(V 增)-时间(t )曲线需要大量的样品和冗长的时间。
2、容量法对于伴随析氢或吸氧的腐蚀过程,通过测定一定时间内的析氢量或吸氧量来计算金属的腐蚀速度的方法即为容量法。
Stm m V 10-=失Stm m V 02-=增许多金属在酸性溶液中,某些电负性较强的金属在中性甚至于碱性溶液中都会发生氢去极化作用而遭到腐蚀,其中:阳极过程M→Mn++ne 阴极过程nH+ +ne→(n/2)H2↑在阳极上金属不断失去电子而溶解的同时,溶液中的氢离子与阴极上过剩的电子结合而析出氢气。
金属溶解的量和析氢出的量相当。

金属的腐蚀与防护知识点总结第三单元金属的腐蚀与防护知能定位1.了解金属腐蚀的缘故,能辨不金属发生腐蚀的类型。
2.了解金属电化学腐蚀的缘故及反应原理。
3.了解金属防护的普通办法及金属的电化学防护的原理。
情景切入铁生锈的现象随处可见,为啥铁在潮湿的环境中容易生锈?采取啥措施能够防止铁生锈呢?自主研习一、金属的电化学腐蚀1.金属腐蚀(1)定义金属或合金与身边环境中的物质发生化学反应而腐蚀损耗的现象。
(2)实质金属失去电子被氧化。
(3)类型①化学腐蚀:指金属与其他物质直截了当接触发生氧化还原反应而引起的腐蚀。
腐蚀过程中无电流产生。
②电化学腐蚀:指别纯的金属或合金发生原电池反应,使较爽朗的金属失去电子被氧化而引起的腐蚀。
2.电化学腐蚀(1)吸氧腐蚀:钢铁表面吸附的水膜酸性非常弱或呈中性时,氧气参加电极反应,发生吸氧腐蚀。
负极: 2Fe==4e-+2Fe2+;正极: 2H2O+O2+4e-==4OH-;总反应: 2Fe+O2+2H2O==2Fe(OH) 2。
最后生成铁锈(要紧成分为Fe2O3·xH2O),反应如下:4Fe(OH) 2+O2+2H2O==4Fe(OH) 3;2Fe(OH) 3==Fe2O3·xH2O+(3-x)H2O。
(2)析氢腐蚀:金属表面的电解质溶液酸性较强,腐蚀过程中别断有H2放出。
负极: Fe==Fe2++2e-;正极: 2H++2e-==H2↑;总反应:Fe+2H+==Fe2++H2↑。
二、金属的电化学防护1.金属的防护(1)本质:阻挠金属发生氧化反应。
(2)办法①改变金属内部结构,如制成合金等。
②加防护层,如在金属表面喷油漆、涂油脂、电镀等。
③电化学防护2.电化学防护(1)牺牲阳极的阴极爱护法将被爱护金属与比其更爽朗的金属连接在一起,更爽朗的金属作阳极(负极)被腐蚀,作为阴极(正极)的金属被爱护。
(2)外加电流的阴极爱护法(原理如图)课堂师生互动类型析氢腐蚀吸氧腐蚀形成条件水膜酸性较强水膜酸性较弱电解质溶液溶有CO2的水溶t液溶有O2的水溶液负极反应Fe-2e-==Fe2+正极反应2H++2e-==H2↑O2+2H2O+4e-==4OH-电子怎么流淌形成电通路Fe失2e-,成为Fe2+进入溶液,Fe失去的e-流入C极,H+趋向于C极,与C极上的e-结合成H2析出溶液Fe失2e-成为Fe2+进入溶液,Fe失去的e-流入C极,在C极O2获得e-成为OH-进入溶液其他反应及产物Fe2++2OH-==Fe(OH) 22Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3;2Fe(OH)3==Fe2O3·xH2O+(3-x)H2O普遍性吸氧腐蚀比析氢腐蚀更普遍考例1(2009·北京卷,6)下列叙述别正确的是()A..铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e--==4OH-D.工业上电解饱和食盐水的阳极反应:2Cl--2e-==Cl2↑解析:本题要紧考查电化学知识,只要掌握原电池和电解的原理就能作答,A项中锌作阳极,B项锌作负极,铁被爱护,C、D基本上正确的。

金属腐蚀的产生与腐蚀速度当金属和周围介质接触时,由发生化学作用或电化学作用二引起的破坏叫做金属的腐蚀。
除少数的贵重金属(如Au、Pt)需要像王水那样的特殊介质外,各种金属都有与周围介质发生作用而转变成离子的倾向,也就是说金属腐蚀是自然趋势(自发的),因此腐蚀现象是普遍存在的。
金属腐蚀直接或间接地造成巨大的经济损失,甚至会引起严重的事故;但金属腐蚀有时也会给人类带来好处(如刻字)。
因此,我们每一名操作人员都应了解金属腐蚀的产生机理。
根据金属腐蚀过程的不同特点,可将其分为化学腐蚀和电化学腐蚀两类。
一、化学腐蚀a)单纯由化学作用而引起的腐蚀成为化学腐蚀。
化学腐蚀是金属与周围介质的分子或原子直接发生氧化还原反应而引起的破坏。
例如电气绝缘油、润滑油、液压油以及干燥空气中的O2、H2S、SO2、CI2等物质与电气、机械设备中的金属接触时,在金属表面生成相应的氧化物、硫化物、氯化物等,都属于化学腐蚀。
温度对化学腐蚀的速度影响很大。
例如高温水蒸气对锅炉的腐蚀特别严重,将会发生下述反应:1.Fe+H2O→FeO+H22.Fe+H2O→Fe2O3+H23.Fe+H2O→Fe3O4+H2在反应生成一层氧化皮(FeO、Fe2O3、Fe3O4组成)的同时,还会发生脱碳现象。
这是由于钢铁中的渗碳体(Fe3C)与高温水蒸气反应的结果:Fe3C+H2O→+Fe+CO+H2b)这些反应都是可逆反应。
在渗碳体与水蒸气的反应中,碳从邻近的、尚未反应的金属内部逐渐扩散到反应区,于是金属中的碳逐渐减少,形成脱碳层。
由脱碳反应及其它氧化还原反应生成的氢因扩散渗入钢铁内部,使钢铁产生脆性(称氢脆)。
钢的脱碳和氢脆会造成刚的表面硬度和内部强度的降低。
这是非常有害的现象。
二、电化学腐蚀及电极极化作用如果我们将一块化学纯的锌投入稀盐酸中,几乎看不见氢气放出来。
但是当用一铜丝接触锌的表面,铜丝上即剧烈地放出氢气,锌粒逐渐溶解。
如果用含有较多杂质的工业粗锌投入稀盐酸中,也能明显地观察到有氢气放出。
