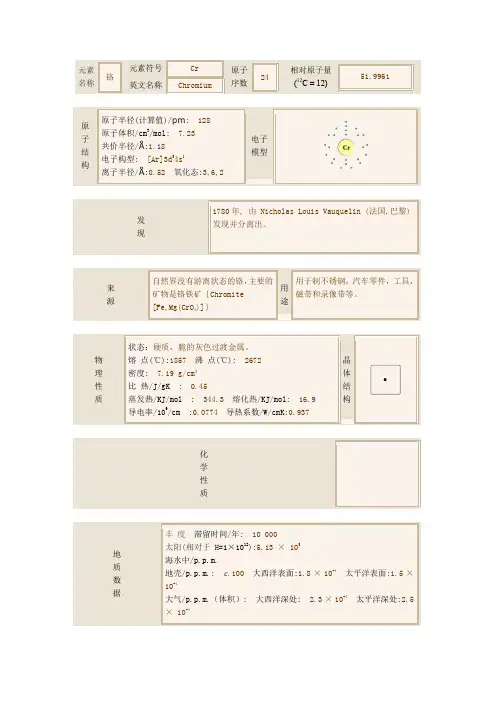
铬
- 格式:doc
- 大小:44.00 KB
- 文档页数:6


铬
鉻gè〈名〉一种蓝白色多价金属元素,原子序数24,通常制得的铬,质硬且脆,抗腐蚀,只以化合状态存在。
主要以铬铁矿形式存在,用铝热法、硅热法或电解法将它从矿石中分离出,主要用于合金(如供铬钢用的铬铁合金或如镍铬电阻合金)及电镀(如汽车减震器和内部装璜以及切削工具) [chromium]——元素符号Cr
性质:性状略带暗灰色的银白色金属(体心立方晶系)。
分子量:52
熔点(1857±20)℃
沸点2672℃
相对密度7.20℃
溶解性溶于稀硫酸、盐酸,不溶于水、硝酸、王水。
用途:用于炼制高温合金、电阻合金、精密合金。
产品规格: 80目,100目,150目,200目,250目,300目,350目
用途:热等静压铬靶原料,金属陶瓷,硬质合金添加,不绣铜添加,焊材,金刚石工具,激光熔覆,喷涂,等
性状:浅灰色粉末,
产品特性:粉度分布均匀,流动性,成型性好,气体杂质含量低。
易成型
Cr≥99.9% Fe≤0.001% Si≤0.004% Al≤0.025%
Cu≤0.0015% C≤0.01% S≤0.01%P≤0.007% Pb≤0.0004%
“铬”英文翻译:.[Chemistry] chromium。

铬元素符号Cr,银白色金属,在元素周期表中属ⅥB族,铬的原子序数24,原子量51.996,体心立方晶体,常见化合价为+3、+6和+2。
1797年法国化学家沃克兰(L.N.Vauquelin)在西伯利亚红铅矿(铬铅矿)中发现一种新元素,次年用碳还原,得金属铬。
因为铬能够生成美丽多色的化合物,根据希腊字chroma(颜色)命名为chromium。
化学性质铬能慢慢地溶于稀盐酸、稀硫酸,而生成蓝色溶液。
与空气接触则很快变成绿色,是因为被空气中的氧气氧化成绿色的Cr2O3的缘故。
Cr + 2HCl= CrCl2 + H2↑4CrCl2 + 4HCl + O2= 4CrCl3+ 2H2O铬与浓硫酸反应,则生成二氧化硫和硫酸铬(Ⅲ)。
2Cr + 6H2SO4 =Cr2(SO4)3+ 3SO2↑ + 6H2O但铬不溶于浓硝酸,因为表面生成紧密的氧化物薄膜而呈钝态。
在高温下,铬能与卤素、硫、氮、碳等直接化合。
铬与稀硫酸反应。
Cr + H2SO4 = CrSO4 + H2↑物理性质铬是重要的合金元素。
铬以金属铬和铬铁形式加入钢与合金中。
银白色金属,质极硬,耐腐蚀。
密度7.20克/cm3。
可溶于强碱溶液。
铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。
不溶于水。
镀在金属上可起保护作用。
历史简介铬是由法国化学家Nicholas Louis Vauquelin在巴黎于1798年发现的。
他被一种鲜红色的矿石吸引住了,其是于1766年在西伯利亚的金矿开采的,而且曾被归类于西伯利亚红铅。
知道它是铬铅矿,是铬酸铅的一种形式。
Vauquelin分析了它并确认它是一种铅矿石。
之后他将其溶解进了酸中,沉淀出铅,过滤掉之后,他把注意力集中到了留下的液剂上,他成功的从中独立出了铬。
因着迷于它在溶液中能产生的颜色的范围,他把它命名为chromium (铬),基于希腊词语chroma(颜色)。
他之后发现翡翠的绿色也是因为铬。

铬的化学元素
铬是一种重要的化学元素,属于第24周期元素,其元素符号为Cr,原子序数为24,原子质量为51.9961。
铬具有高密度、耐磨、韧性和耐腐蚀性,因此得到了广泛的应用。
铬是一种稀土元素,它的原子在晶体中具有正方形,自身表面具有金色的微量光泽,在大气中能被吸得非常深。
它是一种奥氏体结构的金属元素,其原子半径为128 pm。
它在普通温度下为固态,具有相当高的熔点。
由于铬的特性,它成为一种常见的合金材料。
例如,钢铁合金中添加铬能增加材料的强度,耐磨性和抗腐蚀性。
还可以用于制造电器部件,例如开关、电线、连接器和线圈等,以及许多其他化学应用。
除了上述的工业应用外,铬还在医学上有广泛的应用。
如果将铬肥料添加到土壤中,有助于植物吸收铬元素,促进植物的生长。
此外,铬还可以作为一种营养补充剂,能够有效促进人体健康。
总之,铬是一种重要的化学元素,它具有许多用途,包括工业应用和医学应用。
铬具有金属光泽,耐腐蚀性,韧性和耐磨性,因此得到了广泛的应用。
- 1 -。
![[课外阅读]稀有金属铬](https://uimg.taocdn.com/e787b6ec8762caaedd33d47f.webp)
[课外阅读]稀有金属铬铬,稀有金属元素,符号Cr,质硬而脆,抗腐蚀性强。
用于电镀和制造特种钢。
一种蓝白色多价金属元素,原子序数24,通常制得的铬,质硬且脆,抗腐蚀,只以化合状态存在。
主要以铬铁矿形式存在,用铝热法、硅热法或电解法将它从矿石中分离出,主要用于合金(如供铬钢用的铬铁合金或如镍铬电阻合金)及电镀(如汽车减震器和内部装璜以及切削工具) [chromium]——元素符号Cr铬钢管银白色金属,质硬而脆。
密度7.20克/厘米3。
熔点1857±20℃,沸点2672℃。
化合价+2、+3和+6。
电离能为6.766电子伏特。
金属铬在酸中一般以表面钝化为其特征。
一旦去钝化后,即易溶解于几乎所有的无机酸中,但不溶于硝酸。
铬在硫酸中是可溶的,而在硝酸中则不易溶。
在高温下被水蒸气所氧化,在1000℃下被一氧化碳所氧化。
在高温下,铬与氮起反应并为熔融的碱金属所侵蚀。
可溶于强碱溶液。
铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。
不溶于水。
铬合金元素名称:铬 [汉语拼音为 gè] 元素符号:Cr 元素原子量:51.9961 工业上使用的铬矿石为铬铁矿,属尖晶石(MgO?Al2O3)和磁铁矿(FeO?Fe2O3)类,其通用化学式是(Fe,Mg)O?(Cr,Fe,Al2O3)。
由于二价元素(Mg2+、Fe2+、Zn2+ )和三价元素(Al3+、Fe3+、Cr3+)相互置换,可以出现各种不同成分的矿石。
除主成分FeO及Cr2O3外,一般含有不同成分的 MgO、Al2O3 及其他杂质。
矿石结构组成对使用有明显影响,如铬尖晶石比铬铁矿(FeO?Cr2O3)难于还原;含蛇纹石的铬矿石,若其中挥发物大于 2%,用它制造的铬质耐火砖在加热到1000℃时,会因释放结晶水而炸裂。
美国1978年耗用铬铁矿917000吨,其用途分配如下:冶金61%,化工21%,耐火材料18%。
1981年伦敦市场铬矿石价格:土耳其矿(48%Cr2O3,Cr/Fe=3)130~135美元/吨,南非(阿扎尼亚)铬矿(44%Cr2O3)60~70美元/吨。


铬的拼音_铬的组词_铬的笔顺_铬的意思
及诗句大全
铬的拼音_铬的组词_铬的笔顺_铬的意思及诗句大全的详细拼音、笔顺、诗句,觉得有用就收藏了,这里给摘抄给大家学习。
铬的拼音,铬的组词,铬的笔顺,铬的意思,铬的笔画,铬的部首,铬的英文,铬的成语,铬的诗句
铬的拼音:gè
铬的笔顺:ノ一一一フノフ丶丨フ一
铬的部首:钅
铬的笔画:11
铬的结构:左右结构
铬的英文:chromium
铬的繁体字:鉻
铬的同音字:各、个、個、鉻、吤、硌、箇、虼、、亇
铬的组词:铬钢、铁铬、铬铁
铬的意思:
一、◎一种金属元素,符号Cr,质硬而脆,抗腐蚀性强。
用于电镀和制造特种钢。
铬的诗句:
一、平视苍铬变《九月六日泛舟航村而舟人不审误抵道场之麓越》
铬的拼音_铬的组词_铬的笔顺_铬的意思及诗句大全全部内容,
1。

铬的化学元素铬是一种重要的化学元素,原子序数为24,期子数为24,核电荷数为24,分子量为 51.9961。
它主要以过氧化铬(CrO2)的形式存在于矿石、砂土和土壤中,也常常作为含铬的化学溶液存在于水中,例如海水、河水和淡水。
铬在自然界中大量存在,但由于不溶于水,所以在空气和水时之间稳定形式受到阻碍,因此它没有独立的存在。
其属于正价铬,在环境中常常以无机离子的形式(Cr2O7-2、Cr3+)存在,由于CRO4-1属于强碱性的离子,而 Cr2O7-2属于强酸性的离子,所以铬根据其电离程度在水中有五个不同的存在形态,它们分别是Cr3+、Cr2O7-2、Cr6+、CrO4-1以及CrO42-。
铬具有一定的元素性质,与大部分元素差不多,它的离子半径为0.97埃,其最外层电子排布为4s2 3d5,是一种中等容易氧化的金属元素,它在自然界中是黑色或棕色,广泛存在于矿物中,几乎所有矿石中都含有微量的铬,如铬矿石、磁石和铁铬合金。
铬对人类和动物是有害的,摄入大量的铬会危害机体健康,人若长期吸入铬烟雾、铬粉尘及铬熔结物中的铬就会遭受铬中毒的困扰,铬中毒主要表现在消化道炎症,皮肤病及呼吸道疾病上,由于铬是一种毒性很高的物质,所以要在工业中对铬进行有效的环保处理。
另外,铬对人类有重要的使用价值。
它是我国工业上最为重要的金属之一,在电力、机械、化工等行业里都有应用,也因其良好的抗腐蚀能力而被广泛应用于制鞋、家具、电气等行业。
同时,铬也是镶嵌宝石、黄金首饰加工中的常用材料之一。
综上所述,铬是一种重要的化学元素,自然界中广泛存在,对人类和动物具有危害性,但同时铬也是工业上的重要金属材料之一,有重要的使用价值,所以在环境保护和使用价值上都要妥善处理。

铬元素铬是最硬的单质金属。
如果用一把纯铬的刀在钢铁上刻字,就跟美工刀在塑料上划出痕迹一样轻松。
你可能听过“莫氏硬度表”,它是矿物学、宝石学中常用的标准,按照这个标准,金刚石的硬度为10,二单质铬的硬度则达到了9。
红宝石之所以红,就是因为含铬。
红宝石的主体成分其实是氧化铝,氧化铝本身是没有颜色的。
氧化铝形成矿物之后,被称为刚玉。
当刚玉中有一部分铝被铬替代的时候,才会变成红色,形成红宝石。
天然的红宝石就是这种结构,人造红宝石也是利用了这一原理。
“铬污染”是经常在新闻中看到的词,也是环境污染领域备受关注的话题。
铬有很多种不同的状态,最常见的两种被称为三价铬和六价铬,三价铬几乎无毒,但是六价铬的毒性很大。
工业生产中,产生六价铬的情况很常见,比如电镀、制革、金属加工等等,都会排出大量的含铬的废水废气。
很多人知道铬属于黑色金属,但其实铬是银白色的。
黑色金属是炼铁工业遗留下来的俗称,因为铁合金大多呈黑色,所以钢铁工业中最常用的铁、锰、铬就都被笼统地称为黑色金属。
但这其中,铬是非常冤枉的,因为它白得通透,即使氧化了表面也是白的。
铬是一种很活泼的金属元素,但是在做过钝化处理之后,它抗腐蚀性特别强,就算是能腐蚀金的王水和硝酸这种这样的强腐蚀性物质,也拿它没办法。
绝大多数不锈钢品种都是含铬的,铬不仅自身耐腐蚀,当它和铁组成合金之后,也能让容易生锈的铁变得不再容易生锈。
比如说有一种316L型不锈钢,被称为钛钢,抗腐蚀性能非常优异,但它其实通常都不含钛,而是主要由铁、铬、镍三种元素组成。
铬也可以用来电镀。
因为铬的本色很白,硬度又高,还不容易被腐蚀。
汽车的进气格栅,是生活中最常见的镀铬器件。
铬的英文chromium来自于希腊语chroma,就是多彩的意思。
因为铬的化合物非常多彩,可以呈现出红色、橙色、黄色、蓝色、绿色、紫色等多种颜色。
至今很多颜料都还是含铬的原料,如铬黄。
铬变色的这个特性,曾经被用来检验酒驾。
检测酒驾最常用的方法是检验呼气中的酒精浓度,早期的传感器技术不够先进,需要有颜色变化来辅助判断,这时候铬就派上了用场。

矿物质之铬元素
铬是体内的微量元素之一,其在体内的含量随着年龄的增大而逐渐减少。
铬的需要量虽少,但能帮助胰岛素促进葡萄糖进入细胞内的效率,是重要的血糖调节剂。
在血糖调节方面,特别是对糖尿病患者而言有着重要的作用。
它有助于生长发育,并对血液中的胆固醇浓度也有控制作用,缺乏时可能会导致心脏疾病。
≮功效≯
帮助成长;
防止动脉硬化、降低血压,预防高血压;
预防心脏病;
帮助胰岛素作用,降低血糖,辅助治疗糖尿病。
≮建议每日摄取量≯
一般人对铬的日需要量为50-200μg。
锌可以与铬相辅相成。
≮食物来源≯
未精制的谷类、新鲜水果、带皮的土豆、乳品、蛋、蛤类、酵母、啤酒、麦
芽、牛肉、牛肝、鸡肉、栗米油、葵花籽油等。
≮需要人群≯
血糖高、血压高的人可适当补铬。
≮缺乏症≯
缺乏铬可能会导致生长发育不良和周围神经炎,并且美国医学营养研究机构认为,缺铬可能是动脉硬化和糖尿的原因之一。
化学元素铬铬是一种化学元素,其化学符号为Cr,原子序数为24。
它是一种具有略微金属光泽的灰色固体。
铬是一种过渡金属,它可在自然界中以不同的形式存在,如铬矿物、铬锰矿石、铬铁矿石和其他矿物中。
铬是地壳中的第21种最常见元素之一。
它的存在对于生命和人们的生活都具有重要的意义。
铬的物理和化学特性在自然界中,铬通常以三价或六价的形式存在。
其中,三价铬是一种具有很高反应性的形式,它可以与氧气、硫化氢等物质反应。
六价铬则是一种稳定的形式,它通常用于制备不锈钢、铬酸盐等材料。
铬是一种硬度较高的金属,具有很好的延展性和韧性,并且可以耐受高温。
铬的熔点为1907℃,沸点为2672℃。
在干燥的空气中,铬可以长期保持不变,但在潮湿的环境中,它容易腐蚀。
铬的应用铬是一种广泛应用的金属,主要用于制造不锈钢、合金、电镀等方面。
具有不锈、高温耐蚀性和装饰性的不锈钢,其主要成分是铬。
铬合金的加入可以改善钢材的力学性能,耐磨性和抗腐蚀性。
除此之外,铬还广泛应用于电镀行业。
电镀铬可以制作具有高光泽、优美的外观以及较高的抗腐蚀性和耐磨性的表面。
在化学工业中,铬及其化合物也具有重要用途。
例如,铬酸盐是一种强氧化剂,可用于清洗和消毒等方面。
铬的健康效益和风险铬在人体内具有很高的生物学价值。
它是一种重要的人体微量元素,对人体代谢、免疫系统和生殖系统等都具有重要作用。
人体内的铬需要从食物中摄取,并且可以通过一些食物中比较丰富的铬来满足需求,如放养家禽和牲畜的食物,谷类、干豆类、酵母等。
然而,过量摄入铬也可能对人体健康造成风险。
当铬摄入过量时,会使其转变为六价铬,从而导致细胞损伤和过敏反应。
过量摄入铬还可能导致身体出现各种病症,如胃肠道问题、头晕、头痛、疲劳等。
因此,正确地摄取铬是非常重要的。
总结铬是一种重要的金属元素,具有广泛的应用。
它是一种不可或缺的人体微量元素,对人们的健康具有重要意义。
然而,过量摄入铬仍然可能对人体健康造成风险,因此正确地摄取铬是非常必要的。
铬的性质及分析方法综述一、铬的基本性质表1:铬的基本性质元素符号Cr原子系数24相对原子质量51.996 g/mol颜色金属铬是银白有光泽金属熔点2130℃沸点2945℃密度7.20 g/cm3导电性差机械性能质硬同位素及放射线49Cr、50Cr、51Cr、52Cr、53Cr、54Cr金属铬的还原能力强,能溶于盐酸、硫酸和高氯酸;但在其它酸中会形成保护性氧化膜,连王水也不可溶解;高温下能被金属稳定性强碱侵蚀。
所属族系铬位于第三周期第VIB族。
化学活性铬为不活泼金属,在常温下对氧和湿气都是稳定的,但和氟反应生成CrF3。
金属铬在酸中一般以表面钝化为其特征。
一旦去钝化后,极易溶解于几乎所有的无机酸中,但不溶于硝酸。
在高温下,铬与氮起反应并被碱所侵蚀。
可溶于强碱溶液。
铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。
不溶于水。
镀在金属上可起保护作用。
温度高于600℃时铬和水、氮、碳、硫反应生成相应的Cr2O3,Cr2N和CrN, Cr7C3和Cr3C2,C r2S3。
铬和氧反应时开始较快,当表面生成氧化薄膜之后速度急剧减慢;加热到1200℃时,氧化薄膜破坏,氧化速度重新加快,到2000℃时铬在氧中燃烧生成Cr2O3。
铬很容易和稀盐酸或稀硫酸反应,生成氯化物或硫酸盐,同时放出氢气。
化合价化合价在分析化学中有-2价、-1价、0价、+1价、+2价、+3价、+4价、+5价、+6价。
氧化物铬有+3和+6两种氧化态的氧化物。
卤化物氟化铬具有腐蚀性,受高热分解成氟化氢等有毒气体;三氯化铬易溶于水,溶于乙醇,不溶于乙醚。
加热分解,用于制备铬盐、媒染剂、镀铬、颜料、催化剂等,由氢氧化铬与盐酸作用制得。
氯化铬酰由三氧化铬与盐酸作用制得,易挥发。
硫化物硫化铬是铬的硫化物,化学式Cr2S3,不溶于水。
盐类主要为铬酸盐和重铬酸盐资源情况金球铬资源丰富,现己探明储量约为75亿吨,可开采储量为48亿吨,主要分布在南非(83.3%)、哈萨克斯塔(8.9%)、津巴布韦(3.9%)等地冶炼制备钢铁工业中广泛应用的铬铁合金和硅铬合金是用电炉冶炼的。
书山有路勤为径,学海无涯苦作舟金属铬知识铬是有光泽的灰色金属,密度7.2,熔点1857℃,沸点2672℃,有延展性,但含氧、氢、碳和氮等杂质时变得硬而脆。
铬的化学性质不活泼,常温下对氧和水汽都是稳定的,铬在高于600℃时开始和氧发生反应,但当表面生成氧化膜以后,反应便缓慢,当加热到1200℃时,氧化膜被破坏,反应重新变快。
高温下,铬与氮、碳、硫发生反应。
铬在常温下就能和氟作用。
铬能溶于盐酸、硫酸和高氯酸,遇硝酸后钝化,不再与酸反应。
铬能与镁、钛、钨、锆、钒、镍、钽、钇形成合金。
铬及其合金具有强抗腐蚀能力。
在自然界中目前已发现的含铬矿物约有50 余种,分别属于氧化物类、铬酸盐类和硅酸盐类。
此外还有少数氢氧化物、碘酸盐、氮化物和硫化物。
其中氮化铬和硫化铬矿物只见于陨石中。
具有工业价值的铬矿物都属于铬尖晶石类矿物,它们的化学通式为(Mg、Fe2+)(Cr、Al、Fe3+)2O4 或(Mg、Fe2+)O(Cr、Al、Fe3+)2O3,其Cr2O3 含量为18%~62%。
常见的铬矿物有:(1)铬铁矿,化学成分为(Mg、Fe)Cr2O4,介于亚铁铬铁矿(FeCr2O4,含FeO 32.09%、Cr2O3 67.91%)与镁铬铁矿(MgCr2O4,含Mg 20.96%、Cr2O3 79.04%)之间,通常有人将亚铁铬铁矿和镁铬铁矿也都称为铬铁矿。
铬铁矿为等轴晶系,晶体呈细小的八面体,通常呈粒状和致密块状集合体,颜色为黑色,条痕呈褐色,半金属光泽,硬度5.5,密度4.2~4.8,具弱磁性。
铬铁矿是岩浆成因矿物,产于超基性岩中,当含矿岩石遭受风化破坏后,铬铁矿常转入砂矿中。
铬铁矿是炼铬的最主要的矿物原料,富含铁的劣质矿石可作高级耐火材料。
(2)富铬类晶石,又称铬铁尖晶石或铝铬铁矿,化学成分为Fe(Cr,Al)2O4,含Cr2O3 32%~38%。
(3) 硬铬尖晶石,化学成分为(Mg、Fe)(Cr、Al)2O4,含Cr2O3 32%~50%。
化学元素铬铬是化学元素周期表中的一种金属元素,原子序数为24,化学符号为Cr。
它是一种坚硬、有光泽的银白色金属,具有很高的抗腐蚀性和耐热性。
铬在自然界中主要以铬铁矿的形式存在,是地壳中的重要成分之一。
铬的发现可以追溯到18世纪末。
1797年,法国化学家瓦克兰在对铬铁矿进行研究时首次发现了铬元素。
他将铬铁矿与盐酸反应,得到一种黄绿色的溶液,其中含有一种新的金属元素。
瓦克兰将这种金属元素命名为“铬”,意为颜色。
铬在工业生产中有着广泛的应用。
由于其抗腐蚀性和耐热性的特点,铬被广泛用于不锈钢制造。
不锈钢是一种具有抗腐蚀性能的合金,其中铬是主要的合金元素之一。
不锈钢在建筑、汽车、航空航天等领域有着广泛的应用,成为现代工业中不可或缺的材料。
除了不锈钢,铬还广泛应用于电镀工艺中。
通过电镀,可以将铬镀在其他金属的表面,提高其外观和耐腐蚀性能。
铬电镀被广泛应用于汽车零部件、家居用品、电子设备等制造过程中,使产品更具美观和耐用性。
铬还被用于制造合金和化工产品。
铬合金具有良好的机械性能和高温强度,被广泛应用于航空航天、船舶、汽车等领域。
铬的化合物也被用于制造颜料、媒染剂和催化剂等化工产品。
然而,铬也有一定的毒性。
在高浓度的铬环境中,人体暴露于铬化合物可能引发铬中毒。
铬中毒可导致呼吸系统、皮肤和消化系统的疾病,严重时甚至可能致命。
因此,在工业生产和使用铬的过程中,需要严格控制铬的排放和暴露,保护工作人员和环境的安全。
总的来说,铬作为一种重要的金属元素,具有广泛的应用价值。
它在不锈钢制造、电镀工艺以及合金和化工产品制造中发挥着重要作用。
然而,我们也要认识到铬的毒性和环境风险,并采取相应的措施来保护人类健康和环境安全。
通过科学的研究和技术创新,我们可以更好地利用铬的优势,同时减少其对环境的负面影响,实现可持续发展的目标。
、铬(Cr)铬能增加钢的淬透性并有二次硬化作用。
可提高高碳钢的硬度和耐磨性而不使钢变脆;含量超过12%时。
使钢有良好的高温抗氧化性和耐氧化性介质腐蚀的作用。
还增加钢的热强性,铬为不锈耐酸钢及耐热钢的主要合金元素。
铬能提高碳素钢轧制状态的强度和硬度。
降低伸长率和断面收缩率。
当铬含量超过15%时,强度和硬度将下降,伸长率和断面收缩率则相应地有所提高。
含铬钢的零件经研磨容易获得较高的表面加工质量。
铬在调质结构钢中的主要作用是提高淬透性。
使钢经淬火回火后具有较好的综合力学性能,在渗碳钢中还可以形成含铬的碳化物,从而提高材料表面的耐磨性。
含铬的弹簧钢在热处理时不易脱碳。
铬能提高工具钢的耐磨性、硬度和红硬性。
有良好的回火稳定性。
在电热合金中,铬能提高合金的抗氧化性、电阻和强度。
(1) 对钢的显做组织及热处理的作用A、铬与铁形成连续固溶体,缩小奥氏体相区城。
铬与碳形成多种碳化物,与碳的亲和力大于铁和锰而低于钨、钼等.铬与铁可形成金属间化合物σ相(FeCr)B、铬使珠光体中碳的浓度及奥氏体中碳的极限溶解度减少C、减缓奥氏体的分解速度,显著提高钢的淬透性.但亦增加钢的回火脆性倾向(2)对钢的力学性能的作用A、提高钢的强度和硬度.时加入其他合金元素时,效果较显著B、显著提高钢的脆性转变温度C、在含铬量高的Fe-Cr合金中,若有σ相析出,冲击韧性急剧下降(3)对钢的物理、化学及工艺性能的作用A、提高钢的耐磨性,经研磨,易获得较高的表面光洁度B、降低钢的电导率,降低电阻温度系数C、提高钢的矫顽力和剩余磁感.广泛用于制造永磁钢D、铬促使钢的表面形成钝化膜,当有一定含量的铭时,显著提高钢的耐腐蚀性能(特别是硝酸)。
若有铬的碳化物析出时,使钢的耐腐蚀性能下降E、提高钢的抗氧化性能F、铬钢中易形成树枝状偏析,降低钢的塑性G、由于铬使钢的热导率下降,热加工时要缓慢升温,锻、轧后要缓冷(4)在钢中的应用A、合金结构钢中主要利用铬提高淬透性,并可在渗碳表面形成含铬碳化物以提高耐磨性B、弹簧钢中利用铬和共他合金元素一起提供的综合性能C、轴承钢中主要利用铬的特殊碳化物对耐磨性的贡献及研磨后表面光沽度高的优点D、工具钢和高速钢中主要利用铬提高耐磨性的作用,并具有一定的回火稳定性和韧性E、不锈钢、耐热钢中铬常与锰、氮、镍等联合便用,当需形成奥氏体钢时,稳定铁素体的铬与稳定奥氏体的锰、镍之间须有一定比例,如Cr18Ni9等F、我国铬资源较少.应尽量节省铬的使用2、钼(Mo)钼在钢中能提高淬透性和热强性。
防止回火脆性,增加剩磁和矫顽力以及在某些介质中的抗蚀性。
在调质钢中,钼能使较大断面的零件淬深、淬透,提高钢的抗回火性或回火稳定性,使零件可以在较高温度下回火,从而更有效地消除(或降低)残余应力,提高塑性。
在渗碳钢中钼除具有上述作用外,还能在渗碳层中降低碳化物在晶界上形成连续网状的倾向,减少渗碳层中残留奥氏体,相对地增加了表面层的耐磨性。
在锻模钢中,钼还能保持钢有比较稳定的硬度,增加对变形、开裂和磨损等的抗力。
在不锈耐酸钢中,钼能进一步提高对有抗酸(如蚁酸、醋酸、草酸等)以及过氧化氢、硫酸,亚硫酸、硫酸盐、酸性染料、漂白粉液等的抗蚀性。
特别是由于钼的加入,防止了氯离子存在所产生的点腐蚀倾向。
含1%左右钼的W12Cr4V4Mo高速钢具有高的耐磨性、回火硬度和红硬性等。
(1)对钢的显做组织及热处理的作用A、钼在钢中可固溶于铁素体、奥氏体和碳化物中,它是缩小奥氏体相区的元素B、当钢含量较低时,与铁、碳形成复合的渗碳体;含量较高时可形成钢的特殊碳化物C、钼提高钢的淬透性,其作用较铬强.而稍逊于锰D、钼提高钢的回火稳定性,作为单一合金元素存在时,增加钢的回火脆性;与铬、锰等并存时,钼又降低或抑止因其他元素所导致的回火脆性(2)对钢的力学性能的作用A、钼对铁素体有固溶强化作用.同时也提高碳化物的稳定性.从而提高钢的强度B、钼对改善钢的延展性和韧性以及耐磨性起到有利作用C、由于钼使形变强化后的软化和恢复温度以及再结晶温度提高,并强烈提高铁素体的蠕变抗力,有效抑制渗碳体在450-600℃下的聚集.促进特殊碳化物的析出,因而成为提高钢的热强性的最有效的合金元素(3)对钢的物理、化学及工艺性能的作用A、在含碳1.5%的磁钢中,2%-3%的钢提高剩余磁感和矫顽力B、在还原性酸及强氧化性盐溶液中都能使钢表面钝化.因此钼可以普遍提高钢的抗蚀性能,防止钢在氯化物溶液中的点蚀C、钼含量较高(>3%)时使钢的抗氧化性恶化D、含钼不超过8%的钢仍可以锻、轧,但含量较高时,钢对热加工的变形抗力增高(4)在钢中的应用A、在调质和渗碳结构钢、弹簧钢、轴承钢、工具钢、不锈耐酸钢、耐热钢、磁钢中都得到了广泛应用B、铬钼钢在许多情况下可代替铬镍钢来制造重要的部件C、我国富产钼,但在世界范围内的储量并不丰富。
含钼钢在我国应适当发展,但钼是重要战略物资,应注意合理和节约使用3、硅(Si)硅能溶于铁素体和奥氏体中提高钢的硬度和强度,其作用仅次于磷,较锰、镍、铬、钨、钼和钒等元素强。
但含硅超过3%时,将显著降低钢的塑性和韧性。
硅能提高钢的弹性极限、屈服强度和屈服比(σs/σb),以及疲劳强度和疲劳比(σ-1/σb)等,这是硅或硅锰钢可作为弹簧钢种的缘故。
硅能降低钢的密度、热导率和电导率。
能促使铁素体晶粒粗化。
降低矫顽力。
有减小晶体的各向异性倾向,使磁化容易,磁阻减小,可用来生产电工用钢,所以硅钢片的磁滞损耗较低,硅能提高铁素体的磁导率,使硅钢片在较弱磁场下有较高的磁感强度。
但在强磁场下,硅降低钢的磁感强度。
硅因有强的脱氧力,从而减小了铁的磁时效作用。
含硅的钢在氧化气氛中加热时,表面将形成一层SiO2薄膜,从而提高钢在高温时的抗氧化性。
硅能促使铸钢中的柱状晶成长,降低塑性。
硅钢若加热或冷却较快,由于热导率低,钢的内部和外部温差较大,因而易裂。
硅能降低钢的焊接性能。
因为与氧的亲合力硅比铁强,在焊接时容易生成低熔点的硅酸盐,增加熔渣和熔化金属的流动性,引起喷溅现象,影响焊缝质量。
硅是良好的脱氧剂。
用铝脱氧时酌加一定量的硅,能显著提高铝的脱氧能力。
硅在钢中本来就有一定的残存,这是由于炼铁炼钢作为原料带入的。
在沸腾钢中,硅限制在<0.07% ,有意加入时,则在炼钢时加入硅铁合金。
(1)对钢的显做组织及热处理的作用A、作为钢中的合金元素,其含量一般不低于0.4 %。
以固溶体形态存在于铁素体或奥氏体中,缩小奥氏体相区B、提高退火、正火和淬火温度,在亚共析钢中提高淬透性C、硅不形成碳化物,有强烈的促进碳的石墨化的作用,在硅含量较高的中碳和高碳钢中,如不含有强碳化物形成元素,易在一定温度条件下发生石墨化D、在渗碳钢中,硅减小渗碳层厚度和碳的浓度E、硅对钢水有良好脱氧作用(2)对钢的力学性能的作用A、提高铁素体和奥氏体的硬度和强度,其作用较Mn 、Ni 、Cr . W 、Mo、V 等更强;显著提高钢的弹性极限、屈服强度和屈强比(σs/σb).并提高应劳强度和疲劳比(σ-1/σb)B、硅含量超过3 %时显著降低钢的塑性和韧性;硅提高塑/脆转变温度C、硅易使钢中形成带状组织,使横向性能低于纵向性能D、改善钢的耐磨性能(3)对钢的物理、化学及工艺性能的作用A、降低钢的密度、热导率、电导率和电阻温度系数B、硅钢片的涡流损耗量显著低于纯铁,矫顽力、磁阻和磁滞损耗较低.磁导率和磁感强度较高。
但在强磁场中,硅降低磁感强度C、提高高温时钢的抗氧化性能,但硅含量高时,表面脱碳加剧D、硅含量超过2.5 %的钢,其变形加工较为困难E、硅降低钢的可焊性(4)在钢中的应用A、在普通低合金钢中提高强度,改善局部腐蚀抗力,在调质钢中提高淬透性和抗回火性,是多元合金结构钢中的主要合金组元之一B、硅含量为0.5 %-2.8 %的SiMn 或SiMnB 钢(碳含量0.5 %-0.7 %)广泛用于高载荷弹黄材料,同时加人W 、V 、Mo、Nb 、Cr等强碳化物形成元素C、硅钢片为含硅1.O %-4.5 %的低碳和超低碳钢,用于电机和变压器D、在不锈钢和耐蚀钢中,与Mo 、W 、Cr 、Al、Ti、N 等配合,提高抗蚀和抗高温氧化能力E、硅含量较高的石墨钢用于冷作模具材料4、锰(Mn)锰是良好的脱氧剂和脱硫剂。
钢中一般都含有一定量的锰,它能消除或减弱由于硫所引起的钢的热脆性,从而改善钢的热加工性能。
锰和铁形成固溶体,提高钢中铁素体和奥氏体的硬度和强度;同时又是碳化物形成元素,进入渗碳体中取代一部分铁原子。
锰在钢中由于降低临界转变温度。
起到细化珠光体的作用。
也间接地起到提高珠光体钢强度的作用;锰稳定奥氏体组织的能力仅次于镍,也强烈增加钢的淬透性。
已用含量不超过2%的锰与其他元素配合制成多种合金钢。
锰具有资源丰富、效能多样的特点,获得了广泛的应用,如含锰较高的碳素结构钢、弹簧钢。
在高碳高锰耐磨钢中。
锰含量可达10%一14% ,经固溶处理后有良好的韧性,当受到冲击而变形时,表面层将因变形而强化,具有高的耐磨性。
锰与硫形成熔点较高的MnS 。
可防止因FeS而导致的热脆现象。
锰有增加钢晶粒粗化的倾向和回火脆性敏感性。
若冶炼浇铸和锻轧后冷却不当,容易使钢产生白点。
(1)对钢的显做组织及热处理的作用A、锰是良好的脱氧剂和脱硫剂,工业用钢中一般均含有一定量的锰B、锰固溶于铁素体和奥氏体中.扩大奥氏体区,使临界温度A4点升高,A3点降低,(α+γ)区下移.当锰含量超过12%时,上临界点降至室温以下,使钢在室温时形成单一奥氏体组织。
在降低共析温度同时,使共析体中的碳含量减少C、锰强烈降低钢的Ar1和马氏体转变温度(其作用仅次于碳)和钢中相变的速度,提高钢的淬透性,增加残余奥氏体含量D、使钢的调质组织均匀、细化,避免了渗碳层中碳化物的聚集成块,但增大了钢的过热敏感性和回火脆性倾向E、锰是弱碳化物形成元素(2)对钢的力学性能的作用A、锰强化铁素体或奥氏体的作用不及碳,磷、硅,在增加强度的同时,对延展性无影响B、由于细化了珠光体,显著提高低碳和中碳珠光体钢的强度,使延展性有所降低C、通过提高淬透性而提高了调质处理索氏体钢的力学性能D、在严格控制热处理工艺、避免过热时的晶粒长大以及回火脆性的前提下,锰不会降低钢的韧性(3)对钢的物理、化学及工艺性能的作用A、随锰含量的增加,钢的热导率急剧下降,线胀系数上升,使快速加热或冷却时形成较大内应力,工件开裂倾向增大B、使钢的电导率急剧降低,电阻率相应增大,电阻温度系数下降C、使矫顽力增大,饱和磁感、剩余磁感和磁导率均下降,因而锰对永磁合金有利,对软磁合金有害D、锰含量很高时,钢的抗氧化性能下降E、使钢中的硫形成较高熔点的MnS ,避免了晶界上的FeS 薄膜,消除钢的热脆性,改善热加工性能F、高锰奥氏体钢的变形阻力较大,且钢锭中柱状结晶明显,锻轧时较易开裂G、由于提高了淬透性和降低了马氏体转变温度,对焊接性能有不利影响。