分析化学作业(第十四章)参考答案
- 格式:doc
- 大小:103.00 KB
- 文档页数:3

第十四章胶体分散系统和大分子溶液一、选择题1. .以下说法中正确的是:( ) A通过超显微镜能看到胶体粒子的大小和形状;B溶胶和真溶液一样是均相系统;C溶胶能产生丁铎尔效应;D溶胶在热力学和动力学上都是稳定系统。
2.溶胶的基本特性之一是( ) A热力学上和动力学上皆属于稳定系统;B热力学上和动力学上皆属于不稳定系统;C热力学上不稳定而动力学上属于稳定系统;D热力学上稳定而动力学上属于不稳定系统。
3外加直流电场于胶体溶液,向某一电极作定向移动的是:( ) A胶粒;B胶核;C胶团;D紧密层4.区别溶胶与真溶液和悬浮液最简单灵敏的方法是:( ) A乳光计测定粒子浓度; B观察丁铎尔效应;C超显微镜测定粒子大小;D观察ζ电位。
5.工业上为了将不同蛋白质分子分离,通常采用的方法是利用溶胶性质中的: ( ) A电泳;B电渗;C沉降;D扩散。
6.当溶胶中加入大分子化合物时:( ) A一定使溶胶更稳定;B一定使溶胶更容易为电解质所聚沉;C对溶胶稳定性影响视加入量而定;D对溶胶稳定性没有影响。
7.对于Donnan平衡,下列哪种说法是正确的:( ) A膜两边同一电解质的化学位相同;B膜两边带电粒子的总数相同;C膜两边同一电解质的浓度相同;D膜两边的离子强度相同。
8.Donnan平衡产生的本质原因是:( ) A溶液浓度大,大离子迁移速度慢;B小离子浓度大,影响大离子透过半透膜;C大离子不能透过半透膜,且因静电作用使小离子在膜两边的浓度不同;D大离子浓度大,妨碍小离子通过半透膜。
9.对大分子溶液发生盐析的现象,不正确的说法是:( ) A加入大量电解质才能使大分子化合物从溶液中析出;B盐析过程与电解质用量无关;C盐析的机理包括电荷中和和去极化两个方面;D电解质离子的盐析能力与离子价态关系不大。
10.有关胶粒ζ电势的叙述中,下列说法不正确的是:( )A正比于热力学电势φ;B只有当固液相对运动时,才能被测定;C与胶粒的扩散速度无关;D不能利用能斯特公式计算。

第十四章胶体分散体系和大分子溶液练习题一、选择题2.对于有过量KI存在的AgI溶液,电解质聚沉能力最强的是:()(A)K3[Fe(CN)6](B)MgSO4(C)FeCl3(D)NaCl3.在大分子溶液中加入大量的电解质,使其发生聚沉的现象称为盐析,产生盐析的主要原因是:()(A)电解质离子强烈的水化作用使大分子去水化(B)降低了动电电位(C)由于电解质的加入,使大分子溶液处于等电点(D)动电电位的降低和去水化作用的综合效应4.(1)在晴朗的白昼,天空呈蔚蓝色的原因是:()(2)日出和日落时,太阳呈鲜红色的原因是:()(A)蓝光波长短,透射作用显著(B)蓝光波长短,散射作用显著(C)红光波长长,透射作用显著(D)红光波长长,散射作用显著5.关于电动电位描述正确的是:()(A)电动电位是恒定不变的(B)电动电位是胶核与介质间的电位差(C)电动电位是可以粗略地看成吸附层与扩散层间的电位差(D)电动电位仅与吸附的离子浓度有关7.在分析化学上,有两种利用光学性质测定胶体溶液浓度的仪器,一是比色计,另一个是比浊计,分别观察的是胶体溶液的:()(A)透射光;折射光(B)散射光;透射光(C)透射光;反射光(D)透射光;散射光8.向FeCl3(aq)中加入少量氨水,可制备稳定的氢氧化铁溶胶,此时胶体粒子带电荷情况为:()(A)总是带正电(B)在pH较大时带正电(C)总是带负电(D)在pH较大时带负电9.对于Helmholz紧密双电层模型,下列描述中不正确的是:()(A)带电的固体表面和带相反电荷的离子构成平行的两层,称为双电层(B)此双电层距离约等于离子半径,如同一个平板电容器(C)在此双电层内,热力学电势φ0呈直线下降(D)由于模型上的缺陷,此双电层模型不能说明电泳现象10.用三氯化铝AlCl3水解制备的氢氧化铝溶胶,哪种物质聚沉能力最强?()哪种物质聚沉能力最弱?()(A)Na2SO4(B)MgCl2(C)La(NO3)3(D)K4[Fe(CN)6]二、填空题11.超离心沉降分为两种方法:(1)沉降平衡法,它是_______________平衡(2)沉降速度法,它是________________平衡12.界面吉布斯自由能和界面张力的相同点是不同点是。

第十四章极谱法与伏安法14.1复习笔记一、极谱分析法的基本原理1.极谱法的装置图14-1极谱分析基本装置1—储汞瓶2—汞3—塑料管4—毛细管5—试液6—电解容器7—甘汞电极2.极谱波的形成(1)极谱波极谱波是指当外加电压变化,使被测溶液中某物质能在滴汞电极上发生还原或氧化时,记录下的电流-电压关系的曲线。
图14-2镉离子极谱图(2)极谱波的形成①残余电流部分(AB);②电流上升部分(BC);③极限电流部分(CD)。
(3)定量分析的基础——极限扩散电流极限扩散电流是指在排除了其他电流的影响后,极限电流减去残余电流后的值;i d与被测物的浓度成正比。
(4)定性分析的依据——半波电位半波电位是指当电流等于极限扩散电流的一半时相应的滴汞电极电位,符号为E1/2。
3.极谱过程的特殊性(1)电极的特殊性①极谱法的基础必须使滴汞电极在电解过程中完全极化,电流密度要小。
②滴汞电极的优点a.电极表面吸附杂质少,数据重现性好;b.在酸性溶液中可进行极谱分析;c.金属与汞形成汞齐使金属离子更易电解析出;d.汞易提纯。
③滴汞电极的缺点a.汞易挥发且有毒;b.不能用于比甘汞电极正的电位;c.残余电流较大,限制了其测定的灵敏度。
(2)电解条件的特殊性①溶液保持静止,对流切向运动可以忽略不计;②使用大量的支持电解质,电子迁移运动可以被消除。
二、极谱定量分析1.扩散电流方程式(1)Ilkovic方程式中,i d为平均极限扩散电流(μA),z为电子转移数,D为扩散系数(cm2·s-1),m为汞滴流量(mg·s-1),t为测量时,汞滴周期时间(s),c为待测物浓度(mmol·L-1)。
(2)极谱定量分析方法的类型①标准曲线法②标准加入法③直接比较法在相同实验条件下,分别测定已知浓度为c s的标准溶液与未知试液的扩散电流。
2.影响扩散电流的主要因素(1)溶液组分的影响组分不同,溶液黏度不同,因而扩散系数D不同。

第十四章荧光分析法一、单项选择题(类型说明:每一道试题下面有A、B、C、D四个备选答案,请从中选择一个最佳答案。
)1、下列哪种化学反应可以产生化学发光?()A.中和反应 B.离子交换反应 C氧化反应 D置换反应2、分子荧光与化学发光均为第一激发态的最低振动能级跃迁至基态中各振动能量能级产生的光辐射,它们的主要区别在于()A.分子中的电子层不同B.跃迁至基态中的振动能级不同C.产生光辐射的能源不同D.无辐射驰豫的能源不同3、受激单线态的平均寿命应为()秒。
A.10-8 B.10-7 C.10-6 D.1受激三线态的平均寿命应为()秒。
A.10-8 B.10-7 C.10-6 D.10-55、下列那种离子不能产生荧光?()A. B.2+ C.3+ D.V()6、根据下列化合物的结构,判断那种物质的荧光效率最大?()A.苯B.联苯C.对联三苯D.蒽7、下列结构中那一种能产生荧光的强度最大? ( )A.苯酚B.苯C.硝基苯D.苯甲酸8、苯胺在下列哪个值能产生荧光(苯胺以分子形式产生荧光) ( )A.1B.2C.7D.139、下列那种说法是正确的 ( )A.荧光物质的浓度增加,荧光强度增大。
B. 荧光物质的浓度增加,荧光强度减弱。
C. 荧光物质的浓度减弱,荧光强度减弱。
D. 荧光物质的浓度减弱,荧光强度减弱。
10、下列说法那种是正确的 ( )A.溶液温度升高,荧光效率增加,荧光强度增大。
B.溶液温度降低,荧光效率增加,荧光强度增大。
C.溶液温度升高,荧光效率降低,荧光强度增大。
D.溶液温度降低,荧光效率降低,荧光强度增大。
11、下列那种基团能使单线态转让三线态 ( )A. 2NH -B. OH -C. 65C H -D. I -12、下列那种溶剂对荧光的光谱干扰最小 ( )A.水B.乙醇C.环已烷D.四氯化碳13、荧光光度计和分光光度计的主要区别是 ( )A.光源B.光路C.单色器D.检测器瑞利散射是在那种情况下产生的 ( )A.自发辐射B.受激辐射C.辐射能照射分子产生热运动D. 光子和物质分子发生弹性碰撞,只是光子运动方向发生了改变15、拉曼散射是在那种情况下产生的 ( )A.自发辐射B.受激辐射C.辐射能照射分子产生热运动D.辐射能照射分子产生非弹性碰撞,并发出光辐射。

第十四章 光谱法紫外-可见分光光度法一.选择题1.CuSO 4溶液呈蓝色,是由于CuSO 4溶液选择性地吸收了白光中的( ) 。
A .紫色光B .绿色光C .黄色光D .蓝色光2.用吸光光度法测得某溶液的透光率为T 0,若将该溶液稀释一倍,则此时溶液的透光率为( ) 。
A .20T B .0T C .02T D .20T3.分光光度法的吸光度与下列哪个因素无关( ) 。
A .溶液的浓度B .入射光的波长C .液层厚度D .液层的高度4.吸光度A 为0时,透光率T 为( ) 。
A .0B .10C .100%D .20%5.某溶液在某波长处测得A 为0.22,若浓度增加一倍,比色皿厚度减为原来的一半,则吸光度变为( )。
A .0.44B .0.22C .0.66D .0.116.现测定A 、B 两个不同浓度的某溶液,若A 比色皿的厚度为1cm,B 比色皿的厚度为2cm,测得两溶液的吸光度相同,则AB 浓度关系为( ) 。
A .B A c c = B .B A c c 2=C .B A c c =2D .B A c c 31= 7.分光光度法中,吸光系数与( )有关。
A.光的强度B.溶液的浓度C.入射光的波长D.液层的厚度 8.摩尔吸光系数很大,则说明( )。
A.该物质的浓度很大B.光通过该物质溶液的光程长C.该物质对某波长光的吸收能力强D.测定该物质的方法的灵敏度低 9.符合比耳定律的有色溶液稀释时,其最大的吸收峰的波长位置( )。
A.向长波方向移动B.向短波方向移动C.不移动,但峰高降低D.无任何变化 10.分光光度计测定中,工作曲线弯曲的原因可能是( )。
A 、溶液浓度太大 B.溶液浓度太稀C.参比溶液有问题D.仪器有故障11.在分光光度法中运用光吸收定律进行定量分析,应采用()作为入射光。
A.白光B.单色光C.可见光D.锐线光12.可见分光光度法中,使用的光源是()。
A 钨丝灯B 氢灯C氘灯D汞灯三、判断题1.溶液的浓度越大,则该溶液的吸光系数越小;比色皿厚度越小,则吸光系数越大。

无机及分析化学习题及答案精选xxx科技大学第十四章分析化学基础1.对某组分的含量进行测定时,若被分析样品的质量大于100mg,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析2.对某溶液中的铝进行测定时,若取分析试液25ml进行分析测定,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析3.由精密度好就可断定分析结果可靠的前提是( )A. 偶然误差小B. 系统误差小C. 标准偏差小D. 相对偏差小4.下列各种分析纯的化学试剂,其中不能用直接配制法配制标准溶液的是A. KHCO3B. KMnO4C. K2CrO7D. KCl5.下列各种措施中,可以减小偶然误差的是( )A. 进行空白试验B. 进行对照试验C. 进行仪器校准D. 增加平行测定次数6.下述情况引起的误差中,不属于系统误差的是( )A. 移液管转移溶液之后残留时稍有不同B. 称量时使用的砝码锈蚀C. 滴定管刻度未经校正D. 天平的两臂不等长7.下列叙述中错误的是()A.系统误差呈正态分布 B. 系统误差又称可测误差C. 方法误差属于系统误差D. 系统误差具有单向性8. 分析测定中出现下列情况,何者属于系统误差( )A. 滴定时有溶液溅出B. 试样未经充分混匀C. 滴定管未经校正D. 读错法码9. 下列计算式的计算结果(X)应有几位有效数字?( )X= [0.3120⨯48.12⨯(21.65-16.10)]÷(1.2845⨯1000)A. 二位B. 三位C. 四位D. 五位第 1 页10. 欲测某组分含量,由四人分别进行测定,试样称取量皆为2.2g,问下列结果中哪一个是合理的?( )A. 2.085%B. 2.08%C. 2.09%D. 2.1%11. 称取一定质量的邻苯二甲酸氢钾基准物质以标定NaOH溶液的浓度,下列何者将引起正误差( )A. 称取基准物重量时用的一只10mg法码,事后发现其较正后的值为9 .7mgB.滴定时滴定终点在等量点后到达。
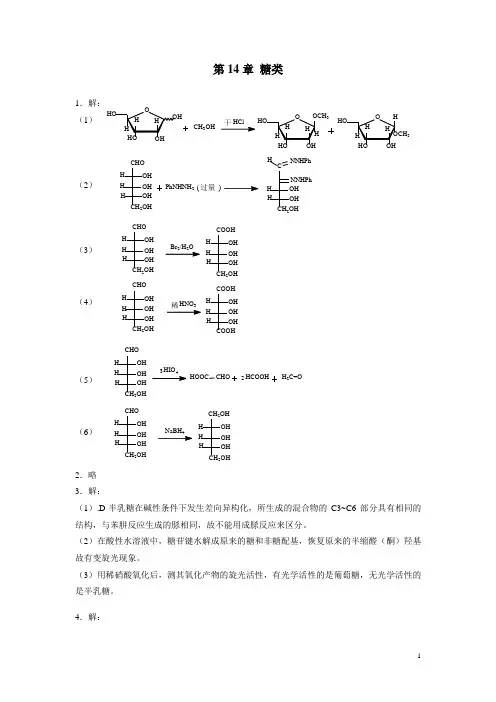

第十四章 碳水化合物14.8 下列化合物哪个有变旋现象?a.OCH 2OCH 3b.OCH 3CH 3OCH 2OCH 3OOH CH 2OHO CH 3Oc.d.OCH 2OH OCH 2OHOe.OHOH 2C CH 3OCH 3O 3OCH 3O CH 2OH OCH 2OH Of.答案: a .b. f.有变旋现象。
因为属半缩醛,可通过开链式α–β互变。
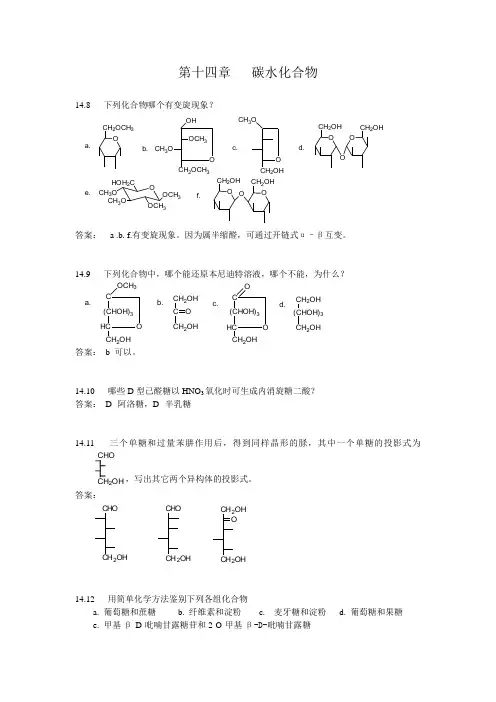
14.9 下列化合物中,哪个能还原本尼迪特溶液,哪个不能,为什么?a.b.C (CHOH)3HC CH 2OHOOCH 3CH 2OH C CH 2OHO c.d.C (CHOH)3HC CH 2OHO OCH 2OH (CHOH)3CH 2OH答案: b 可以。
14.10 哪些D 型己醛糖以HNO 3氧化时可生成内消旋糖二酸? 答案: D--阿洛糖,D--半乳糖14.11三个单糖和过量苯肼作用后,得到同样晶形的脎,其中一个单糖的投影式为2OH ,写出其它两个异构体的投影式。
答案:CHOCH 2OH CHOCH 2OHCH 2OH CH 2OH O14.12 用简单化学方法鉴别下列各组化合物a. 葡萄糖和蔗糖b. 纤维素和淀粉c. 麦牙糖和淀粉d. 葡萄糖和果糖e. 甲基-β-D-吡喃甘露糖苷和2-O-甲基-β-D-吡喃甘露糖答案:a. Bendict 试剂; e. Tollen 试剂b. I 2c. I 2d.Br 2_H 2O14.13 写出下列反应的主要产物或反应物:CHOCH 2OH CH 2OHa.H 2OO OHAg(NH 3)2+b.c.Br 2--H 2O d.(β--麦芽糖)e.Ag(NH 3)2+(α-纤维二糖)f.(某个D 型丁糖)内消旋酒石酸答案:CHOCH 2OH CH 2OHa.2CH 2OH OCH 2OHCHOCH 2OHO OHAg(NH 3)2+b.COOHCH 2OHc.3Br 2--H 2OCH 2OHOCOOHd.(β--麦芽糖)e.2CH2OHOCOOHAg(NH3)2+(α-纤维二糖)f.CHOCH2OHHNOCOOHCOOH14.14 写出D-甘露糖与下列试剂作用的主要产物:a. Br2-H2Ob. HNO3c. C2H5OH+无水HCld. 由c得到的产物与硫酸二甲酯及氢氧化钠作用 e. (CH3CO)2O f. NaBH4g . HCN,再酸性水解h. 催化氢化i. 由c得到的产物与稀盐酸作用j. HIO4答案:CH2CH2OCH2CH32CH3CH2OHCOOH+CH2OHCOOHOH+ C2H5OH14.17 D-苏阿糖和D-赤藓糖是否能用HNO3氧化的方法来区别?答案:D--苏阿糖和D--赤藓糖可以用HNO3氧化的方法来区别.因为氧化产物前者有旋光,后者比旋光度为零.14.18 将葡萄糖还原得到单一的葡萄糖醇A,而将果糖还原,除得到A外,还得到另一糖醇B,为什么?A与B是什么关系?答案:因为果糖的还原所形成一个手性碳,A与B的关系为差向异构体.14.19 纤维素以下列试剂处理时,将发生什么反应?如果可能的话,写出产物的结构式或部分结构式。

第十四章核磁共振波谱法 - 经典习题1.试对照结构指出图14-1上各个峰的归属。
解:δ1.2 三重峰 3H-CH2-CH3δ2.0 单峰 3H-CO-CH3δ4.0 四重峰 2H-O-CH2-CH3δ6.8~7.6 4H-C6H4-δ9.8 单峰 1H-NH-图14-1 例题1的1H-NMR谱2.由下述1H-NMR图谱,进行波谱解析,给出未知物的分子结构及自旋系统。
(1)已知化合物的分子式为C4H10O,1H-NMR谱如图14-2所示。
图14-2 C4H10O的 1H-NMR谱解:u=(2+2×4-10)/2=0δ1.13 三重峰 6H -CH2-CH3(2个)δ3.38 四重峰 4H -O-CH2-CH3(2个)可能结构式为:CH3-CH2-O-CH2-CH3自旋系统:2个A2X3(2)已知化合物的分子式为C9H12,1H-NMR谱如图14-3所示。
图14-3 C9H12的1H-NMR谱解:u=(2+2×9-12)/2=4δ1.22 二重峰 3H -CH-CH3δ2.83 七重峰 1H -CH-(CH3)2δ7.09 单峰 5H C6H5-可能结构式为:自旋系统:A6X,A5(3)已知化合物的分子式为C10H10Br2O,1H-NMR谱如图14-4所示。
图14-4 C10H10Br2O的1H-NMR谱解:u=(2+2×10-12)/2=5δa 2.42 单峰 3H -CO-CH3δb 4.88 双峰 1Hδc 5.33 双峰 1Hδd 7.35 单峰 5H C6H5- 可能结构式为:自旋系统:A5、AB、A33.某化合物分子式为C8H12O4,NMR图谱如图14-6所示,δa=1.31(三重峰,)δb=4.19(四重峰),δc=6.71(单峰),Jab=7Hz,峰面积积分值比a:b:c=3:2:1,试推断其结构式。
图14-6 C8H12O4的氢核磁共振谱解:(1)计算不饱和度u=(2+2×8-1)/2=3(2)由积分值比计算氢分布:a:b:c=3:2:1分子式有12个H,可知分子具有对称结构为a:b:c=6H:4H:2H(3)偶合系统(ab)为一级偶合A2X3系统(二个质子的四重峰与三个质子的二重峰)(4)根据δa=1.31,δb=4.19及偶合系统可以推测有-CH2CH3存在,并均向低场移动,故为-OCH2CH3型结构。

第十四章氧化还原反应习题答案36 ½ Fe 2O 3 ~ Fe ~ FeSO 4·7H 2OMnO 4-+5Fe 2++8H +=Mn 2++5Fe 3++4H 2O 44443105KMnO Fe KMnO KMnO Fe /KMnO V MV c T -⨯⋅⋅==5×0.02484×55.85×10-3=6.937×10-3(g/ml ) 同理,4324432421053KMnOO Fe KMnO KMnO O Fe /KMnO V MV c T -⨯⋅⋅= ==5×0.02484×331091791027159--⨯=⨯..(g/ml )7 滴定反应式为Cr 2O 72- + 6 Fe 2+ + 14H + ==2Cr 3+ + 6Fe 3+ + 7H 2O计量点时;反应能定量进行,则,故8 解法I :Cr 2O 72-+6I -+14H +=2Cr 3++3I 2+7H 2OI 2+2S 2O 32-=2I -+S 4O 62-n (KI)=6n (Cr 2O 72-)n (Cr 2O 72-)=61n (S 2O 32-) S m M n n w )KI (])O S Na (61)O Cr (K [6(KI)322722-⨯= %7.94g 518.0mol g 166]L 01000.0Lmol 1000.061mol g 2.294g194.0[6111=⋅⨯⨯⋅⨯-⋅⨯=---解法II :根据整个测定过程中氧化剂得到的电子的物质的量与还原剂失去的电子的物质的量相等的关系进行计算:测定过程中Cr 2O 72-+6I -+14H +=2Cr 3++3I 2+7H 2O 反应中K 2Cr 2O 7作为氧化剂得到电子,KI 作为还原剂失去电子;加热除去I 2时,没发生电子转移;在再加过量KI (和 过量K 2Cr 2O 7作用 ),析出的I 2用Na 2S 2O 3滴定过程中I -经反应后又恢复为I -,故未参与电子转移,而这步反应(I 2+2S 2O 32-=2I -+S 4O 62 )中Na 2S 2O 3作为还原剂失去电子;故根据测定过程中氧化剂得到的电子的物质的量与还原剂失去的电子的物质的量相等的关系,可得:n (K 2Cr 2O 7得e -)=n (KI 失e -)+n (Na 2S 2O 3失e -)6n (K 2Cr 2O 7)=n (KI)+n (Na 2S 2O 3)S S m M V c M m w V c M w m M m KI)()]O S Na ()O S Na ()O Cr K ()O Cr K (6[)KI ()O S Na ()O S Na (KI)()KI ()O Cr K ()O Cr K (6322322722722322322722722-⨯=+⋅=9101112 MnO 4-+5Fe 2++8H +=Mn 2++5Fe 3++4H 2On (Fe 2O 3)=21n (Fe)=25n (KMnO 4)%81.7000.1%)19.3000.1(1100.0)O Al (%19.3g000.1mol g 7.159L 08000.L mol 01000.025)O Fe (321132=⨯-==⋅⨯⨯⋅⨯=--g g g w w 13Ca 2++C 2O 42-=CaC 2O 4CaC 2O 4+2H += H 2C 2O 4+ Ca 2+2MnO 4-+5 H 2C 2O 4+6H +=2Mn 2++10CO 2+8H 2O n (Ca)=n (H 2C 2O 4)=25n (KMnO 4)%010.7g 000.1mol g 08.56L 02000.0L mol 02500.025(CaO))KMnO ()KMnO (25)CaO (1144=⋅⨯⨯⋅⨯==--Sm M V c w 14解:Cr 2O 72-+6Fe 2++14H +=2Cr 3++6 Fe 3++7H 2OMnO 4-+5Fe 2++8H +=Mn 2++5 Fe 3++4H 2OCr 2O 72- ~ 2Cr 3+ =31056124444-⨯-⨯--)V c V c (MnO MnO FeSO FeSO=1/3[0.1000×25.00-5×0.01800×7.00)]×10-3=6.233×10-4m M n w Cr Cr Cr ⋅==0324.0000.100.5210233.64=⨯⨯-15。
第十四章 羰基α-取代反应和缩合反应习题14-11 (P614页,应该为14-1)3(1)(CH 3)2C C CH 3OH(CH 3)2CH C CH 2N(位阻关系)(3)(4)习题14-1 (P617页,应该为14-2)因为CH 3CH ROH 可以被氧化成CH 3C O 。
习题14-2 (P617页,应该为14-3)(2) 2-戊酮,(4) 苯乙酮,(6) 2-丁醇在卤仿试验中呈阳性。
习题14-3 (P617页,应该为14-4)碱性条件下,不同结构的酮发生卤代反应活性顺序为:C CH 3C CH 2C O CH >>原因在于碱性条件下酮的反应活性决定于α-H 的酸性强弱,由于烷基的给电子作用,羰基α-C 上没有烷基取代的α-H 酸性较强。
习题14-4 (P618页,应该为14-5)酸性条件下,下列结构的醛酮发生卤代反应的活性顺序为:C OCH 3C OCH 2C O CH <<这是因为酸性条件下醛酮的α-卤代反应是通过烯醇进行的,α-C 上烷基取代越多,生成的烯醇越稳定,即越容易生成。
习题14-5 (P618页,应该为14-6)CH 3CH 2CH 2CH 3O(1)+(± mol)C CH 3CH 2CH CH 3OCl H 2O,HOAcCl 2(2)33(3)习题14-6(P618页,应该为14-7)I IOOO CI 3OH I 23O OO O +HCI 3习题14-7 (P619页,应该为14-8)羧酸转化为α-卤代羧酸使用催化量的PBr 3。
而转化为酰卤则需要使用等摩尔量的PBr 3。
习题14-8 (P619页,应该为14-9)使用羧酸先进行α-卤代和或酰卤反应得到α-卤代酰卤,再进行酯化反应。
习题14-9(P620页,应该为14-10)CH 3CH 2CHOCH 3BrCH 3CH BrCHOOBr 2HOAc,H 2O无水HCl HOCH 2CH 2OH (1)CH 3CH N(CH 3)2CHOOCH 3CH N(CH 3)2CHO32H 3OBr 2HOAc无水HCl22(2)3)2(1) (CH 3)2CHNa 2+Br 2HOAc-2+(3)OO(4)O OBrOO无水HCl22△3习题14-10 (P621页,应该为14-11)CH 3CH 2CH 2CCH3OCH 3CH 2CH 2C CH 2OLiLDA THF,-78℃T.M(1)方法二:CH 3CH 2CH 2CCH 2CH 2CH 3OCH 3CH 2CHCCH 2CH 2CH 3Br O 2HOAc(1) HOCH 2CH 2OH,H +(2) OH,△(3) H 3OT.MCH 3CH 3C OCH CH 2+HCHO OH (2)CH 3O方法二:CH 3C OCH 2CH 3CH 3C O 3Br 23Br T.M习题14-12(P621页)2CH 2CHOO (3) H 3ORCOOOH2CH 2COOC 2H 5习题14-13(P622页)CH 3CH 23LDA/THF(1)CH 3CH 2CCH 3O(1) LDA/THF(2) ICH 3CH 3CH 2CCH 2CH 3O(2)(1) LDA/THF (2) BrCH 2CH 3(3)OC 2H 5OCH 32CH 3OBr (4)习题14-14 (P624页) 位阻的原因:N H 3CH H NHH 3CH H习题14-15(P624页)(CH 3)2CHCHO (CH 3)2NHK 2CO 3(1)+(CH 3)2C CH N(CH 3)2CH 2Br2+C (H 3C)2CH 2CH N(CH 3)2C (H 3C)2CH 2CHO+(CH 3)2NHO+N(2)H2OCH 32H OCH 2OCH 3O(3)NO+2H 5CH 2CH 3H 2OH O2H 5CH 2CH3(4)ON+H2CH 2COOC 2H 5H 2O-EtOHH OCH 2CH 2COOC 2H 5习题14-14 (P625页,应该是14-16)羧酸在醇钠作用下将转化为羧酸根负离子,从而使得羰基碳难以接受亲核试剂的进攻。
第8章沉淀滴定法思考题1. 什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?答:沉淀滴定法是以沉淀反应为基础的一种滴定分析法。
用于滴定分析的沉淀反应必须具备下列几个条件:(1)生成的沉淀具有恒定的组成,而且溶解度很小。
(2)沉淀反应必须迅速、定量地进行。
(3)有合适的方法确定终点。
2.分别写出摩尔法、佛尔哈德法和法扬司法测定Cl-的主要反应,并指出各种方法选用的指示剂和滴定条件。
答:3.用银量法测定下列试样中Cl含量时,选用哪种指示剂指示终点较为合适?(l)BaCl2;(2)NaCl + Na3PO4;(3)FeCl2;(4)NaCl + Na2SO4。
答:(l)荧光黄;(2)铁铵矾;(3)荧光黄;(4)铁铵矾。
4. 说明用下述方法进行测定是否会引入误差,如有误差,指出偏高还是偏低?(1)pH≈4时用摩尔法测定Cl;(2)用法扬斯法测定Cl时,用曙红作指示剂;(3)用佛尔哈德法测定Cl,但没有加硝基苯;(4)中性溶液中用摩尔法测定Br-;(5)用摩尔法测定pH≈8的KI溶液中的I-;(6)用摩尔法测定Cl,但配制的K2CrO4指示剂溶液浓度过稀。
答:(1)测定结果偏高。
摩尔法应当在中性或弱碱性介质中进行。
若在酸性介质pH≈4的溶液中,CrO42-与H+结合生成HcrO4-,溶液中CrO42-减少,Ag2CrO4沉淀出现过迟,滴定剂消耗过量,则结果偏高。
(2)测定结果偏低。
用法扬斯法测定Cl时,常用荧光黄作指示剂,只能在中性、弱碱性(pH=7~10)溶液中使用,若选用曙红作指示剂,由于Cl吸附性能较Br-、I-差,理论终点前就有一部分指示剂阴离子取代Cl而进入吸附层中,因而终点提前,测定结果偏低。
(3)测定结果偏低。
佛尔哈德法当达终点时,由于发生AgCl+SCN-=AgSCN↓+Cl沉淀转化反应,得不到正确终点。
为阻止生成的AgCl沉淀与外部溶液SCN-接触,应加入有机溶剂硝基苯等。
因此未加硝基苯即发生沉淀转化,引入很大正误差,对返滴定来说致使结果偏低。
复习提纲:第十四章气相色谱法色谱法的基本原理1. 色谱法的起源(了解)、基本原理(掌握)、仪器基本框图(掌握)、分类、特点及应用(了解)2. 色谱流出曲线及相关术语:基线:可用于判断仪器稳定性及计算检出限(掌握)峰面积(峰高):定量基础(掌握)保留值:定性基础(掌握);死时间、保留时间、调整保留时间;死体积、保留体积、调整保留体积;相对保留值(选择性因子)等(掌握)峰宽的各种表示及换算(掌握)3. 色谱基本原理:热力学(掌握):分配系数K,仅与两相和温度有关,温度增加K减小分配比k,k除与两相和温度有关外(温度增加k减小)还与相比有关(相比的概念)k=t r/t0;k=K/;=K2/K1=k2/k1分离对热力学的基本要求:两组份的>1或K、k不相等;越大或K、k相差越大越容易实现分离动力学:塔板理论:理论(或有效)塔板数(柱效)及理论(有效板高)的计算公式及有关说明(掌握);塔板理论的贡献及不足(了解)速率理论:H=A+B/u+Cu中H、A、B、C、u的含义(掌握);减小A、B、C的手段(掌握);u对H的影响及最佳流速和最低板高的计算公式(掌握);填充物粒径对板高的影响(掌握)4. 分离度分离度的计算公式;R=时,完全分离;R=1时基本分离(掌握)5. 基本色谱分离方程两种表达形式要熟练掌握;改善分离度的手段:增加柱效n(适当增加柱长的前提下减小板高)、增加选择性因子(GC:改变固定相和柱温)和控制适当的容量因子k(GC:改变温度及固定相用量)(掌握)分离度与柱效、柱长、分析时间(即保留时间)之间的关系(掌握);柱温对分离度的影响(了解);相关例题(熟练掌握)6. 定性分析常规检测器用保留时间(相对保留值也可以)定性,但该法存在的不足要知道,双柱或多柱可提高保留时间定性的可靠性;质谱或红外等检测器有很强的定性能力(了解)7. 定量分析相对校正因子和绝对校正因子的概念(掌握);归一化法各组分含量的计算公式(掌握);内标法定量的计算公式(掌握相关作业)归一化法和内标法不受进样量和仪器条件变化的影响,外标法受进样量和仪器条件变化的影响较大(了解)气相色谱法1. 气相色谱法流程和适用对象;气固和气液色谱的适用对象(掌握)2. 气相色谱法的仪器:气路系统:通常采用N2、H2、Ar、He等惰性气体做载气(高压钢瓶提供),载气纯度、流速的大小及稳定性对色谱柱柱效、仪器灵敏度及整机稳定影响很大,因此载气纯度要高、流速要适当而且稳定。
第十四章红外分光光度法第一节概述(一)红外线的区划红外线:波长大于0.76μm,小于500μm(或1000μm)的电磁波称为~习惯上将红外线分为三个区域:近红外区(0.76μm~2.5μm),OH、NH、CH键的倍频吸收区中红外区(2.5μm~50μm),振动,伴随着转动(基本振动区)远红外区(50μm~5000(或1000μm)),转动三种波长范围的红外线,引起三种类型的能级跃迁红外光谱:由分子的振动、转动能级引起的光谱,称为中红外吸收光谱,简称红外吸收光谱或红外光谱远红外光谱及微波谱:由分子的纯转动能级跃迁所引起的光谱称为~红外吸收光谱法:利用样品的红外吸收光谱进行定性、定量分析及测定分子结构的方法,或称红外分光光度法,简称红外光谱法(二)红外吸收光谱的表示方法T-λ曲线,T-σ曲线T-λ曲线“前密后疏”T-σ曲线“前疏后密”这是因为前者是波长等距,后者是波数等距目前的红外光谱采用波数为横坐标波数为波长的倒数,在红外光谱中波长的单位用微米(μm),波数的单位用cm-1,1μm=10-4cmσ(cm-1)=104/λ(μm)波数:表示每1cm距离内包含多少个波长(三)红外吸收光谱与紫外吸收光谱的区别1 起源不同紫外光谱与红外光谱都属于分子吸收光谱,但起源不同1 电子能级跃迁紫外线波长短、频率高、光子能量大,能引起分子外层电子的能级跃迁,虽伴有振动及转动能级跃迁,因能级差较小,常被淹没,除某些化合物(苯)蒸汽的紫外光谱,会显现振动能级跃迁外,一般不显现因此紫外吸收光谱属电子光谱2 振动-转动能级跃迁红外线的波长比紫外线长,光子能量比紫外线小得多,只能引起分子的振动能级并伴随转动能级的跃迁因而中红外光谱是振动-转动光谱2 适用范围不同1 紫外吸收光谱法:只是用于研究芳香族或具有共轭结构的不饱和芳香族化合物及某些无机物,不适用于饱和有机化合物红外吸收光谱法:不受此限,在中红外区,能测得所有有机化合物的特征红外光谱,红外光谱还可以用于研究某些无机物2 紫外分光光度法:测定对象的物态为溶液及少数物质的蒸汽红外分光光度法:测定气、液及固体样品,并以固体样品最为方便3紫外分光光度法:用于定量分析及测定某些化合物的类别红外分光光度法:用于定性鉴别及测定有机化合物的分子结构3 特征性不同红外光谱的特征性比紫外光谱强紫外光谱主要是分子的π电子或n电子跃迁所产生的吸收光谱,因此多数紫外光谱比较简单,特征性较差红外吸收光谱是振动-转动光谱,每个官能团都有几种振动形式,在中红外区相应产生几个吸收峰,光谱复杂,特征性强,除了个别化合物外,每个化合物都有其特征红外光谱,因而红外光谱是定性鉴别的有力手段(四)用途红外分光光度法的用于可概括为:定性鉴别、定量分析、结构分析等可提供化合物具有什么官能团、化合物类别(脂肪族、芳香族)、结构异构、氢键、某些链状化合物的链长等信息,是分子结构研究的主要手段之一第二节基本原理一条红外吸收曲线,可由吸收峰的位置(λmax或σmax)及吸收强度(ξ)来描述一、振动能级与振动光谱由于分子的振动能级差大于转动能级差,因此在分子发生振动能级跃迁时,不可避免地伴随着转动能级的跃迁,因而无法测得纯振动光谱由于振动能级是量子化的,则所吸收的光子的能量hνL必须恰等于振动能级的能量差,即hνL=△EvνL=ν·△V σL=σ·△V若把双原子分子视为谐振子,吸收红外线而发生能级跃迁时所吸收的红外线频率(νL),只能是谐振子振动频率(ν)的△V倍二、振动形式双原子分子只有一类振动形式:伸缩振动多原子分子有两类振动形式:伸缩振动、弯曲振动振动形式可以了解吸收峰的起源振动形式的数目,有助于了解基频峰的可能数目(一)伸缩振动伸缩振动:键长沿键轴方向发生周期性的变化称为~多原子分子(或基团)的每个化学键可以近似地看做一个谐振子伸缩振动的振动形式可分为两种:1 对称伸缩振动2 不对称伸缩振动或称反称伸缩振动除CH2及CH3以外,凡含有两个或两个以上相同键的基团也都有对称及反称两种伸缩振动形式化合物中含有两个相邻相同的官能团,也有对称伸缩振动和反称伸缩振动两种形式(二)弯曲振动弯曲振动:使键角发生周期性变化的振动称为~(或称为变形振动)弯曲振动分为:面内、面外、对称弯曲振动、不对称弯曲振动1 面内弯曲振动:在由几个原子所构成的平面内进行的弯曲振动,称为~按振动形式,面内弯曲振动可以分为:剪式振动、面内摇摆振动两种组成为AX2的基团或分子易发生此类振动(1)剪式振动:在振动过程中键角的变化类似剪刀“开”“闭”的振动(2)面内摇摆振动:基团作为一个整体,在平面内摇摆2 面外弯曲振动:在垂直于由几个原子所组成的平面外进行的而弯曲振动称为~(1)面外摇摆振动:两个X同时向面上或向面下的振动(2)蜷曲振动:一个X向面上,另一个X向面下的振动3 变形振动AX3基团或分子的弯曲振动分为两种:(1)对称变形振动在振动过程中,三个AX键与轴线组成的夹角α对称的缩小或增大(2)不对称变形振动在振动过程中,二个α角缩小,一个α角增大,或相反的振动(三)振动自由度双原子分子只有一种振动形式——伸缩振动基本振动的数目称为振动自由度,即分子的独立振动数在中红外区,光子的能量较小,不足以引起分子的电子能级跃迁只需考虑分子中三种运动形式的能量变化:平动、振动、转动的能量变化分子的平动能改变,不产生光谱转动能级跃迁产生远红外光谱,不在中红外光谱的讨论范围,因此应扣除这两种运动形式N个原子有3N个独立运动方向,分子有三个平动自由度在非线性分子中,分子由三个转动自由度,剩下3N-6个振动自由度在线性分子中,分子有两个转动自由度,剩下3N-5个振动自由度由振动自由度数可以估计基频峰的可能数目三、基频峰与泛频峰在红外光谱上,从吸收峰的峰位(即所吸收红外线的频率)与基团的振动频率(或称基本振动频率)之间的关系,可以分为基频峰和泛频峰(一)基频峰基频峰是红外光谱上最重要的一类吸收峰1 简并某些振动虽然振动形式不同,但是振动频率相等2 红外非活性振动红外非活性振动:不能吸收红外线发生能级跃迁的振动称为~,反之称为红外活性振动红外非活性振动的原因:振动过程中分子的偶极矩不变只有偶极矩有变化的振动过程,才能吸收红外线而发生能级跃迁这是因为红外线是具有交变电场和磁场的电磁波,不能与非电磁分子或基团发生振动耦合(共振)的缘故红外线不能将振动过程中无偶极矩变化的分子或基团激发3 仪器的分辨率不高,一些弱峰仪器检测不出来等原因某基团和或分子的基本振动吸收红外线而发生能级跃迁,必须满足两个条件:1振动过程△μ≠02 必须服从νL=ν·△V的关系(二)泛频峰倍频峰:在红外吸收光谱上,除基频峰外,还有振动能级由基态(V=0)跃迁至第二振动激发态(V=2)、第三激发态(V=3)....等现象,所产生的吸收峰称为~二倍频峰、三倍频峰等统称为倍频峰三倍频峰及三倍以上,因跃迁几率很小,一般都很弱,常观测不到由于分子的非谐振性质,位能曲线中的能稽查并非等距,V越大,间距越小倍频峰的频率并非是基频峰的整数倍,而是略小一些倍频峰、合频峰、差频峰统称为泛频峰取代苯的泛频峰出现在2000~1667cm-1(5~6μm)的区间,主要由苯环上碳-氢面外弯曲的倍频峰等构成,特征性很强,可用于鉴别苯环上的取代位置四、特征峰与相关峰(一)特征峰(特征频率)官能团的存在与吸收峰的存在相对应,因此可用一些易辨认、有代表性的吸收峰来确认官能团的存在凡是可用于鉴别官能团存在的吸收峰,称为特征吸收峰,简称特征峰或特征频率(二)相关峰多数情况一个官能团有数种振动形式,而每一种红外活性振动,一般相应产生一个吸收峰,有时还能观测到泛频峰,因而常常不能由单一特征峰肯定官能团的存在相关峰:由一个官能团,所产生的一组相互依存的特征峰,可称为相关吸收峰,简称~相关峰的数目与基团的活性振动数及光谱的波数范围有关用一组相关吸收峰确定一个官能团的存在,是光谱解析的一条重要原则五、吸收峰的位置吸收峰的位置或称峰位通常用σmax(或νmax、λmax)表示,即前述振动能级跃迁时所吸收的红外线的波数σL(或频率νL、波长λL)对基频峰而言,σmax=σ,基频峰的峰位即基团或分子的基本振动频率其他峰,σmax=σ△V每种基频峰都在一段区间内出现,这是因为虽是同一种基团、同一种振动形式的跃迁,但在不同的化学环境中所受的影响不同,而使吸收峰的位置有所改变基频峰的位置主要由四方面因素所决定:化学键两端原子的质量、化学键力常数、内部影响因素、外部影响因素(一)基本振动频率1 基本振动频率的计算公式:K为化学键力常数,是将化学键两端的原子由平衡位置拉长0.1nm后的恢复力称为~化学键力常数越大,表明化学键的强度越大K越大,折合质量越小,谐振子的振动频率越大双原子基团的基本振动频率与化学键力常数及折合质量有关,即基频峰的峰位与K和u有关同类原子组成的化学键,力常数越大,则基本振动频率越大比较不同原子组成的化学键,则需看力常数与折合质量哪一个是主要矛盾由于氢原子的原子量最小,故所有含氢原子单键的基频峰,都出现在中红外光谱上的高频区2 基频峰的分布图1)折合质量越小,伸缩频率越高2)折合质量相同的基团,伸缩力常数越大,伸缩振动基频峰的频率越高3)折合质量相同时,ν>β>γ,因为它们的力常数依次减小(二)影响因素1 内部因素主要是结构因素,如相邻基团的影响及空间效应1)诱导效应吸电子的诱导效应,常使吸收峰向高频方向移动2)共轭效应共轭效应的存在使吸收峰向低频方向移动3)氢键氢键的形成使伸缩振动频率降低分子内氢键缔合作用的一种形式,由于分子内氢键的形成,往往对谱带位置有极明显的影响,但它不受浓度的影响,有助于结构分析分子间氢键受浓度的影响较大,随浓度的稀释吸收峰位置改变可观测稀释过程峰位是否变化,来判断是分子间氢键还是分子内氢键4)杂化影响在碳原子的杂化轨道中s成分增加,键能增加,键长变短,C-H伸缩振动频率增加碳-氢伸缩振动频率是判断饱和氢与不饱和氢的重要依据,不饱和碳氢的伸缩振动频率大于3000cm-12 外部因素主要是溶剂、仪器色散元件、温度的影响溶剂影响:极性基团的伸缩频率,常随溶剂的极性增大而降低通常是因为极性基团与溶剂间生成氢键的缘故,形成氢键的能力越强,降低越多(三)特征区和指纹区1 特征区特征区:习惯上把4000~1250cm-1(2.5~8.0μm)区间称为特征频率区,简称~特征区的吸收峰较疏,易辨认主要包括:1 含有氢原子的单键2 各种三键及双键的伸缩振动的基频峰3 含氢单键的面内弯曲振动的基频峰羰基峰时红外吸收光谱上最受重视的吸收峰之一2 指纹区指纹区:1250~200cm-1(8.0~50μm)的低频区称为~指纹区的红外线的能量比特征频率区低所出现的谱带起源于:各种单键的伸缩振动、多数基团的弯曲振动两个结构相近的化合物的特征频率区可能大同小异,只要它们的化学结构上存在着微小差别,指纹区一般就有较明显的不同但是含碳较多的直链烷烃,碳数差别较小时,指纹区也无明显差别六、吸收峰的强度吸收峰的强度:是讨论一条吸收曲线上吸收峰(谱带)的相对强度或摩尔吸光系数与什么有关的额问题,而不是讨论浓度与吸光度之间的关系在红外分光光度法中,浓度与吸光度的关系与可见-紫外吸收光谱法一致,仍然服从Lambert-Beer定律1跃迁几率:跃迁过程中激发态分子占总分子的百分数,称为~谱带的强度即跃迁几率的量度跃迁几率与振动过程中偶极矩的变化有关,偶极矩变化越大,跃迁几率越大,谱带强度越大偶极矩的变化与键的偶极矩及振动形式有关在一定测定条件下,一个化合物的各基团的各种振动能级的跃迁几率恒定在不考虑相邻基团的相互抵消前提下,键的偶极矩越大,伸缩振动过程偶极矩变化越大振动过程偶极矩的变化还与分子结构的对称性有关,对称性越强,变化越小,完全对称,变化为零2谱带强度的划分:红外吸收光谱上的吸收峰高、矮,可以说明相对吸光强度谱带的绝对强度,需用摩尔吸光系数来描述用ε将红外吸收光谱的谱带强度区分为五级:非常强谱带(vs)ε>100强谱带(s) 20~100中等强度谱带(m) 10~20弱谱带(w) 1~10非常弱谱带(vw) <1第四节红外分光光度计及制样分光器:将复光分解为单色光的仪器称为~光度计:测量光强的仪器分光光度计:兼有分光器和光度计两种性能的仪器称为~按工作波长范围的不同,分为:紫外-可见、红外分光光度计仪器发展大体历经三个阶段:主要区别是单色器第一代仪器为棱镜红外分光光度计第二代仪器为光栅红外分光光度计第三代仪器为干涉调频分光傅里叶变换红外分光光度计一、光栅红外分光光度计光栅红外分光光度计,属于色散型一起,其色散元件为光栅按仪器的平衡原理可以分为:光学平衡式、电学平衡式红外分光光度计由:光源、吸收池(或固体样品框)、单色器、检测器、记录装置五个基本部分组成1 辐射源(光源)凡能发射连续波长的红外线,强度能满足需要的物体,均可为红外光源一般分为:碳硅棒、Nernst灯、特殊线圈Nernst灯低温时不导电2 色散元件目前多用反射光栅当红外线照射至光栅表面时,由反射线间的干涉作用而形成光栅光谱,各级光谱相互重叠,为了获得单色光,必须滤光由于一级光谱最强,故常滤去二级、三级光谱3 检测器常用检测器为:真空热电偶、Golay池热电偶:是利用不同导体构成回路时的温差现象,将温差转变为电位差的装置4 吸收池分为:液体池、气体池,分别用于液体样品与气体样品为了使红外线能透过,吸收池都具有岩盐窗片吸收池不用时需在保干器中保存(1)液体池分为固定池、密封池、可拆卸池可拆卸池:只能用于定性分析(2)气体池可用减压法将气体装入样品池中测定,气体池常用的光径为50mm及100mm多次反射气体池:测量低浓度、弱吸收气体样品,沸点较低的液体样品气体池在药物分析中很少应用二、干涉分光型红外分光光度计检测器多用热电型硫酸三甘肽(TGS)、光电导型检测器三、仪器性能红外分光光光度计的性能指标有分辨率、波数的准确度与重复性、透过率或吸光度的准确度与重复性仪器的最主要指标:I0线的平直度,检测器的满度能量输出1 分辨率(分辨本领):在某波数处恰能分开两个吸收峰的波数差为指标2 波数准确度与重复性波数准确度:仪器测定所得波数与文献值比较之差称为~波数重复性:多次重复测量同一样品,所得同一吸收峰波数的最大值与最小值之差称为~波数准确性关系测得光谱峰位的正确性,直接影响光谱解析四、制样气、液、固态样品皆可测定其红外光谱,但以固态样品最方便对样品的主要要求:1样品的纯度需大于98%,以便于纯化合物光谱对照2 样品应不含水分,若含水(结晶水、游离水)则对羟基峰有干扰样品更不得是水溶液若制成溶液,需用符合光谱波段要求的溶剂配制(一)固态样品固体样品可用三种方法制样:压片法、糊剂法、薄膜法(二)液态样品可用夹片法、液体池法粘度大的样品可用涂片法第五节应用与示例一、光谱解析方法红外吸收光谱是定性分析的有力工具(一)样品的来源和性质、1 来源、纯度、灰分来源可帮助估计样品及杂质的范围纯度需大于98%,若不符合要求则需精制混合物,需经色谱分离,而后再用红外定性有灰分则含无机物2 物理化学常数样品的沸点、熔点、折光率、旋光度等,作为光谱解析的旁证3 分子式不饱和度:分子结构中达到距离饱和时所缺一价元素的“对”数每缺二个一价元素时,不饱和度为一个单位(U=1)不饱和度公式:(二)光谱解析的几种情况1 若要求判定样品是否是某物质,可采用1 已知物对照法2 对照标准光谱法3 简单化合物一般进行红外光谱解析即可判定2 新发现化合物待定结构或化合物的结构复杂,或标准光谱尚未收载,则需要进行综合光谱解析综合光谱解析:包括元素分析、UV、IR、NMR、MS(三)光谱解析程序两区域法:将光谱划分为特征区及指纹区两个区域进行解析解析方法:四先、四后、相关法遵循:先特征区、后指纹区,先最强峰、后次强峰,先粗查、后细找,先否定、后肯定的顺序以及由一组相关峰确认一个官能团存在的原则。
第十四章胶体分散系统和大分子溶液自测题I.选择题1.憎液溶胶在热力学上是(b)。
(a) 不稳定、可逆系统(b) 不稳定、不可逆系统(c) 稳定、可逆系统(d) 稳定、不可逆系统2.在分析化学上有两种利用光学性质洲测定胶体溶液浓度的仪器,一种是比色计,另一种是比浊计,分别观察的是胶体溶液的(d)。
(a) 透射光、折射光(b) 散射光、透射光(c) 透射光、反射光(d) 透射光、散射光3. 在晴朗的白昼,天空呈蔚蓝色的原因是(b)。
(a) 蓝光波长短,透射作用显著(b) 蓝光波长短,散射作用显著(c) 红光波长长,透射作用显著(d) 红光波长长,散射作用显著4. 外加直流电场干胶体溶液,向某一电极做定向移动的是(b)。
(a) 胶核(b) 胶粒(C) 胶团(d) 紧密层5. 甲将0.12 dm3,浓度为0.02 mol·dm-3的KCI溶液和100 dm3,浓度为0.005 mol·dm-3的AgNO3溶液混合制备的溶胶,其胶粒在外电场的作用下电泳的方向是(b)。
(a) 向正极移动(b) 向负极移动(c) 不规则运动(d) 静止不动6甲下述对电动电势的描述错误的是(a)。
(a) 表示胶粒溶剂化层界面至均匀相内的电势差(b) 电动电势值随少量外加电解质而变化(c) 其值总是大于热力学电势值(d) 当双电层被压缩到溶剂化层相合时,电动电势值变为零7. 下列各电解质对某溶胶的聚沉值分别为电解质KNO3KAc MgSO4Al(NO3)3聚沉值/ (mol·dm-3) 50 110 0.81 0.095该胶粒的带电情况为(a)。
(a) 带负电(b) 带正电(C) 不带电(d) 不能确定8. 甲在一定量的以KCl为稳定剂的AgCl溶胶中加人电解质使其聚沉,下列电解质的用量由小到大的顺序正确的是(d)。
(a) AlCl3 < ZnSO4 < KCl (b) KCl < ZnSO4 < AlCl3(C) ZnSO4 < KCl < AlCl3 (d) KCl < AlCl3 < ZnSO49. 由等体积的1 mol·dm-3的KI溶液与0.8 mol·dm-3AgNO3溶液制备的AgI溶胶,分别加入下列电解质时,其聚沉能力最强的是(b)。
《仪器分析》作业参考答案第2章 光谱分析法导论2-1 光谱仪一般由几部分组成?它们的作用分别是什么? 参考答案:(1)稳定的光源系统—提供足够的能量使试样蒸发、原子化、激发,产生光谱; (2)试样引入系统(3)波长选择系统(单色器、滤光片)—将复合光分解成单色光或有一定宽度的谱带; (4)检测系统—是将光辐射信号转换为可量化输出的信号; (5)信号处理或读出系统—在显示器上显示转化信号。
2-2 单色器由几部分组成,它们的作用分别是什么? 参考答案:(1)入射狭缝—限制杂散光进入;(2)准直装置—使光束成平行光线传播,常采用透镜或反射镜; (3)色散装置—将复合光分解为单色光;(4)聚焦透镜或凹面反射镜—使单色光在单色器的出口曲面上成像; (5)出射狭缝—将额定波长范围的光射出单色器。
2-5 对下列单位进行换算:(1)150pm Z 射线的波数(cm -1) (2)Li 的670.7nm 谱线的频率(Hz )(3)3300 cm -1波数对应的波长(nm ) (4)Na 的588.995nm 谱线相应的能量(eV ) 参考答案:(1)171101067.61015011---⨯=⨯==cm cm λσ (2))(1047.4)(107.670100.314710Hz Hz c⨯=⨯⨯==-λν (3))(3030)(1003.3)(3300114nm cm cm =⨯===-νλ (4))(1.2)(10602.110995.588100.310625.6199834eV eV ch E =⨯⨯⨯⨯⨯⨯==---λ 2-6 下列种类型跃迁所涉及的能量(eV )范围各是多少?(1)原子内层电子跃迁; (4)分子振动能级跃迁; (2)原子外层电子跃迁; (5)分子转动能级跃迁; (3)分子的电子跃迁 参考答案跃迁类型 波长范围 能量范围/eV 原子内层电子跃迁 10-1 ~ 10nm 1.26×106 ~1.2×102原子外层电子跃迁 200 ~ 750nm 6~1.7 分子的电子跃迁 200 ~ 750nm 6~1.7 分子振动能级跃迁 0.75 ~ 50μm 1.7~0.02 分子转动能级跃迁50 ~ 1000μm2×10-2~4×10-7第10章 吸光光度法(上册)2、某试液用2cm 吸收池测量时,T=60%。
14-1 填充柱气相色谱分析某试样,柱长为1 m 时,测得A 、B 两组分的保留时间分别为5.80 min 和6.60 min ,峰底宽分别为0.78 min 和0.82 min.,死时间为1.10 min ,试计算以下各项(1)载气的平均线速度;(2)组分B 的分配比;(3)组分A 的有效塔板数;(4)选择性因子;(5)分离度;(6)条件不变情况下,A 、B 完全分离时所需的柱长。
解:(1)10min m 91.010.1/1t /L u -⋅===
(2)00.510
.110
.160.6k B =-=
(3)()()()58178.010.180.516A W t A t 16A n 2
2
0r eff =⎪
⎭⎫ ⎝⎛-⨯=⎪⎭
⎫ ⎝⎛-⨯=
(4)()()17.110
.180.510
.160.6A t B t 'r 'r =--==α
(5)()
0.178
.082.080.560.62R =+-⨯=
(6)m 25.20.10.15.1L 2
5.1=⋅⎪⎭
⎫ ⎝⎛=
14-2 已知组分A 和B 的分配系数分别为7.6和9.3,当它们通过相比β=90的填充柱时,能否达到基本分离?(基本分离时R=1.0)
解:2.16.7/3.9K /K A B ===α;10.090/3.9/K k B B ==β=
6969610.010.0112.12.1116k k 11R 16n 2
22
2
B B 2
2=⎪
⎭
⎫ ⎝⎛+⨯⎪⎭⎫ ⎝⎛-⨯⨯=⎪⎭⎫ ⎝⎛+⋅⎪⎭⎫ ⎝⎛-αα⋅= 填充柱柱长最多5 m (通常为2 m ),单位长度塔板数为1500/m ,因此无法达到这样的柱效,因此在上述条件下,不能实现分离。
(计算柱效时,用A 的分配比也行,本来就是估算)
14-3 某组分在一2 m 长的色谱柱上的分配比为3.0,若载气流速为28 cm ⋅min -1,请问在理想状态下20 min 后该组分柱中的位置(即谱带中心距进样端的距离)以及该组分流出色谱柱所需时间(以色谱峰值所对应的时间表示)。
解:100r min cm 70.3128
k 1u u u L u L
u L
t t t k -⋅=+=+=⇒-
=-=载气组分载气
载气组分
20 min 时,组分移动了20⨯7=140 cm (即距进样端140 cm )
该组分流出色谱柱的时间:t=L/u 组分=200/7=28.6 min
14-4 长度相等的两根色谱柱,其Van Deemter 常数如下:
(1)若载气流速为0.50 cm ⋅s -1,则哪根柱子的理论塔板数大?(2)柱1的最佳流速为多少? 解:(1)H 1=0.18+0.40/0.50+0.24⨯0.50 =1.1cm
H 2=0.05+0.50/0.50+0.10⨯0.50=1.1 cm 相等 (2)1111opt s cm 3.124.0/40.0C /B u -⋅===
14-5 用柱长为2 m ⨯2.0 mm 的色谱柱分离乙酸甲酯、丙酸甲酯和正丁酸甲酯。
它们的峰面积分别为18.1、43.6、29.9,相对质量校正因子分别为0.60、0.78、0.88,试计算丙酸甲酯的质量分数。
解:%78.47%1009
.2988.06.4378.01.1860.06
.4378.0w =⨯⨯+⨯+⨯⨯=丙酸甲酯
14-6 用内标法测定乙醛中水分的含量,以甲醇为内标。
称取0.0213g 甲醇加到4.586g 乙醛试样中进行色谱分析,测得水和甲醇的峰面积分别为150和174(具体单位与计算无关,因此忽略)。
已知水和甲醇的相对校正因子分别为0.55和0.58,计算乙醛中水分的含量。
解:%38.0%100586
.417458.0150
55.00213.0m A f A f m m m w s
OH CH OH CH O H O H OH CH s
O H O H 3322322=⨯⨯⨯⨯
=
⨯⋅⋅⨯=
=
14-7 为了测定一混合样品中的间苯二甲酸的含量,首先应了解样品的性质。
该样品大致含有间苯二甲酸和对苯二甲酸,还有一些不明的其它杂质。
现在称取样品0.3578 g ,内标癸二酸0.1029g 。
将样品衍生化,使其中的酸转化为相应的甲酯,然后进行分析。
测得间苯二甲酸二甲酯和癸二酸二甲酯的峰面积分别为23.7单位和24.5单位,已求得这两种酯的定量校正因子为0.77和1.00。
试问:(1)间苯二甲酸的质量分数;(2)为什么要将样品预先进行衍生化?(间苯二甲酸、癸二酸、间苯二甲酸二甲酯、癸二酸二甲酯的分子量分别为166、202、194、230)(此题暂不强求,有经理同学可尝试做一下)
%9.20%1003578
.05.2400.1202230
1029.07.2377.0194
166m A f m m m A f m m m m %w s
s s X x x
=⨯⨯⨯⨯
⨯⨯⨯=⋅⋅⋅⋅⋅==
试样
癸二酸
癸二酸二甲酯间苯二甲酸二甲酯间苯二甲酸
试样
气相色谱适合测定沸点低、极性小的且热稳定性高的试样。
间苯二甲酸的极性大且挥发性差,直接进样需较高柱温且易形成拖尾峰,导致分离效果变差。
酯化后极性变小、挥发性增强,分离效果变好。