初中常见化学式(人教版)
- 格式:xls
- 大小:30.50 KB
- 文档页数:2
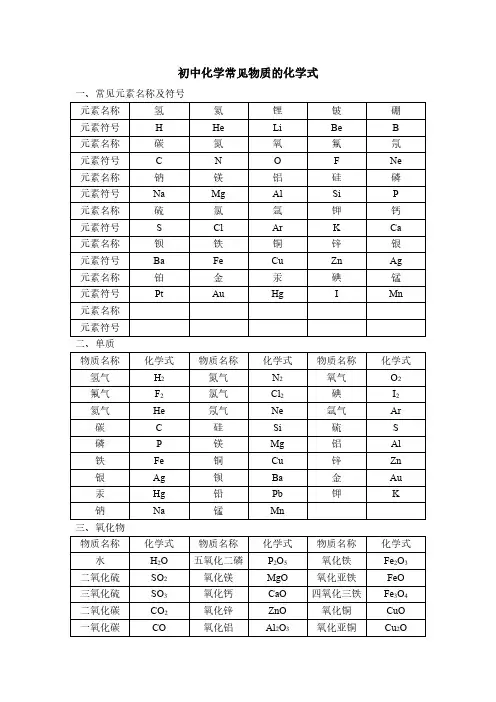
初中化学常见物质的化学式一、常见元素名称及符号元素名称氢氦锂铍硼元素符号H He Li Be B元素名称碳氮氧氟氖元素符号C N O F Ne 元素名称钠镁铝硅磷元素符号Na Mg Al Si P元素名称硫氯氩钾钙元素符号S Cl Ar K Ca 元素名称钡铁铜锌银元素符号Ba Fe Cu Zn Ag 元素名称铂金汞碘锰元素符号Pt Au Hg I Mn 元素名称元素符号二、单质物质名称化学式物质名称化学式物质名称化学式氢气H2氮气N2氧气O2氟气F2氯气Cl2碘I2氦气He氖气Ne氩气Ar 碳C硅Si硫S 磷P镁Mg铝Al 铁Fe铜Cu锌Zn 银Ag钡Ba金Au 汞Hg铅Pb钾K 钠Na锰Mn三、氧化物物质名称化学式物质名称化学式物质名称化学式水H2O五氧化二磷P2O5氧化铁Fe2O3二氧化硫SO2氧化镁MgO氧化亚铁FeO 三氧化硫SO3氧化钙CaO四氧化三铁Fe3O4二氧化碳CO2氧化锌ZnO氧化铜CuO 一氧化碳CO氧化铝Al2O3氧化亚铜Cu2O四、酸物质名称化学式物质名称化学式物质名称化学式盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3磷酸H3PO4五、碱物质名称化学式物质名称化学式物质名称化学式氢氧化钠NaOH氢氧化镁Mg(OH)2氢氧化铜Cu(OH)2氢氧化钾KOH氢氧化铝Al(OH)3氨水NH3·H2O 氢氧化钙Ca(OH)2氢氧化铁Fe(OH)3氢氧化钡Ba(OH)2氢氧化亚铁Fe(OH)2六、盐物质名称化学式物质名称化学式物质名称化学式硝酸钾KNO3氯化钾KCl硫酸钾K2SO4硝酸钠NaNO3氯化钠NaCl硫酸钠Na2SO4硝酸钡Ba(NO3)2氯化钡BaCl2硫酸钡BaSO4硝酸钙Ca(NO3)2氯化钙CaCl2硫酸钙CaSO4硝酸镁Mg(NO3)2氯化镁MgCl2硫酸镁MgSO4硝酸铝Al(NO3)3氯化铝AlCl3硫酸铝Al2(SO4)3硝酸锌Zn(NO3)2氯化锌ZnCl2硫酸锌ZnSO4硝酸铁Fe(NO3)3氯化铁FeCl3硫酸铁Fe2(SO4)3硝酸亚铁Fe(NO3)2氯化亚铁FeCl2硫酸亚铁FeSO4硝酸铜Cu(NO3)2氯化铜CuCl2硫酸铜CuSO4硝酸银AgNO3氯化银AgCl硫酸银Ag2SO4硝酸铵NH4NO3氯化铵NH4Cl硫酸铵(NH4)2SO4碳酸钾K2CO3碳酸钠Na2CO3碳酸钡BaCO3碳酸钙CaCO3碳酸镁MgCO3碳酸锌ZnCO3碳酸亚铁FeCO3碳酸银Ag2CO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸氢钠NaHSO4碳酸氢钙Ca(HCO3)2高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3。

人教版初中化学方程式大全一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O22MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光2. 铁在氧气中燃烧:3Fe + 2O2Fe3O4现象:剧烈燃烧、火星四射、生成黑色的固体3. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O22Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O 现象:淡蓝色的火焰6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O22P2O5现象::生成白烟7. 硫粉在空气中燃烧:S + O2 SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
8. 碳在氧气中充分燃烧:C + O2CO2现象:生成能够让澄清石灰水浑浊的气体9. 碳在氧气中不充分燃烧:2C + O22CO 现象:燃烧(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2↑14.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O22MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O22CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O22CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理): Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O22H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O22MgO41.铁在氧气中燃烧:3Fe + 2O2Fe3O442. 铜在空气中受热:2Cu + O22CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸---盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)---- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属--盐+ 氢气(见上)(2)酸+ 金属氧化物--盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱--- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐----另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑1、基本反应类型:化合反应:多变一分解反应:一变多置换反应:一单换一单复分解反应:互换离子2、常见元素的化合价(正价):一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳;一二铜,二三铁,二四六七锰特别。


写及配平的全部内容。
教学目的与目标1、书写化学方程式的原则2、按化学方程式的书写步骤正确书写简单的化学方程式3、会用最小公倍数法配平化学方程式教学内容1、化学方程式:用化学式来表示化学反应的式子。
2、书写原则(1)必须满足客观事实:不凭空臆造事实上不存在的物质和化学反应(2)必须符合质量守恒定律:等号两边各原子的种类、数目相等3、书写化学方程式的步骤以实验室加热氯酸钾制取氧气的反应为例:(1)写:根据实验事实,在式子的左、右两边写出反应物和生成物的化学式,并在式子左、右两边之间画条短线.当反应物或生成物不止一种时,分别用加号连接。
KCIO3——KCl+O2(2)配:配平化学方程式,并检查式子左右两边各元素原子的种类和数量,使之符合质量守恒定律.2KCIO3——2KCl+3O2(3)注:注明反应条件,如把点燃、加热(常用“△”号表示)、催化剂等写在等号的上方,把短线改为等号标出生成物的状态,如果反应物中没有气体,而生成物中出现了气体,要用“↑”号标出;溶液中的反应如果反应物中没有固体,生成物中有固体,要用“↓"号标出.2KCIO3 KCl+3O2↑课堂导入(4)查:检查化学式是否写对,化学方程式是否配平,条件和物质的状态是否标注、标的是否恰当。
4、注意事项(1)标明反应条件(如点燃、加热、催化剂等)(2)反应物中没有气体,生成物中有气体时,用气体符号“↑”标明;反应物中有气体,生成物中也有气体时,不用气体符号(3)反应物都是液体,生成物中有固体时用“↓"符号标明;反应物中有固体,生成物中也有固体时,不用沉淀符号5、口诀左写反应物,右写生成物;写对化学式,系数来配平;中间连等号,条件要标清;生成沉淀气,箭头来标明。
精讲精练1、关于化学方程式CH4+2O2错误!CO2+2H2O的描述正确的是( )A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子D.1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O2、某同学写了以下都存在错误的化学方程式:A、Mg+O2 错误! MgO2B、 KC1O3 KC1+O2↑。

人教版九年级化学常用化学式氢气H 2; 氮气N 2; 氧气O 2; 氯气Cl 2; 碘I 2; 红磷 P ; 金刚石C ;硫磺S ; 锌Zn ; 铜Cu ; 铝Al ; 铁Fe ; 水H 2O ; 过氧化氢双氧水H 2O 2 二氧化碳CO 2; 一氧化碳CO ; 一氧化氮NO ; 二氧化氮NO 2; 五氧化二磷P 2O 5; 二氧化硅SiO 2; 二氧化硫SO 2;三氧化硫SO 3; 二氧化锰MnO 2; 氧化铜CuO ; 氧化亚铁FeO ;三氧化二铁Fe 2O 3; 四氧化三铁Fe 3O 4; 氧化钙CaO ; 氧化钡BaO ; 三氧化二铝Al 2O 3; 氧化镁MgO ; 氧化钠Na 2O ; 氧化钾K 2O ; 氧化锌ZnO ; 氧化汞HgO ; 氧化钡BaO ; 氯化钡BaCl 2; 氧化铝AlCl 3; 氯化亚铁FeCl 2; 氯化铁FeCl 3; 氯化银AgCl ;氯化氢HCl ; 氯化钾KCl ; 氯化钠食盐 NaCl ; 氯化铜CuCl 2; 氯化镁MgCl 2; 氯化钙CaCl 2; 氯化锌ZnCl 2; 硫化氢H 2S ; 硫化锌ZnS ; 硫化钠Na 2S ; 硫酸镁MgSO 4; 硫酸亚铁FeSO 4; 硫酸铁Fe 2SO 43; 硫酸钠Na 2SO 4; 硫酸铝Al 2SO 43; 硫酸锌ZnSO 4; 硫酸H 2SO 4; 硫酸钾K 2SO 4; 硫酸钙CaSO 4; 硫酸钡BaSO 4; 硫酸铜CuSO 4; 碳酸锌ZnCO 3; 碳酸钾K 2CO 3; 碳酸钡BaCO 3; 碳酸H 2CO 3; 碳酸钠Na 2CO 3; 碳酸镁MgCO 3; 碳酸钙CaCO 3; 氢氧化亚铁FeOH 2; 氢氧化钠NaOH ; 氢氧化镁MgOH 2;氢氧化铜CuOH 2; 氢氧化钡BaOH 2; 氢氧化钙CaOH 2; 氢氧化铝AlOH 3; 氢氧化钾KOH ; 氢氧化铁FeOH 3; 氢氧化锌ZnOH 2; 氨水NH 3·H 2O ; 硝酸HNO 3; 硝酸钙CaNO 32; 硝酸镁MgNO 32; 硝酸钠NaNO 3; 硝酸银AgNO 3; 硝酸钾KNO 3; 硝酸铜CuNO 32; 硝酸铝AlNO 33; 硝酸锌ZnNO 32; 硝酸铁FeNO 33; 硝酸亚铁FeNO 32; 硝酸钡BaNO 32; 碳酸铵NH 42CO 3; 硝酸铵NH 4NO 3; 氯化铵NH 4Cl ; 硫酸铵NH 42SO 4; 氨气NH 3; 碳酸氢铵NH 4HCO 3; 碳酸氢钠NaHCO 3; 氯酸钾KClO 3; 锰酸钾K 2MnO 4 高锰酸钾 KMnO 4; 亚硝酸钠NaNO 2; 胆矾CuSO 4·5H 2O ; 甲烷CH 4 乙醇C 2H 5OH ; 乙酸醋酸CH 3COOH ; 尿素CONH 22;。

中考复习资料总结九年级上册化学方程式及实验现象总结一、化合反应1、木炭(碳)在空气中燃烧现象:发出红光..,放出热量,生成能使澄清石灰水变浑浊的气体;在氧气中燃烧现象:发出白光..,放出热量,生成能使澄清石灰水变浑浊的气体。
C+O2点燃CO2(充分燃烧)2C+O2点燃 2 CO (不充分燃烧)2、硫在空气中燃烧现象:发出微弱的淡蓝色......火焰,生成有刺激性气味的气体,放出热量;在氧气中燃烧现象:发出明亮的蓝紫色......火焰,生成有刺激性气味的气体,放出热量。
S+O2点燃SO23、红磷(或者白磷)在空气中燃烧现象:产生大量白烟,放出热量。
4P+5O2点燃2P2O54、注意..铁丝在空气中不能燃烧;在氧气燃烧现象:剧烈燃烧,火星四射,生成黑色固体,放出热量。
3Fe+2O2点燃Fe3O45、镁带在空气中燃烧现象:发出耀眼的白光,冒白烟,生成白色粉末,放出热量。
2Mg+O2点燃2MgO6、氢气在空气(或氧气)中燃烧现象:发出淡蓝色火焰,放出热量,火焰上罩一个干而冷的烧杯,烧杯内壁出现水雾。
2H2+O2点燃2H2O7、铜在空气中加热现象:红色固体逐渐变成黑色2Cu+O2△2CuO8、一氧化碳在空气中燃烧现象:发出蓝色火焰,放出热量,火焰上罩一个涂有澄清石灰水的烧杯,澄清石灰水变浑浊。
2CO+O2点燃2CO29、汞在加热的条件下与氧气反应:2Hg+O2△2HgO10、铝在空气中燃烧:4Al+3O2点燃2Al2O311、二氧化碳通过灼热的碳层:CO2 +C高温2CO12、二氧化碳与水反应:CO2 +H2O == H2CO3(二氧化碳通入紫色石蕊试液,溶液变红的原因)二、分解反应1、氧化汞加热分解:2HgO△2Hg+O2↑2、高锰酸钾制氧气:2KMnO4△K2MnO4+MnO2+O2↑3、氯酸钾制氧气:2KClO3MnO22KCl+3O2↑△MnO24、过氧化氢制氧气:2H2O2 2H2O+O2↑5、电解水:2H2O通电2H2↑+O2↑6、碳酸不稳定,易分解:H2CO3 === H2O+CO2↑ (二氧化碳通入石蕊试液,溶液变红,加热红色变为紫色的原因)三、其他反应1、实验室制取二氧化碳:CaCO3+2HCl==CaCl2+ H2O + CO2↑ (大理石或石灰石和稀盐酸)2、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑ (CuO为黑色粉末)现象:黑色粉末逐渐变为红色,澄清石灰水变浑浊。

人教版九年级化学第十一单元盐和化肥知识点1、氯化钠:NaCl,食盐的主要成分物性:白色粉末状固体易溶于水用途:①、重要的调味品,②、医疗上配制生理盐水,③、农业上配制溶液选种,④、工业上作重要原材料,制取Na₂CO₃、NaOH、Cl₂、HCl等⑤、生活中腌制蔬菜、水果、肉类⑥、交通方面,用NaCl除积雪。
(其他可溶性盐也具有这种性质,但要注意环保)。
2、粗盐:含有可溶性NaCl、MgCl₂、CaCl₂,也含难溶性固体:如泥沙。
粗盐提纯方法:溶解→沉淀(反应或静置或吸附)→过滤→蒸发→结晶。
3、①名称:碳酸钠②化学式:Na₂CO₃③俗称:纯碱、苏打④物性:白色粉末状固体易溶于水⑤用途:工业原料,广泛用于玻璃、造纸、纺织和洗涤剂生产等4、①名称:碳酸钙②化学式:CaCO₃③主要成份:大理石,石灰石、鸡蛋壳、贝壳④物性:白色粉末状固体,难溶于水⑤用途:建筑材料、补钙剂、摩擦剂等。
5、①名称:碳酸氢钠②化学式:NaHCO₃③俗称:小苏打④物性:白色粉末状固体、可溶于水⑤、用途:发酵粉主要成分之一,医疗上治疗胃酸过多症,除去浓硫酸清洗后的残留液。
6、碳酸钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:Na₂CO₃+2HCl=2NaCl+CO₂↑+H207、碳酸氢钠与稀盐酸反应现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:NaHCO₃+HCl=NaCl+CO₂↑+H₂O8、CO32-、HCO3-的鉴定方法①药品:稀盐酸、澄清石灰水②方法:取样,向待测样品中加入过量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-或HCO3-。
9、Na₂CO₃与Ca(OH)₂反应现象:溶液中有白色沉淀生成原理:Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH.10、Na₂CO₃与BaCl₂反应现象:溶液中有白色沉淀生成原理:Na2CO₃+BaCl₂=BaCO₃↓+2NaCl11、CuS04与Fe反应现象:在铁的表面析出红色物质,溶液由蓝色变为浅绿色。

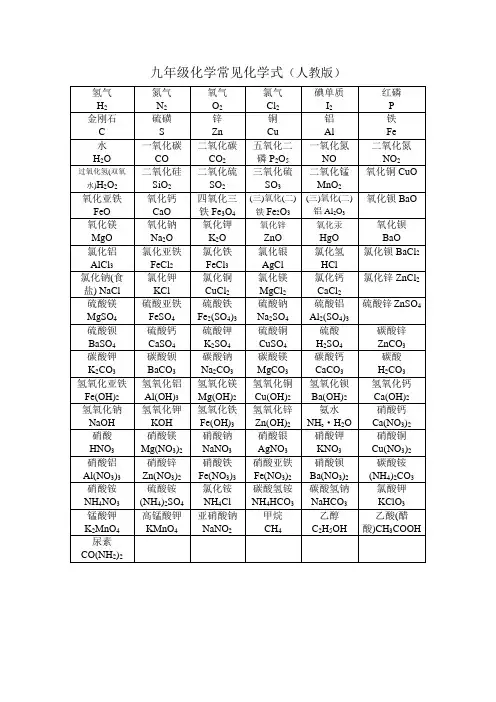

初中常见化学式一、常见单质氢气:H2氮气:N2氯气:Cl2氧气:O2臭氧:O3氦气:He氖气:Ne 氩气:Ar 碳:C 硅:Si 硫:S 磷:P 碘:I2钾:K 钙:Ca 钠:Na 镁:Mg 铝:Al 锌:Zn 铁:Fe 铜:Cu 汞:Hg 银:Ag二、化合物1、氧化物水:H2O 三氧化硫:SO3一氧化碳:CO 二氧化碳:CO2五氧化二磷:P2O5过氧化氢:H2O2二氧化氮:NO2二氧化硫:SO2氧化钙:CaO氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4氧化镁:MgO氧化锌:ZnO 二氧化锰:MnO2氧化汞:HgO 氧化铝:Al2O3氧化铜:CuO2、其他化合物硝酸:HNO3硫酸:H2SO4盐酸:HCl 碳酸:H2CO3硫酸钡:BaSO4氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化钙:Ca(OH)2氢氧化镁:Mg(OH)2氢氧化铝:Al(OH)3氢氧化锌:Zn(OH)2氢氧化铁:Fe(OH)3氯化铝:AlCl3氢氧化亚铁:Fe(OH)2氢氧化铜:Cu(OH)2氢氧化钡:Ba(OH)2氯化钾:KCl氨水:NH3·H2O 氯化钠:NaCl 氯化铜:CuCl2氯化亚铁:FeCl2氯化铁:FeCl3氯化银:AgCl 氯化钙:CaCl2氯化镁:MgCl2硫化氢:H2S氯化钡:BaCl2氯化锌:ZnCl2硫酸铜:CuSO4高锰酸钾:KMnO4锰酸钾:K2MnO4氯酸钾:KClO3碳酸钙:CaCO3硝酸钾:KNO3硝酸钠:NaNO3硝酸铁:Fe(NO3)3硝酸亚铁:Fe(NO3)2硝酸铝:Al(NO3)3碳酸钠:Na2CO3碳酸钙:CaCO3碳酸铵:(NH4)2CO3碳酸氢钠:NaHCO3硫酸铁:Fe2(SO4)3硫酸亚铁:FeSO4硝酸银:AgNO3硝酸钡:Ba(NO3)2硝酸铵:NH4NO3硫酸钡:BaSO43、常见有机化合物甲烷:CH4乙醇:C2H5OH 葡萄糖:C6H12O6初中化学方程式一、氧气的性质:Ⅰ.单质与氧气的反应(化合反应):1. 镁在空气中燃烧:2Mg+O2点燃2MgO2. 铁在氧气中燃烧:3Fe+2O2点燃Fe3O43. 铜在空气中受热:2Cu+O2△2CuO5. 氢气中空气中燃烧:2H2+O 2 点燃 2H 2O6. 红磷在空气中燃烧:4P+5O 2点燃 2P 2O 57. 硫粉在空气中燃烧:S+O 2 点燃 SO 28. 碳在氧气中充分燃烧:C+O 2 点燃 CO 29. 碳在氧气中不充分燃烧:2C+O 2 点燃 2CO Ⅱ.化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 2 点燃 2CO 2 11. 甲烷在空气中燃烧:CH 4 + 2O 2 点燃 CO 2+2H 2O 12. 酒精在空气中燃烧:C 2H 5OH+3O 2 点燃 2CO 2+3H 2O Ⅲ.氧气的来源:13.玻义耳研究空气的成分实验:2HgO △ 2Hg+O 2↑ 14.加热高锰酸钾:2KMnO 4 △ K 2MnO 4+MnO 2+O 2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H 2O 2 MnO 2 2H 2O+O 2↑ 二、自然界中的水:16.电解水:2H 2O 通电 2H 2↑+O 2↑ 17.生石灰溶于水:CaO+H 2O Ca(OH)2 18.二氧化碳可溶于水: H 2O+CO 2H 2CO 3 三、质量守恒定律:19.镁在空气中燃烧:2Mg+O 2 点燃 2MgO 20.铁和硫酸铜溶液反应:Fe+CuSO 4FeSO 4+Cu 21.氢气还原氧化铜:H 2+CuO △ Cu+H 2O 22. 镁还原氧化铜:Mg+CuO △ Cu+MgO 四、碳和碳的氧化物: Ⅰ.碳的化学性质:23. 碳在氧气中充分燃烧:C+O 2 点燃 CO 224.木炭还原氧化铜:C+2CuO 高温 2Cu+CO 2↑25. 焦炭还原氧化铁:3C+2Fe2O 3 高温 4Fe+3CO 2↑ Ⅱ.煤炉中发生的三个反应(属于化合反应): 26.煤炉的底层:C+O 2 点燃 CO 2 27.煤炉的中层:CO 2+C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO+O 2 点燃 2CO 2 Ⅲ.二氧化碳的制法与性质:29.大理石与稀盐酸反应:CaCO 3+2HCl CaCl 2+H 2O+CO 2↑ 30.碳酸不稳定而分解:H 2CO 3H2O+CO 2↑ 31.二氧化碳可溶于水: H 2O+CO 2H 2CO 3 32.高温煅烧石灰石(工业制二氧化碳):CaCO 3 高温 CaO+CO 2↑ 33.石灰水与二氧化碳反应:Ca(OH)2 + CO 2CaCO 3↓+ H 2O Ⅳ.一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO △ Cu+CO 2 35.一氧化碳的可燃性:2CO+O 2 点燃 2CO 2 Ⅴ.其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理): Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4+2O 2 点燃 CO 2+2H 2O 38.酒精在空气中燃烧:C 2H 5OH+3O 2 点燃 2CO 2+3H 2O六、金属:Ⅰ.金属与氧气反应:40.镁在空气中燃烧:2Mg+O 2 点燃 2MgO 41.铁在氧气中燃烧:3Fe+2O 2 点燃 Fe 3O 4 42.铜在空气中受热:2Cu+O 2 △ 2CuO 43.铝在空气中形成氧化膜:4Al+3O 22Al 2O 3 Ⅱ.金属单质+酸盐+氢气(置换反应): 44.锌和稀硫酸Zn+H 2SO 4ZnSO 4+H 2↑ 45.铁和稀硫酸Fe+H2SO4FeSO 4+H 2↑ 46.镁和稀硫酸Mg+H2SO4MgSO 4+H 2↑ 47.铝和稀硫酸2Al+3H 2SO 4Al 2(SO 4)3+3H 2↑ 48.锌和稀盐酸Zn+2HCl ZnCl 2+H 2↑ 49.铁和稀盐酸Fe+2HCl FeCl 2+H 2↑ 50.镁和稀盐酸Mg+2HCl MgCl 2+H 2↑ 51.铝和稀盐酸2Al+6HCl 2AlCl 3+3H 2↑ Ⅲ.金属单质+盐(溶液)新金属+新盐: 52.铁和硫酸铜溶液反应:Fe+CuSO 4FeSO 4+Cu 53.锌和硫酸铜溶液反应:Zn+CuSO 4ZnSO 4+Cu 54.铜和硝酸汞溶液反应:Cu+Hg(NO 3)2Cu(NO 3)2+Hg Ⅳ.金属铁的治炼原理:55.3CO+2Fe2O 3 高温 4Fe+3CO 2↑ 七、酸、碱、盐:(一)酸的化学性质: Ⅰ.金属化合物+酸盐+水:56.氧化铁和稀盐酸反应:Fe2O 3+6HCl 2FeCl 3+3H 2O 57.氧化铁和稀硫酸反应:Fe2O 3+3H 2SO 4Fe 2(SO4)3+3H 2O 58.氧化铜和稀盐酸反应:CuO+2HCl CuCl 2+H 2O 59.氧化铜和稀硫酸反应:CuO+H 2SO 4CuSO 4+H 2O Ⅱ.酸+碱盐+水(中和反应)【A+BC B+AC 】: 60.盐酸和烧碱起反应:HCl+NaOH NaCl+H 2O 61. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2CaCl 2+2H 2O 62. 氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3AlCl 3+3H 2O 63. 硫酸和烧碱反应:H 2SO 4+2NaOH Na 2SO 4+2H 2O Ⅲ.酸+盐新酸+新盐:64.大理石与稀盐酸反应:CaCO 3+2HCl CaCl 2+H 2O+CO 2↑ 65.碳酸钠与稀盐酸反应: Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO 3+HCl NaCl+H 2O+CO 2↑ 67. 硫酸和氯化钡溶液反应:H 2SO 4+BaCl 2BaSO 4↓+2HCl (二)碱的化学性质: Ⅰ.碱+非金属氧化物盐+水:68.苛性钠暴露在空气中变质:2NaOH+CO 2Na2CO 3+H 2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO 2Na2SO 3+H 2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO 3Na2SO 4+H 2O 71.消石灰放在空气中变质:Ca(OH)2+CO 2CaCO 3↓+H 2O 72. 消石灰吸收二氧化硫:Ca(OH)2+SO 2CaSO 3↓+H 2OⅡ.碱+酸盐+水(中和反应,方程式见上)Ⅲ.碱+盐新碱+新盐:73. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3CaCO3↓+2NaOH(三)盐的化学性质:Ⅰ.盐(溶液)+金属单质另一种金属+另一种盐:74. 铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+CuⅡ.盐 + 酸另一种酸+另一种盐:75.碳酸钠与稀盐酸反应: Na2CO3+2HCl2NaCl+H2O+CO2↑76.碳酸氢钠与稀盐酸反应:NaHCO3+HCl NaCl+H2O+CO2↑Ⅲ.盐+碱另一种碱+另一种盐:77. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3CaCO3↓+2NaOHⅣ.盐 + 盐两种新盐:78.氯化钠溶液和硝酸银溶液:NaCl+AgNO3AgCl↓+NaNO378.硫酸钠和氯化钡:Na2SO4+BaCl2BaSO4↓+2NaCl。
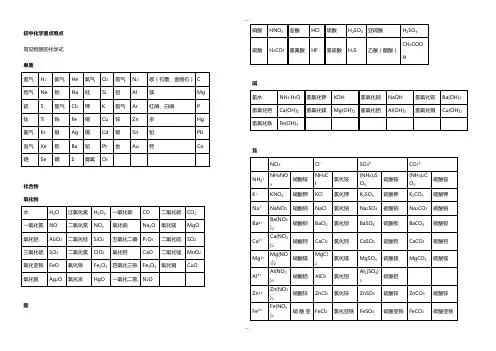
初中化学重点难点 常见物质的化学式 单质化合物 氧化物酸碱 盐铁Fe3+Fe(NO3)3硝酸铁FeCl3氯化铁Fe 2(SO4)3硫酸铁Cu2+Cu(NO3)2硝酸铜CuCl2氯化铜CuSO4硫酸铜Ag+AgNO3硝酸银AgCl 氯化银Ag2SO4硫酸银Ag2CO3碳酸银高锰酸钾KMnO4氯酸钾KClO3锰酸钾K2MnO4碳酸氢钙Ca(HCO3)2硫酸铜晶体CuSO4·5H2O 碳酸钠晶体Na2CO3·10H2 O碳酸氢铵NH4HCO3磷酸钙Ca3(PO4)2磷酸二氢钙Ca(H2PO4)2碳酸氢钠NaHCO3亚硝酸钠NaNO2磷酸二氢铵NH4H2PO4磷酸氢二铵(NH4)2HPO4羟基磷酸钙Ca10(PO4)6(OH)2有机物甲烷CH4乙醇(酒精)C2H5OH 乙酸(醋酸)CH3COOH淀粉(C6H10O5)n葡萄糖C6H12O6蔗糖C12H22O11尿素CO(NH2)2其他:氨气NH3常见物质的俗名名称俗名化学式名称俗名化学式碳酸钠苏打、纯碱Na2CO3氧化钙生石灰CaO碳酸钠晶体天然碱、石碱、口碱Na2CO3·10H2O固体二氧化碳干冰CO2碳酸氢钠小苏打NaHCO 一氧化碳和氢气水煤气CO和H2氢氧化钠烧碱、火碱、苛性钠NaOH 硫酸铜晶体胆矾、蓝矾CuSO4·5H2O氢氧化钙熟石灰Ca(OH)2甲烷沼气CH4常见的化学方程式化合反应●红磷在空气中燃烧,产生白烟:4P+5O22P2O5白磷自燃:4P+5O2=2P2O5●木炭充分燃烧:C+O2CO2●木炭不充分燃烧:2C+O22CO●硫在空气(氧气)中燃烧:S+O2SO2●铁丝在氧气中燃烧:3Fe+2O2Fe3O4●铝在氧气中燃烧:4Al+3O22Al2O3铝不易生锈的原因:4Al+3O2=2Al2O3●镁在空气中燃烧:2Mg+O22MgO●铜在空气中加热:2Cu+O22CuO●氢气在氧气中燃烧:2H2+O22H2O●将CO2变成CO:C+CO22CO●二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3●用生石灰制取熟石灰:CaO+H2O=Ca(OH)2●一氧化碳燃烧:2CO+O 22CO2●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:CaCO3+CO2+H2O=Ca(HCO3)2●氢气在氯气中燃烧:H2+Cl 22HCl钠在氯气中燃烧:2Na+Cl 22NaCl镁在氮气中燃烧:3Mg+N 2Mg3N2(注意氮元素的化合价)上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。
人教版初三化学需要背诵的化学式一、介绍化学式是化学元素或化合物的符号表示法,是化学中的基本概念之一。
在初中化学学习中,掌握化学式是非常重要的,不仅是理论学习的基础,也是实验操作的必备知识。
人教版初三化学需要背诵的化学式,涉及到元素的符号、化合物的组成以及化学反应等内容。
二、常见元素的化学式1. 氢:H2. 氦:He3. 铍:Be4. 碳:C5. 氮:N6. 氧:O7. 氟:F8. 钠:Na9. 镁:Mg10. 铝:Al11. 锌:Zn12. 铁:Fe13. 铜:Cu三、常见化合物的化学式1. 氨气:NH32. 氯化钠:NaCl3. 氧化铜:Cu2O4. 二氧化碳:CO25. 一氧化碳:CO6. 亚硝酸盐:NO2-7. 硫酸:H2SO48. 碳酸钠:Na2CO39. 铝矾:Al2(SO4)310. 硫化氢:H2S11. 过氧化氢:H2O212. 白砷:As2O3四、化学反应中的化学式1. 直接组成反应:例如氢气与氧气的反应生成水,化学式为2H2 + O2 → 2H2O2. 分解反应:例如过氧化氢分解成水和氧气,化学式为2H2O2 → 2H2O + O23. 单一置换反应:例如锌与盐酸生成氢气和氯化锌,化学式为Zn + 2HCl → ZnCl2 + H24. 双置换反应:例如氯化钠与硫酸反应生成盐酸和硫酸钠,化学式为NaCl + H2SO4 → HCl + Na2SO45. 酸碱中和反应:例如氢氧化钠与硫酸反应生成水和硫酸钠,化学式为2NaOH + H2SO4 → 2H2O + Na2SO4五、总结人教版初三化学需要背诵的化学式,包括常见元素的化学式、常见化合物的化学式以及化学反应中的化学式。
通过背诵这些化学式,可以帮助学生牢固掌握这些基本的化学知识,为进一步深入学习化学打下坚实的基础。
在日常的学习中,可以通过多种方式来背诵和巩固这些化学式,如制作化学式卡片、做化学式练习题等。
希望学生们能够重视化学式的背诵,从而在化学学习中取得更好的成绩。
初中化学上册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH- NO3- CO32- SO4 2- PO43- NH4+2、化合价口诀(1) 常见元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三五氮磷三价铝;铜汞一二铁二三;二、四、六硫四价碳;许多元素有变价,条件不同价不同。
(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2(9)生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态),除了有颜色的固体,其他固体一般为白色。
初中化学上册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根磷酸根铵根OH-NO3-CO32-SO4 2-PO43-NH4+2、化合价口诀(1) 常见元素化合价口诀:钾钠银氢正一价;氟氯溴碘负一价;钙镁钡锌正二价;铜一二铁二三铝三硅四氧负二二四六硫二四碳(2) 常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
4、必须熟记的制取物质的化学方程式〔1〕实验室制取氧气一:2KMnO4===K2MnO4+MnO2+O2↑〔2〕实验室制取氧气二:2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三:2KClO3===2KCl+3O2↑〔4〕实验室制法CO2:CaCO3+2HCl==CaCl2+H2O+CO2↑〔5〕实验室制取氢气:Zn+H2SO4==ZnSO4+H2↑〔6〕电解水制取氢气:2H2O===2H2↑+O2↑〔7〕湿法炼铜术〔铁置换出铜〕:Fe+CuSO4==FeSO4+Cu〔8〕炼铁原理:3CO+Fe2O3===2Fe+3CO2〔9〕生灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2〔10〕生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al ,Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au。
〔按5个一句顺序背诵〕钾钙钠镁铝,锌铁锡铅〔氢〕,铜汞银铂金。
三、常见物质的颜色、状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色〔汞为银白色液态〕,除了有颜色的固体,其他固体一般为白色。
2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫磺:淡黄色4、溶液的颜色:含Cu2+的溶液呈蓝色〔如CuSO4溶液〕;含Fe2+的溶液呈浅绿色〔如FeCl2溶液〕;含Fe3+的溶液呈棕黄色〔如FeCl3溶液〕,其余溶液一般为无色。
常见物质的化学式单质氢气H2氦气He 氧气O2氮气N2碳(石墨、金刚石)C 氖气Ne 钠Na 硅Si 铝Al 镁Mg 硫S 氯气Cl2钾K 氩气Ar 红磷、白磷P 钛Ti 铁Fe 铜Cu 锌Zn 汞Hg 氪气Kr 银Ag 镉Cd 锡Sn 铅Pb 氙气Xe 钡Ba 铂Pt 金Au 钙Ca 硒Se 碘I2臭氧O3化合物氧化物水H2O过氧化氢H2O2一氧化碳CO二氧化碳CO2一氧化氮NO二氧化氮NO2氧化钠Na2O 氧化镁MgO氧化铝Al2O3二氧化硅SiO2五氧化二磷P2O5二氧化硫SO2三氧化硫SO3二氧化氯ClO2氧化钙CaO二氧化锰MnO2氧化亚铁FeO 氧化铁Fe2O3四氧化三铁Fe3O4氧化铜CuO氧化银Ag2O 氧化汞HgO 一氧化二N2O氮酸硝酸HNO3盐酸HCl 硫酸H2SO4亚硫酸H2SO3碳酸H2CO3氢氟酸HF氢硫酸H2S 乙酸(醋酸)CH3COOH碱氨水NH3·H2O 氢氧化钾KOH 氢氧化钠NaOH 氢氧化钡Ba(OH)2氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化铜Cu(OH)2氢氧化铁Fe(OH)3盐NO3-Cl-SO42-CO32-NH4+NH4NO3硝酸铵NH4Cl 氯化铵(NH4)2SO4硫酸铵(NH4)2CO3碳酸铵K+KNO3硝酸钾KCl 氯化钾K2SO4硫酸钾K2CO3碳酸钾Na+NaNO3硝酸钠NaCl 氯化钠Na2SO4硫酸钠Na2CO3碳酸钠Ba2+Ba(NO3)2硝酸钡BaCl2氯化钡BaSO4硫酸钡BaCO3碳酸钡Ca2+Ca(NO3)2硝酸钙CaCl2氯化钙CaSO4硫酸钙CaCO3碳酸钙Mg2+Mg(NO3)2硝酸镁MgCl2氯化镁MgSO4硫酸镁MgCO3碳酸镁Al3+Al(NO3)3硝酸铝AlCl3氯化铝Al2(SO4)3硫酸铝Zn2+Zn(NO3)2硝酸锌ZnCl2氯化锌ZnSO4硫酸锌ZnCO3碳酸锌Fe2+Fe(NO3)2硝酸亚铁FeCl2氯化亚铁FeSO4硫酸亚铁FeCO3碳酸亚铁Fe3+Fe(NO3)3硝酸铁FeCl3氯化铁Fe2(SO4)3硫酸铁Cu2+Cu(NO3)2硝酸铜CuCl2氯化铜CuSO4硫酸铜Ag+AgNO3硝酸银AgCl 氯化银Ag2SO4硫酸银Ag2CO3碳酸银高锰酸钾KMnO4氯酸钾KClO3锰酸钾K2MnO4碳酸氢钙Ca(HCO3)2硫酸铜晶体CuSO4·5H2O碳酸钠晶体Na2CO3·10H2O碳酸氢铵NH4HCO3磷酸钙Ca3(PO4)2磷酸二氢钙Ca(H2PO4)2碳酸氢钠NaHCO3亚硝酸钠NaNO2磷酸二氢铵NH4H2PO4磷酸氢二铵(NH4)2HPO4羟基磷酸钙Ca10(PO4)6(OH)2有机物甲烷CH4乙醇(酒精)C2H5OH乙酸(醋酸)CH3COOH 淀粉(C6H10O5)n葡萄糖C6H12O6蔗糖C12H22O11尿素CO(NH2)2其他:氨气NH3。