1-附件一2019年全国临床检验医疗质量控制指标室间质量评价活动 ...
- 格式:doc
- 大小:35.86 KB
- 文档页数:2


国家卫生健康委办公厅、国家中医药局办公室关于启动2019年全国三级公立医院绩效考核有关工作的通知文章属性•【制定机关】国家卫生健康委员会,国家中医药管理局•【公布日期】2019.04.17•【文号】国卫办医函〔2019〕371号•【施行日期】2019.04.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗机构与医师正文关于启动2019年全国三级公立医院绩效考核有关工作的通知国卫办医函〔2019〕371号各省、自治区、直辖市及新疆生产建设兵团卫生健康委、中医药管理局,医管中心:为落实《国务院办公厅关于加强三级公立医院绩效考核工作的意见》(国办发〔2019〕4号),全面推进三级公立医院绩效考核工作,确保绩效考核数据客观真实可比,现将有关工作要求通知如下:一、关于病案首页填报及上传的要求各地卫生健康行政部门(含中医药主管部门,下同)要加强住院病案首页质量管理,提升首页数据质量。
全国三级公立医院(含三级公立中医医院,下同)要按照要求认真完成住院病案首页数据填报及上传工作。
(一)规范使用2011年修订版住院病案首页。
各三级公立医院要按照《卫生部关于修订病案首页的通知》(卫医政发〔2011〕84号)、《国家卫生计生委办公厅关于印发住院病案首页数据填写质量规范(暂行)和住院病案首页数据质量管理与控制指标(2016版)的通知》(国卫办医发〔2016〕24号)要求,规范填写住院病案首页,客观反映住院期间诊疗信息。
各三级公立中医医院要按照《国家中医药管理局关于修订中医住院病案首页的通知》(国中医药医政发〔2011〕54号)、《国家中医药管理局办公室关于印发中医病案首页数据填写质量规范、质量管理与质控指标和质控考核细则的通知》(国中医药医政发〔2017〕1号)要求,规范填写住院病案首页,客观反映住院期间诊疗信息。
(二)使用统一的疾病编码和手术操作编码。
各三级公立医院要全面启用《疾病分类代码国家临床版2.0》(附件1)和《手术操作分类代码国家临床版2.0》(附件2)。

卫生部临检中心的室间质评是每个血液中心或中心血站必须参加的一项活动,因为参加的实验室之多和样本浓度的多样性而受到全国用户的好评。
2017年共计437家实验室参与该室间质评活动,卫生部临检中心对所有室间质评样本均给出了详细的结果,便于我们对比分析,找出问题并及时解决。
本实验室多年来一直积极参与卫生部临检中心的室间质评样本的评价活动,酶免参加的项目包括:HBsAg 、抗-HCV 、抗-HIV 、抗-TP 。
通过参加室间质评活动,可以更加清楚地认识实验室的血液检测方法的性能及血筛试剂的客观评价[1]。
本文就2017年参加卫生部临检中心酶免四项的室间质评结果进行回顾性分析,评价实验室检测系统的性能。
1资料与方法1.1室间质评项目检测项目包括乙型肝炎表面抗原(HBs Ag)、丙型肝炎抗体(抗-HCV)、梅毒抗体和人类免疫缺陷病毒抗体(抗-HIV)4项传染病免疫学指标。
1.2标本来源2017年我实验室共收到三次卫生部临检中心发放的质控样品,均按要求进行保存,实验室完全融化平衡至室温,若有絮状物离心后混匀取上清液进行加样。
卫生部临检中心2017年全年共计发放三次室间质评样本,每次5个样本,共计15个样本。
标本序号分别为1751~1755、1761~1765、1771~1775。
1.3试剂、仪器与质控品乙肝表面抗体检测试剂盒(WT 、LZ),丙肝抗体检测试剂盒(WT 、KH),人类免疫缺陷病毒抗体检测试剂盒(WT),人类免疫缺陷病毒抗原/抗体检测试剂盒(BIO-RAD),梅毒抗体检测试剂盒(WT 、LZ)。
Microlab STAR 全自动样本处理系统(瑞士哈美顿),Microlab FAME 全自动酶免分析仪(瑞士哈美顿),Sunrise 酶标仪(瑞士帝肯),质控品为北京康彻思坦生物技术有限公司提供的酶免四项混合质控品。
实验中涉及到的五种厂家的试剂均由汉语拼音缩写字母标示。
1.4评价方法验证试验(PT):合格项目数/总项目数×100%=PT 得分,PT 得分≥80%为合格,PT 得分<80%为不合格。

2024年临床检验室间质量评价标准和2023年临床检验室间质量评价标准1. 引言1.1 概述随着社会经济的不断发展和人们对健康意识的提高,临床检验在医疗领域中的作用日益重要。
临床检验室作为确保诊断结果准确性和可靠性的重要环节,在医学实践中扮演着关键角色。
因此,质量评价标准成为了衡量临床检验室工作质量的重要依据。
1.2 文章结构本文将围绕2024年和2023年两个时间点的临床检验室间质量评价标准展开论述。
首先介绍2024年临床检验室间质量评价标准的背景、制定过程和核心要点。
然后,对比分析2023年与2024年标准之间的主要差异点,并探讨影响这些差异点的因素。
最后,根据对比结果进行总结并提出对未来发展的展望和建议。
1.3 目的本文旨在通过比较不同时间点下的临床检验室间质量评价标准,揭示其变化趋势和影响因素,并为未来该领域发展提供参考和建议。
通过详细分析这些标准的制定过程和核心要点,我们可以更好地理解临床检验室质量评价的现状与趋势,为提升临床检验工作的质量提供有益借鉴。
2. 2024年临床检验室间质量评价标准:2.1 背景介绍:随着医学技术的不断发展和进步,临床检验在疾病诊断和治疗中的作用愈发重要。
为了确保临床检验结果的准确性和可靠性,临床检验室间质量评价标准被广泛应用。
2024年的临床检验室间质量评价标准是根据最新的技术和实践经验制定的,旨在提高临床检验室之间结果比对与互认水平。
2.2 标准制定过程:2024年的临床检验室间质量评价标准的制定过程需要考虑到国际通行标准以及具体国家或地区自身情况。
首先,通过收集相关文献、调查现有实践和借鉴其他国家经验来确定制定标准的依据。
其次,在专家组织指导下进行多轮讨论、修改和完善,以确保标准能够覆盖各个方面并具有广泛适应性。
最后,标准还需要经过实际应用和验证,以验证其实施效果和可行性。
2.3 核心要点:2024年的临床检验室间质量评价标准的核心要点包括以下几个方面:- 质量管理系统:标准应涵盖建立和运行质量管理系统的要求,包括文件控制、内部审核、纠正预防措施等。

2017年卫生部临床检验中心室间质量评价标准临床化学(NCCL-C-01)2017年2016年钾靶值±6%靶值土0.5mmol/L钠靶值± 4%靶值± 4mmol/L氯靶值士5%靶值± 5% 钙靶值士5% 靶值士0.250mmol/L(1.0mg/dL)磷靶值土10%靶值±0.097mmol/L或靶值± 10.7% (取大者)葡萄糖靶值±7%靶值±0.33mmol/L (6mg/dL)或± 10% (取大者)尿素靶值±8%靶值±0.71mmol/L或±9% (取大者)尿酸靶值土12%靶值士17%肌酐靶值士12%靶值士26.5ummol/L(0.3mg/dL)或± 15% (取大者)总蛋白靶值土5%靶值士10% 白蛋白靶值±6%靶值±10%总胆固醇靶值±9%靶值±10% 甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值± 30%总胆红素靶值± 15%靶值±6.84mmol/L (0.4mg/dL)或±20% (取大者)丙氨酸氨基转移酶靶值±16%靶值±20%天门冬氨酸氨基转移酶靶值±15%靶值±20%碱性磷酸酶靶值± 18%靶值±30%淀粉酶靶值±15%靶值±30%肌酸激酶靶值±15%靶值±30%乳酸脱氢酶靶值±11%靶值±20%直接胆红素靶值±2s靶值±2s铁靶值±15%靶值±20%总铁结合力靶值士2s镁靶值士15%靶值士25%锂靶值土0.3mmol/L 或土20%(取大者)铜靶值± 2s锌靶值± 2s酸性磷酸酶靶值±30%Y -谷氨酰基转移酶靶值±11%靶值±20%a -羟丁酸脱氢酶靶值±30%靶值±30%胆碱酯酶靶值±20%靶值±20%脂肪酶靶值士20%靶值士20%心肌标志物肌酸激酶-MB(ug/L)靶值±30%靶值±30%肌红蛋白靶值± 30%靶值±30%肌钙蛋白-I靶值士30%靶值士30%肌钙蛋白-T靶值士30%靶值土30%肌酸激酶-MB(U/L)靶值士30%超敏CRP靶值±30%靶值±30%同型半胱氨酸靶值±2.5口mol/L 或±20%(取大者)脂类胆固醇靶值±9%靶值±10%甘油三酯靶值±14%靶值±25%高密度脂蛋白胆固醇靶值± 30%靶值±30%低密度脂蛋白胆固醇靶值±30%靶值±30%载脂蛋白A1靶值±30% 靶值±30%载脂蛋白B靶值±30%靶值±30%脂蛋白(a)靶值±30%血气分析pH靶值土0.04靶值士0.04pCO2靶值士5mmHg 或±8% (取大者)靶值±5mmHg或±8% (取大者)pO2靶值± 8%靶值土2SNa+靶值土4%靶值士4mmol/LK+靶值土6%靶值± 0.5mmol/LCa2+靶值± 5%靶值土0.25mmol/LCl-靶值土4%靶值±5%特殊蛋白IgG、IgA、IgE、IgM、C3、C4、C- 反应蛋白(CRP)、类风湿因子(RF)、抗链球菌溶血素O (ASO)、转铁蛋白(TRF)、前白蛋白(PA)靶值±25%靶值± 25%内分泌总T4靶值士20%靶值士20%叶酸靶值士30% 靶值±30%皮质醇、雌二醇、FSH、LH、孕酮、催乳素、睾酮、C-肽、FT3、TT3、FT4、胰岛素、维生素B12、25-OH-VD2、25-OH-VD3、总25-OH-VD靶值±25%靶值±25%肿瘤标志物CEA、AFP、HCG、PSA、CA199、CA125、CA153、0 2-微球蛋白、铁蛋白、总0 -HCG、游离PSA靶值±25% 全血治疗药物监测环孢霉素A、他克莫司、西罗莫司靶值土25%血清治疗药物监测卡马西平靶值± 25%地高辛靶值±20% 或±0.2口g/L苯妥英靶值±25%茶碱靶值±25%丙戊酸靶值±25%糖化血红蛋白HbA1c靶值±8%脑钠肽/N末端前脑钠肽BNP、NT-proBNP靶值士30% 尿液定量生化钾靶值± 29%钠靶值±26%氯靶值±26% 钙靶值±31% 镁靶值±25% 磷靶值±23%葡萄糖靶值±20%尿素靶值±21%尿酸靶值±24%总蛋白靶值±44%白蛋白靶值±30%淀粉酶靶值±30%微量白蛋白靶值±30%半胱氨酸蛋白酶抑制剂C半胱氨酸蛋白酶抑制剂C靶值土25%代谢物、总蛋白正确度验证葡萄糖靶值± 3.5%尿素靶值±4.0%尿酸靶值±6%肌酐靶值±6%总蛋白靶值±2.8%脂类正确度验证总胆固醇靶值± 4.5%甘油三酯靶值±7.5%高密度脂蛋白胆固醇靶值± 6.5%酶学正确度验证ALT (含磷酸吡哆醛)靶值士6%AST (含磷酸吡哆醛)靶值士5%LDH靶值±4%CK 靶值±5.5%AMY 靶值±7.5%ALP 靶值±10%糖化血红蛋白正确度验证HbA1c靶值±6%电解质正确度验证钠靶值± 1.5%钾靶值±2%钙靶值±2%镁靶值±5.5%一般免疫学抗核抗体反应性或阴性抗-HIV反应性或阴性肝炎(HBsAg,anti-HBc,HBeAg )反应性或阴性风疹反应性或阴性全血细胞计数白细胞计数靶值± 15%红细胞计数靶值±6%血红蛋白测定靶值± 6%血细胞比容靶值±9%血小板计数靶值±20%MCH靶值±7%MCHC 靶值±8%凝血试验PT靶值±15%INR 靶值±20%APTT 靶值±15%Fbg 靶值±20%尿液化学分析比重靶值± 1等级PH靶值±1等级蛋白、葡萄糖、胆红素、酮体、红细胞、尿胆原、白细胞阳性时:靶值±1等级亚硝酸盐阴性或阳性红细胞沉降率测定红细胞沉降率靶值土3.0 (W10时)或靶值±30% (〉10 时)流式细胞分析CD3+、CD3+CD4+、CD3+CD8+、CD3-CD16+CD56+、CD3-CD19+ 靶值±2s血液粘度检测切变率为1/S下的粘度(mPa.s)靶值±2s切变率为50/S下的粘度(mPa.s)靶值±2s切变率为200/S下的粘度(mPa.s)靶值±2s网织红细胞计数网织红细胞百分比(%)靶值±2s全血细胞计数正确度验证白细胞计数靶值± 15%红细胞计数靶值±6%血红蛋白测定靶值± 6%血细胞比容靶值±9%血小板计数靶值±20%MCV靶值±7%MCH靶值±7%MCHC 靶值±8%凝血因子检测FWI、FI X靶值±30%D-二聚体检测D-Dimer靶值±2s新生儿遗传代谢病筛查-Phe、TSH苯丙氨酸靶值土30% 或±1mg/dL (取大值)促甲状腺素靶值±30%中孕期母血清产前筛查AFP靶值±30% 或±5口g/L (取大值)hCG 靶值±30%B -hCG 靶值士30%Free-B -hCG 靶值±30%游离雌三醇靶值±30%血铅血铅靶值±40口g/L或±10% (取大值)便携式血糖检测仪葡萄糖靶值土20% 或±1mmol/L (取大值)脑脊液生化白蛋白靶值±10% 或±0.1g/L (取大值)总蛋白靶值±10% 或±0.1g/L (取大值)氯化物靶值±5%葡萄糖靶值±10% 或±1.0mmol/L (取大值)乳酸脱氢酶靶值±20%IgA 靶值±25%IgG 靶值±25%IgM 靶值±25%乳酸靶值±20% 或±0.1mmol/L (取大值)全血五元素铜靶值± 2s锌靶值± 2s钙靶值± 0.25mmol/L镁靶值±25%铁靶值±20%新生儿遗传代谢病筛查-G6PDG6PD靶值±30%新生儿遗传代谢病筛查-17羟孕酮17-羟孕酮靶值±30% 新生儿遗传代谢病串联质谱筛查-氨基酸和酰基肉碱瓜氨酸靶值±25%亮氨酸靶值±25%甲硫氨酸靶值±25%苯丙氨酸靶值± 25%酪氨酸靶值±25%缬氨酸靶值±25%游离肉碱靶值± 30%丙酰肉碱靶值±30%异戊酰肉碱靶值±30%辛酰肉碱靶值±30%月桂酰肉碱靶值±30%棕榈酰肉碱靶值±30%十八碳酰肉碱靶值±30%血红蛋白A2和血红蛋白F血红蛋白A2靶值±20%血红蛋白F靶值±20%早孕期母血清产前筛查PAPP-A(|J g/L)靶值±30% PAPP-A(mU/L)靶值±30%Free-B -HCG⑴ g/L)靶值±30%Free-B -HCG(mIU/mL)靶值±30%。

临床检验15个质量控制指标反映标本采集量就是否正确,就是检验前得重要质量指标。
标本采集量不足或过多都可能影响检验结果。
标本类型错误率中明确规定,是分析采集标本类型不符合要求的标本比例,其计算公式为:标本类型错误率=类型不符合要求的标本数/标本总数×100%。
标本容器错误率中明确规定,是分析采集容器不符合要求的标本比例,其计算公式为:标本容器错误率=采集容器错误的标本数/标本总数×100%。
单从字面意思不难理解这两个指标,但是在实际的操作过程中难免会心生疑问,如果一个大便杯里面装有尿液是归为标本类型错误还是标本容器错误?这就取决于申请的项目,如果申请的项目为大便常规,则归为标本类型错误。
如果申请项目为尿液培养,则归为标本容器错误。
那么我们再举几个例子:如果一个装有尿液的紫头管送检血常规,则归为标本类型错误;如果一个装有大便的无菌杯送检尿培养,则同样归为标本类型错误;如果一个装有血液的红头管送检血常规,则归为标本容器错误;如果一个装有尿液的常规尿杯送检尿培养,则归为标本容器错误。
在这里值得一提的是“标本总数”包括所有类型的标本总数,而不单指某一种类型的标本。
在临床实践过程中如果存在标本类型和检测项目不一致,且对检测结果没有影响的情况,则应视为标本合格。
例如,尿杯里面采集的大便送检大便常规则应视为标本合格。
通过以上的思考和分析对标本类型错误和标本容器错误这两个指标有了更清晰的认识。
探讨2:如何清晰界定标本采集量错误和抗凝标本凝集?标本采集量错误率是分析的标本体积,其计算公式为:标本采集量错误率=量不足或过多(抗凝标本)的标本数/标本总数×100%。
抗凝标本凝集率是分析需要抗凝标本的凝集情况,其计算公式为:抗凝标本凝集率=凝集的标本数/需抗凝标本总数×100%。
似乎这两个指标是完全独立的,当然在大多数情况下都可以明确界定。
假设一个送检红头管的生化项目,由于检测项目多,标本量采集不够,那么这肯定是标本采集量错误。

附件二2019年临床检验医疗质量控制指标室间质量评价上报表一、医院和实验室基本信息1.实验室所在机构性质?A 公立(继续第2题,跳过第3题)B 私立(跳过第2题,继续第3题)2.若选公立,则您实验室所在机构等级及类型?A 三甲综合B三甲专科 C 三乙综合 D 三乙专科 E 二甲综合 F 二甲专科G 二乙综合H 二乙专科I 二级以下医院J 其他3.若选私立,则您实验室所在机构等级及类型?A民营医院B独立实验室C体检中心D门诊部E其他4.实验室所在医院床位数?A 0-500B 501-1000C 1001-1500D 1501-2000E 2000以上5.实验室所在医院是否有LIS(实验室信息系统)和HIS(医院信息系统)?A有LIS和HIS B有LIS,无HIS C无LIS,有HIS D无LIS和HISLIS系统厂商为:,该厂商联系人,联系电话HIS系统厂商为:6.实验室所在医院日均门诊量?()人次7.实验室建筑面积?m28.实验室所有仪器设备总值?万元9.医院年业务额?万元/年;实验室年业务额?万元/年10.本实验室目前为止已开展检验项目总数(不包括外送)项其中:自动化仪器检测项目数?项手工检测项目数?项各专业检验项目数:临检项,占总业务额百分比%生化项,占总业务额百分比%免疫项,占总业务额百分比%微生物项,占总业务额百分比%基因扩增项,占总业务额百分比%其他项,占总业务额百分比%本实验室外送项目项11.科室人员组成实验室负责人:性别年龄学位学历职称已任职时间年实验室总人数二、检验全过程质量指标您实验室LIS是否纳入质量指标相关数据采集与统计:□是□否注意事项:如您实验室无某条目项目数据,请填写“未统计”,如数据为0,请填写数字“0”1. 月度指标2.年度指标(仅用于第1次调查)(六)本年度因分析设备故障导致检验报告延迟的次数:次三、新增检验全过程质量指标(选填项)1. 月度指标2. 年度指标(仅用于第1次调查)。

临床用血质量控制指标(2019年版)一、每千单位用血输血专业技术人员数定义:输血科(血库)专职专业技术人员数与医疗机构年度每千单位用血数之比。
医疗机构年度用血总单位数指医疗机构一年时间使用全血、红细胞成分和血浆的总单位数。
计算公式:每千单位用血输血专业技术人员数=位数/1000医疗机构年度用血总单业技术人员数输血科(血库)专职专意义:反映临床用血服务能力的指标。
评价输血专业技术人员配备是否与医疗机构功能、任务和规模等相适应。
二、《临床输血申请单》合格率定义:填写规范且符合用血条件的《临床输血申请单》数量占同期输血科(血库)接收的《临床输血申请单》总数的百分比。
计算公式:《临床输血申请单》合格率=收的申请单总数同期输血科(血库)接件的申请单数填写规范且符合用血条×100%意义:反映《临床输血申请单》填写及输血前评估的规范程度,体现医疗机构临床用血管理水平。
三、受血者标本血型复查率定义:是指输血科(血库)对受血者血液标本复查血型的数量占同期接收受血者血液标本总数的百分比。
计算公式:受血者标本血型复查率=标本总数同期接收的受血者血液型数受血者血液标本复查血×100%意义:是评价输血申请过程中是否规范开展受血者血液标本采集和检测的指标。
四、输血相容性检测项目室内质控率定义:开展室内质控的输血相容性检测项目数占医疗机构开展的输血相容性检测项目总数的百分比。
计算公式:输血相容性检测项目室内质控率=容性检测项目总数医疗机构开展的输血相容性检测项目数开展室内质控的输血相×100%意义:反映输血相容性检测项目室内质控的覆盖程度,是体现输血相容性检测日常质量管理的指标。
五、输血相容性检测室间质评项目参加率定义:参加室间质评的输血相容性检测项目数占所参加的室间质评机构输血相容性检测室间质评项目总数的百分比。
计算公式:输血相容性检测室间质评项目参加率=评项目总数输血相容性检测室间质所参加的室间质评机构容性检测项目数参加室间质评的输血相×100%意义:反映医疗机构开展输血相容性检测和参加输血相容性检测外部质量评价的情况,是体现输血相容性检测能力的重要指标。

一、急性肺血栓栓塞症指标一、急性肺血栓栓塞症(PTE)患者确诊检查比例(RES-PTE-01)单位时间内,出院诊断为急性 PTE 患者行确诊检查的人数与同期急性 PTE 患者总数的比值。
急性PTE 患者确诊检查比例=急性PTE 患者行确诊检查人数×100同期急性PTE 患者总数确诊检查对急性 PTE 的诊断具有重要意义,是确诊急性 PTE 不可或者缺的条件。
急性 PTE 确诊检查包括: CT 肺动脉造影或者放射性核素肺通气灌注扫描或者磁共振肺动脉造影或者肺动脉造影中任一项。
指标二、急性 PTE 患者行深静脉血栓相关检查比例(RES- PTE-02)单位时间内,急性 PTE 患者行深静脉血栓相关检查的人数与同期急性 PTE 患者总数的比值。
急性 PTE 患者行深静脉血栓相关检查比例=急性PTE 患者行深静脉血栓相关检查人数×100同期急性PTE 患者总数深静脉血栓相关检查对急性PTE 诊断及选择治疗方案具有重要意义。
急性 PTE 患者行深静脉血栓相关检查包括:静脉超声、CT 静脉造影、放射性核素静脉显象、磁共振静脉造影、静脉造影中任一项。
指标三、急性 PTE 患者行危(wei)险分层相关检查比例(RES- PTE-03)单位时间内,急性 PTE 患者行危(wei)险分层相关检查的人数与同期急性 PTE 患者总数的比值。
急性 PTE 患者行危(wei)险分层相关检查比例=急性PTE 患者行危(wei)险分层相关检查人数×100同期急性PTE 患者总数急性 PTE 危(wei)险分层是确诊后制定治疗方案的前提,具有重要指导意义。
危(wei)险分层相关检查包括影像学检查和心脏生物学标志物检查。
其中影像学检查包括超声心动图或者 CT 肺动脉造影检查;心脏生物学标志物包括 BNP/NT-proBNP、肌钙蛋白。
肺血栓栓塞症危(wei )险分层注:a :右心功能不全(RVD)的诊断标准:影像学证据包括超声心动图或者 CT 提示 RVD , 超声检查符合下述 2 项指标即可诊断RVD:(1)右心室扩张 (右心室舒张末期内径 /左心室舒张末期内径>1.0 或者 0.9);(2)右心室前壁运动幅度减低(<5mm) ;(3)吸 气时下腔静脉不萎陷; (4)三尖瓣反流速度增快;估测三尖瓣反流压>30mmHg 。

卫生部关于印发?医疗机构临床实验室管理方法?的通知公布单位:卫生部卫医发〔2006〕73号各省、自治区、直辖市卫生厅局,某某生产建设兵团卫生局:为加强医疗机构临床实验室管理,提高临床检验水平,保证医疗质量和医疗平安,我部组织制定了?医疗机构临床实验室管理方法?。
现印发给你们,请遵照执行。
二○○六年二月二十七日抄送:国家中医药管理局,总后卫生部,卫生部临床检验中心。
医疗机构临床实验室管理方法第一章总如此第一条为加强对医疗机构临床实验室的管理,提高临床检验水平,保证医疗质量和医疗平安,根据?执业医师法?、?医疗机构管理条例?和?病原微生物实验室生物平安管理条例?等有关法律、法规制定本方法。
第二条本方法所称医疗机构临床实验室是指对取自人体的各种标本进展生物学、微生物学、免疫学、化学、血液免疫学、血液学、生物物理学、细胞学等检验,并为临床提供医学检验效劳的实验室。
第三条开展临床检验工作的医疗机构适用本方法。
第四条卫生部负责全国医疗机构临床实验室的监视管理工作。
县级以上地方卫生行政部门负责辖区内医疗机构临床实验室的监视管理工作。
第五条医疗机构应当加强临床实验室建设和管理,标准临床实验室执业行为,保证临床实验室按照平安、准确、及时、有效、经济、便民和保护患者隐私的原如此开展临床检验工作。
第二章医疗机构临床实验室管理的一般规定第六条卫生行政部门在核准医疗机构的医学检验科诊疗科目登记时,应当明确医学检验科下设专业。
医疗机构应当按照卫生行政部门核准登记的医学检验科下设专业诊疗科目设定临床检验工程,提供临床检验效劳。
新增医学检验科下设专业或超出已登记的专业范围开展临床检验工程,应当按照?医疗机构管理条例?的有关规定办理变更登记手续。
第七条医疗机构临床实验室提供的临床检验效劳应当满足临床工作的需要。
第八条医疗机构应当保证临床检验工作客观、公正,不受任何部门、经济利益等影响。
第九条医疗机构临床实验室应当集中设置,统一管理,资源共享。
国家卫生健康委办公厅关于进一步加强医疗机构感染预防与控制工作的通知文章属性•【制定机关】国家卫生健康委员会•【公布日期】2019.05.18•【文号】国卫办医函〔2019〕480号•【施行日期】2019.05.18•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗机构与医师正文国家卫生健康委办公厅关于进一步加强医疗机构感染预防与控制工作的通知国卫办医函〔2019〕480号各省、自治区、直辖市及新疆生产建设兵团卫生健康委:为进一步加强医疗机构感染预防与控制(以下简称感控)工作,提高医疗质量,保障医疗安全,维护人民群众身体健康与生命安全,针对当前存在的薄弱环节,提出以下工作要求:一、进一步提高对感控工作重要性的认识做好感控工作是保障医疗质量和医疗安全的底线要求,是医疗机构开展诊疗活动中必须履行的基本职责。
地方各级卫生健康行政部门和各级各类医疗机构要以高度的责任感和敏感性,提高政治站位,树立底线意识,重视并做好感控工作。
要严格落实相关法律法规、规章制度及技术标准,采取有力有效措施,提高感染性疾病诊疗防控能力,预防和控制感染性疾病传播,杜绝医源性感染发生,防范化解感染暴发风险,以对人民健康高度负责的态度,切实加强感控管理,为人民群众提供安全、高质量的医疗服务。
二、强化责任意识,落实感控制度要求地方各级卫生健康行政部门和各级各类医疗机构要履行主体责任,法定代表人或主要负责人是感控工作的第一责任人。
医疗机构要切实发挥本机构感控委员会的作用,明确感控管理部门、医务、药学、护理、临床检验以及各临床科室的职责分工,压实部门责任,并建立多学科、多部门协作机制,形成合力共同开展感控工作。
要认真学习贯彻《医疗机构感染预防与控制基本制度(试行)》(见附件),根据本机构实际情况,细化具体制度措施,加强全过程管理。
医疗机构要加强感控人才队伍建设,确保感控专(兼)职人员配备充足,感控队伍专业结构合理,健全感控人员职业发展路径和激励机制,加大投入倾斜力度,保持感控队伍的稳定性。
卫生部临床检验中心关于2018 年全国临床检验医疗质量控制指标第1次室间质量评价回报结果说明本次调查共包括47个质量指标,覆盖检验全过程的各个阶段,其中15项为卫计委发布的质量指标,自2015年开始纳入调查,标本溶血率、标本丢失率和分析设备故障数为2017年纳入调查指标,其余29项为2018年新增调查的质量指标。
其中标本类型错误率、标本容器错误率、标本采集量错误率、抗凝标本凝集率、标本溶血率、标本丢失率、检验报告不正确率、危急值通报率、危急值通报及时率、检验前周转时间、实验室内周转时间;申请单标识错误率、实验室人员申请单抄录错误率、非实验室人员申请单抄录错误率、门诊检验申请单无临床问题率、门诊检验申请单无法辨识率、住院检验申请单无法辨识率、门诊检验申请单不适当率、住院检验申请单不适当率、标本标识错误率、标本检验前储存不适当率、标本运输途中损坏率、标本运输温度不适当率、标本运输时间过长率、标本采集时间不正确率、实验室人员导致的标本重新采集率、非实验室人员导致的标本重新采集率、信息系统录入结果错误率、手工抄写结果错误率、检验结果纠正率、检验报告发送超时率、解释性注释有效率这32个指标按照生化、免疫、临检、微生物四个专业分别进行统计;其他不分专业的年度指标以及具体项目的周转时间分别单独进行统计。
除此之外,基于2017的调查数据,制定了质量指标初步质量规范。
因此,本次成绩回报表包括七个文件:(1)2018年第1次临床检验医疗质量控制指标室间质评报告(生化专业)(2)2018年第1次临床检验医疗质量控制指标室间质评报告(免疫专业)(3)2018年第1次临床检验医疗质量控制指标室间质评报告(临检专业)(4)2018年第1次临床检验医疗质量控制指标室间质评报告(微生物专业)(5)2018年第1次临床检验医疗质量控制指标室间质评报告(年度指标)(6)2018年第1次临床检验医疗质量控制指标室间质评报告(具体项目周转时间)(7)2018年全国临床检验质量指标初步质量规范一、以率表示的质量指标的评价鉴于大部分质量指标的发生率较低,为便于清晰比较,统一采用西格玛度量(σ)的方式进行评价。
㊃医疗质量与安全㊃2017 2019年全国临床检验中心室间质量评价结果分析沈㊀锋,寇㊀红∗,谯延娥(陕西省安康市中心医院检验科,安康㊀725000)[摘㊀要]㊀目的㊀对安康市中心医院2017 2019年参加全国临床检验中心室间质量评价结果进行总结分析,探讨临床实验室检测的准确性和可比性,持续提高临床实验室检测能力和质量管理水平㊂方法㊀依据全国临床检验中心室间质量评价活动安排,对各个参评项目使用常规检测方法在规定时间内完成检测工作,并通过网络形式报告检测结果,及时对回报结果进行总结分析㊂结果㊀该院检验科参加全国室间质量评价总成绩合格,各个专业室间质量评价成绩为满意,年度总成绩性能评价均为成功㊂临床化学㊁免疫学㊁微生物学专业中个别项目均存在不合格现象㊂显微镜形态学检查正确率低,2017年血细胞㊁尿沉渣和寄生虫形态学检查室间质评符合率分别为73%㊁93%和67%,2018 2019年,形态学结果较为理想㊂结论㊀通过室间质量评价结果反馈,在检测项目校准问题㊁试剂批间差异㊁设备功能障碍以及结果上报方面存在不足㊂显微镜形态学检查,须结合整个视野有形成分形态学特点综合分析,对细胞典型特征的质和量进行全面评估,减少误判㊂微生物鉴定室间质量评价标本的检测,可积累临床少见的疑难细菌鉴定经验,及时发现和总结不足之处㊂同时室间质量评价作为一种教育工具,强化基础知识㊁重视基本技能培训,制定行之有效的改进措施,建立完善的适合自身的质量管理体系,将质量控制工作贯穿实验全过程㊂[关键词]㊀质量管理;室间质量评价;实验室能力验证DOI:10.16770/J.cnki.1008-9985.2021.03.003[中图分类号]㊀R197.32㊀㊀㊀[文献标识码]㊀A㊀㊀㊀[文章编号]㊀1008-9985(2021)03-0210-04[作者简介]㊀沈㊀锋,男,副主任技师;电话:0915-3284181[通信作者]㊀寇㊀红,电话:0915-3182545AnalysisofExternalQualityAssessmentResultsofNationalClinicalLaboratoryfrom2017to2019SHENFeng,KOUHong∗,QIAOYane(DepartmentofClinicalLaboratory,AnkangCentralHospitalofShaanxiProvince,Ankang㊀725000)[Abstract]㊀Objective㊀Todiscusstheaccuracyandcomparabilityoftheresultsfromtheclinicallaboratoryandimprovethedetectivelevelandqualitymanagementcontinuouslybysummarizingandanalyzingtheexternalqual⁃ityassessmentresultsoftheNationalClinicalLaboratoryintheyearsfrom2017to2019.Methods㊀Accordingtoar⁃rangementfortheexternalqualityassessmentactivitiesoftheNationalClinicalLaboratory,alltheprojectswerere⁃quiredtobeevaluatedbytheroutinetestmethodinthelimitedtime.Thetestworkwascompletedandthetestresultswerereportedvianetwork,andtheresultsweresummarizedandanalyzedintime.Results㊀TheperformanceofthelaboratoryofAnKangCentralHospitalwassatisfactoryintheNationalExternalQualityAssessment.Theresultsofeachspecializeddepartmentallmettherequirements.Individualsub-itemsoftheClinicalChemistry,Immunology,Microbiologyexaminationsstillhadsomeunqualifiedprojects.Theaccuracyofmicroscopicmorphlogyexminationwaslow.Thecoincidencerateofbloodcell,urinarysedimentandparasitemorphologicalexternalqualityassessmentre⁃spectivelywas73%to93%and67%in2017.However,theresultsofmorphologicalexaminationwereidealin2018and2019.Conclusion㊀Accordingtothefeedbackoftheresultsoftheexternalqualityassessment,thereweresomedeficienciesinthecalibrationofthetestsystem,thedifferencesamongreagentbatches,theperformanceobstaclesofequipmentandthereportoftheresults.Inordertoreducemiscalculation,itisnecessarytoevaluatethequalityandquantityofthetypicalcellcharacteristicsincombinationwiththemorphologicalcharacteristicsofthewholevisualfield.Thequalityassessmentforsamplesthroughmicrobiologicalidentificationcanaccumulatetherareclinicalexpe⁃rienceofdifficultbacteriaidentification,andfindandsummarizethedeficienciesintime.Atthesametime,asakindofeducationaltool,thequalityevaluationintheroomstrengthensthebasicknowledge,attachesimportancetothebasicskilltraining,formulatestheeffectiveimprovementmeasures,establishestheperfectqualitymanagementsystemsuitableforitself,andmakesthequalitycontrolworkthroughoutthewholeexperimentprocess.[Keywords]㊀qualitymanagement;externalqualityassessment;laboratoryproficiencytestingHospAdminJChinPLA,2021,28(3):210-213.㊀㊀检验质量是检验科的立足之本,要达到精准检验的预期要求,必须通过一系列技术手段和活动来确保临床实验室的质量㊂在临床实验室全面质量管理体系中,检验中质量控制主要通过室内质量控制(Internalqualitycontrol,IQC)和室间质量评价(externalqualityassess⁃ment,EQA)的实施来确保检测质量要求㊂室内质量控制是为了确保检测完全达到要求在实验室内部进行的操作和活动,主要监测实验室的精密度和有效性,保证日常检测工作的连续性和稳定性;而室间质量评价也称能力验证(proficiecytesting,PT)是监测各实验室之间结果的准确性,连续客观地评价实验室的检测结果,发现系统误差并进行校正,使各实验室之间的结果具有可比性㊂二者在实验室质量保证中相互依存㊁缺一不可㊂室间质量评价作为临床实验室管理体系重要的组成部分,是多数国家临床实验室行政管理和实验室认可的基本要求[1],也是中国合格评定国家认可委员会(CNAS.CL02)‘医学实验室质量和能力认可准则“(ISO15189:2012)临床实验室认可的要件[2]㊂为了解安康市中心医院临床实验室整体检测能力,现将该院检验科2017 2019年参加全国临床检验中心室间质量评价结果进行回顾性分析,寻找检测过程误差产生原因,及时制定应对方案,持续提高检测质量,为临床提供及时准确实验数据㊂1㊀资料与方法1.1㊀样本来源㊀室间质量评价样本由全国临床检验中心提供,参加项目包括:临床生物化学㊁临床基础检验㊁临床免疫学㊁临床分子生物学㊁临床微生物学五大专业,共24个子项目㊂每次每个检测子项目均为5件样本㊂1.2㊀质评物检测㊀按照质评说明书规定的时间和检测要求,使用该实验室常规检测样本的方法,完成室间质评的检测工作,并通过网络上报结果,及时查看回报结果㊂2㊀评价方法按照国家卫健委临床检验中心室间质量评价(EQA)的统一要求,使用PT得分评价方法,参照美国CLIA 88PT评价方法㊂单个测定值评价:测定值落在上下限内为可接受结果,否则为不可接受结果;单次质评:针对某一项目PT得分(%)计算方法是该项目的可接受结果数/该项目的总测定次数ˑ100%㊂PTȡ80%为当前性能满意;总评:连续三次为满意,则累积性能为成功;连续两次为不满意或连续三次中有两次为不满意则为不成功㊂3㊀结㊀果3.1㊀PT评分项目室间质评成绩㊀2017 2019年安康市中心医院检验科的室间质量评价总成绩较为理想,个别子项目存在不满意的成绩,主要集中在临床化学中脑脊液生化检测和临床微生物中鉴定项目结果各出现一次PT得分<80%,其它项目检测结果显示PT得分90%以上㊂每个专业室间质量评价年度总成绩性能评价均为成功(表1)㊂表1㊀2017 2019年国家卫健委临床检验中心室间质量评价能力验证(PT得分)结果(分)项㊀目2017年第1次第2次第3次2018年第1次第2次第3次2019年第1次第2次第3次常规化学9298999710098909891干化学99100991001001009899100半胱氨酸蛋白抑制剂C100--100--100--血气酸碱分析100100-100100971009797脑钠肽/N末端前脑钠肽100--100--100--半胱氨酸蛋白酶抑制剂C100--100--100--降钙素原检测100100-100100-100100-脑脊液生化检测---68--95--全血细胞计数100100-100100-100100-血沉100--100--100--尿液化学分析100100-100100-100100-网织红细胞计数100--100--100--血凝100100-100100-100100-感染性疾病血清学标志物系列A9710010097100-100100-感染性疾病血清学标志物系列B100100-100100-100100-感染性疾病血清学标志物系列C93100100100100-100100-抗环瓜氨酸肽(抗-CCP)抗体100100-100100-100100-抗核抗体100100-100100-100100-PCR-EBV100100-100100-100100-HBV-DNA100100-100100-100100-HCV-DNA100100-100100-100100-微生物学(高级)鉴定6010010010010090100100100微生物学药敏80100100100100100150140120抗酸染色100--100--100--注:PCR-EBV表示EB病毒核酸检测;HBV-DNA表示乙型肝炎病毒核酸检测;HCV-DNA表示乙型肝炎病毒核酸检测;-表示全国临床检验中心该次无计划㊂3.2㊀显微镜形态学检查质评结果㊀2017年进行血细胞形态学检查㊁尿沉渣形态学和寄生虫学检查,其中,血细胞形态学检查共30幅图片,正确辨认22幅,正确率为73.33%;尿沉渣15幅图片,14幅辨认正确,正确率为93.33%;寄生虫检查15幅图片,正确辨认10幅,正确率为66.67%㊂2018年和2019年血细胞形态学检查和尿沉渣形态学检查全部辨认正确㊂2018年,寄生虫检查15幅图片,正确辨认13幅,正确率为86.67%;2019年寄生虫检查15幅图片,正确辨认14幅,正确率为93.33%㊂3.3㊀2017 2019年室间质评失控指标㊀3年室间质评失控指标主要集中在临床化学㊁免疫学㊁微生物学及形态学检查个别检测指标㊂定量项目PT得分ɤ80%的指标:常规化学中,2017年第一次天门冬氨酸氨基转移酶和直接胆红素,2018年第一次钙和果糖胺;2019年第一次钾和氯;2019年第二次总胆红素;2019年第三次钙㊁总蛋白和直接胆红素测定;2018年脑脊液生化中清蛋白㊁氯化物㊁IgA和IgM等指标失控㊂免疫学检测中,梅毒抗体(非特异性)发生2次将正确结果为R检测显示为N的情况,HBeAb出现两次失控㊂微生物学检验在2017年将201704和201705号结果相互混淆㊂2018年中201801鉴定结果属于菌种间属内鉴定错误(表2)㊂表2㊀2017 2019年全国临床检验中心形态学检查错误结果项㊀目本室上报结果回报正确结果本室上报结果回报正确结果血细胞形态巨(中性)杆状核粒细胞都勒小体(Dohlebody)未成熟嗜碱性粒细胞嗜碱性粒细胞异型淋巴细胞淋巴细胞戈谢细胞巨核细胞转移性肿瘤细胞成骨细胞中幼红细胞浆细胞早幼红细胞类/巨幼变幼红细胞尿沉渣形态肾小管上皮细胞移行上皮细胞(底层)寄生虫学㊀布氏姜片虫(虫卵)肺吸虫(虫卵)旅毛虫马来微丝幼阴道毛滴虫蓝氏贾弟鞭毛功滋养体肝片形吸虫华支睾吸虫溶组织阿米巴包囊结肠阿米巴包囊绦虫(早卵)蛔虫(虫卵)猪肉绦虫头节猪肉绦虫孕节杜氏利什曼原虫弓形虫4㊀讨㊀论室间质量评价(EQA)作为一种质量控制工具和持续改进的工作手段被广泛用于临床检验中,是提升和保证临床检验质量的必经途径㊂同时,EQA作为一种教育工具,对室内质控也有一定的促进作用,可通过结果信息资料㊁注释㊁质评经验总结等获取新知识,分享相关信息,使实验室受益匪浅,提升临床实验室整体检测水平,有效评价实验室之间检验结果的可比性,为检测结果互认工作增加可信度㊂通过参加EQA了解临床实验室检验工作中存在的问题,采取行之有效的对策,持续提高临床检验质量水平㊂4.1㊀2017 2019年EQA结果小结㊀安康市中心医院是一所三级甲等综合医院,随着实验室新项目开展,参加全国室间质量评价项目逐年增多,基本涵盖临床开展所有检验项目,与全国其他三级医院参加项目量相当[3]㊂室间质评结果较为理想,成绩基本稳定,达到卫生行业标准(GB/T20470-2006)的质量要求[4],所参加评分项目总成绩能够达到全国临床检验中心合格标准㊂在临床化学㊁感染性标志物㊁临床微生物学㊁显微镜形态学等亚专业中的个别项目偶尔有不合格现象,体现该实验室检测系统随机误差时有发生㊂目前室间质评组织者缺乏对参评单位检测过程进行实时监控,检测者在检测时将室间质评标本当作一份特殊的样本对待,在经过特定校准的仪器上进行检测,其结果又经过处理,容易掩盖实验室检测的真实水平,导致室间质评结果只能作为实验室管理的参考条件㊂为了呈现质评结果真实准确性,现场盲检法可增加EQA的可靠性和科学性㊂4.2㊀EQA不合格项目原因分析以及处理对策㊀2017 2019年EQA失分项目主要集中在临床化学㊁感染性标志物㊁临床微生物学㊁显微镜形态学四个方面㊂常规化学失控原因主要由系统误差引起,失分较多的项目是直接胆红素测定,本室采用钒酸盐氧化法检测直接胆红素,由于直接胆红素见光分解,定标液分解后胆红素变胆绿素,使得检测偏高,重新处理定标液定标后结果在控制范围内;2019年,第一次总胆红素测定偏倚减低,可能与标本复溶后放置时间过长,水中氧气使胆红素氧化浓度减低有关[5];钙失控由于试剂批次间差异引起误差,新旧试剂混用导致结果偏离;钾和氯离子由于电极老化造成失控;果糖胺和总蛋白由于EQA上报时选择仪器㊁试剂分组错误㊂对于脑脊液生化检测,本室脑脊液标本常规只检测葡萄糖㊁总蛋白和氯化物,而未检测清蛋白㊁IgA和IgM等特殊项目,这类项目在脑脊液中含量显著低于血清中,按照血清的方法检测,属于方法学错误,在2019年检测时调整定标液浓度后,调整仪器参数进行检测,回报结果满意,PT得分为95%㊂其他定量项目结果虽然都在允许偏倚范围,但有部分检测指标仍出现批量正偏倚或均出现负偏倚现象,例如2017年第一次五个批号氯测定均出现负偏倚和钙离子均出现正偏倚,这种现象易见,说明检测系统可能存在系统误差,据文献研究,出现这类结果应用Z比分数进行评价,能够及时准确发现问题[6];另一可能原因,在2017年初,使用新检测系统(西门子2400分析系统),工作人员初次接触该仪器,缺乏使用经验,仪器参数设置不当,在试剂批号更换时忽略校准环节,溶解复合校准物混匀方法不当易出现系统误差,造成某些生化指标结果不稳定㊂免疫学检验中感染性疾病血清学标志物系列A的HBeAb出现两次测试不合格,感染性疾病血清学标志物系列C中,梅毒抗体(非特异)有一个测试不合格,这与其他医院出现错误项目相当[7],由于检测者对结果判读不当,质评物为临界水平,仪器检测灵敏度易出现偏差,导致这些项目易出现假阴性或假阳性,免疫学诊断往往在临床上起决定作用,建议在以后的工作中对于处于临界水平的标本应采取多人核查方法,必要时使用不同检测系统进行复检,减少误诊和漏诊㊂2017年,微生物检测细菌鉴定部分,由于操作者责任心不强将检测结果混淆造成误报㊂2018年,第一次误将溶血嗜血杆菌鉴定为流感嗜血杆菌,由于实验室卫星试验操作不当导致细菌种间属内鉴定错误,在日常检测中加强这些特殊试验的实验室内质控工作显得尤为重要,通过微生物鉴定室间质评标本的检测,还可以积累临床少见的疑难细菌鉴定经验㊂显微镜形态学检查是薄弱环节,2017年,血细胞㊁尿沉渣和寄生虫形态学检查室间质评符合率分别为73%㊁93%和67%,低于其他医院水平[8]㊂形态学检验要求检验人员有扎实的理论功底并刻苦钻研积累经验,显微镜形态学检查,须结合整个视野有形成分形态学特点综合分析,对细胞特征的质和量进行全面评估,减少误判才能切实解决形态学检验工作中的疑难问题㊂随着自动化仪器普及,检测者过于依赖仪器,忽视形态学检查的必要性,而造成漏诊和误诊现象时有发生㊂近年来,业内越来越重视形态学,已成为一个热门话题,在临床诊疗中占据举足轻重地位,为了解决形态学检测短板,通过各类培训㊁外出进修和定期考核等途径,弥补不足,同时将质控图片制作成示教材料对日常工作指导和作为实习进修人员的参考资料㊂综上所述,本院参加全国室间质评取得一定成绩,但也暴露诸多缺陷,检测过程出现校准问题㊁试剂批次间差异引起不准确以及设备功能障碍,检测者基本功欠缺等㊂对室间质评中存在不足,认真分析原因,应从人㊁机㊁料㊁法㊁环 五方面查找原因,拟定整改措施㊂日常工作中从以下几个方面进行总结改进:每月召开一次质量管理总结会,探讨本月工作中新亮点,对存在问题集思广益寻找解决对策,优化工作质量;新购置仪器做到从理论到实践全面培训,使每个人都能独立熟练操作,把好质量关;对新进人员强化基础知识㊁重视基本技能培训㊂逐步建立健全临床实验室质量管理体系,提高实验室检测水平,保证室间质评成绩准确性及可比性,为临床提供准确的检测结果奠定基础㊂ʌ参考文献ɔ[1]㊀IntemationStandardsOrgnization.Medicallaboratories-Require⁃mentsforqualityandcompetence[S].Geneva:IntemationStandardsOrgnizationISO,2012.[2]㊀杨惠,王成彬.临床实验室管理[M].北京:人民卫生出版社,2015:174-177.[3]㊀何法霖,王薇,钟堃,等.全国临床检验中心室间质量评价能力调查[J].中国医院管理杂志,2015,31(10):788-790.[4]㊀卫生部临床检验标准专业委员会.GB/T20470-2006)临床实验室室间质量评价要求[S].北京:中国标准出版社,2006.[5]㊀RehakNN,CeccoSA,HortinGL.Photolysisofbilirubininserum⁃specimensexposedtoroomlighting[J].ClinChimActa,2008,387(2):181-183.[6]㊀吴宗勇,刘秋颖,李佳,等.Z分数质控图在室间质量评价报告总结中的应用[J].检验医学与临床,2018,15(9):1239-1244.[7]㊀张成磊,祝茜,黄勇翔,等.临床实验室免疫组室间质评结果回顾[J].检验医学与临床,2016,13(1):96-98.[8]㊀丁培霞,杨云,刘敏丽,等.2012 2015年全国形态学室间质评结果回顾分析[J].中国药物与临床,2016,16(11):1686-1688.(2020-12-27收稿㊀2021-03-02修回)(本文编辑㊀戴志鑫)。
国家卫生健康委办公厅关于2019年度全国三级公立医院绩效考核国家监测分析有关情况的通报文章属性•【制定机关】国家卫生健康委员会•【公布日期】2021.03.19•【文号】国卫办医函〔2021〕135号•【施行日期】2021.03.19•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】医疗机构与医师正文国家卫生健康委办公厅关于2019年度全国三级公立医院绩效考核国家监测分析有关情况的通报国卫办医函〔2021〕135号各省、自治区、直辖市及新疆生产建设兵团卫生健康委:按照《国务院办公厅关于加强三级公立医院绩效考核工作的意见》(国办发〔2019〕4号,以下简称《意见》)要求,2020年我委联合相关部门继续组织三级公立医院绩效考核工作(以下简称绩效考核)。
现将2019年度西医类三级公立医院绩效考核国家监测分析情况通报如下。
一、积极稳妥组织绩效考核工作(一)在新冠肺炎疫情超常规应急阶段,着力完善绩效考核支撑体系。
为保障各医院全力应对新冠肺炎疫情,2020年1月至4月,我委将优化绩效考核方法作为工作重点,形成二级和三级公立医院绩效考核操作手册(2020版),将“重点监控高值医用耗材收入占比”纳入考核指标体系;升级绩效考核管理平台,优化数据填报功能及审核流程;在北京开通数据远程质控通道,通过堡垒机对存储在国家超算广州中心天河二号的病案首页数据进行质控,既满足疫情防控要求,又确保了数据安全和工作进度。
(二)在常态化疫情防控阶段,加快推进绩效考核工作。
2020年5月以来,先后印发《关于采集二级和三级公立医院2019年度绩效考核数据有关工作的通知》《关于启动2020年度二级和三级公立医院绩效考核有关工作的通知》,通过试填报与正式填报,减少数据错报、漏报情况,减轻医院后续工作压力;组织线上为主、线上线下相结合的系列培训,累计收集解答问题5024个,发布答疑手册15期,推出系列宣传品2期;配合“医疗人才组团式”援藏工作,派出专家组赴西藏现场调研辅导,提升西藏绩效考核数据质量;动态维护四级和微创手术目录,确保绩效考核标尺更加精准。
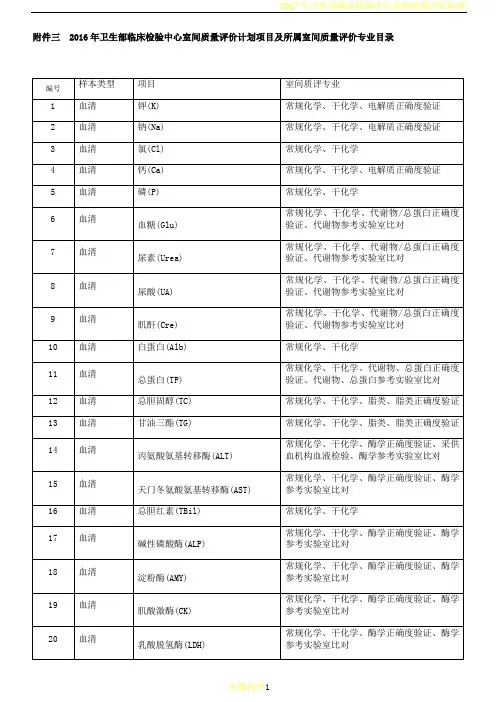
附件一2019年全国临床检验医疗质量控制指标
室间质量评价活动安排及注意事项
2019年临床检验质量指标室间质量评价共包含20项必填质量指标和29项选填质量指标。
一、评价质量指标与数据采集时间
1)月度指标34项(12项必填+22项选填)12项(以月为单位统计):
必填项:标本类型错误率、标本容器错误率、标本采集量错误率、抗凝标本凝集率、标本溶血率、标本丢失率、血培养污染率、检验前周转时间、实验室内周转时间、检验报告不正确率、危急值通报率、危急值通报及时率;
选填项:申请单标识错误率、实验室人员申请单抄录错误率、非实验室人员申请单抄录错误率、门诊检验申请单无临床问题率、门诊检验申请单无法辨识率、住院检验申请单无法辨识率、门诊检验申请单不适当率、住院检验申请单不适当率、标本标识错误率、标本检验前储存不适当率、标本运输途中损坏率、标本运输温度不适当率、标本运输时间过长率、标本采集时机不正确率、实验室人员导致的标本重新采集率、非实验室人员导致的标本重新采集率、微生物标本污染率、信息系统录入结果错误率、手工抄写结果错误率、检验结果纠正率、检验报告发送超时率、解释性注释有效率。
第1次调查要求回顾采集和统计2018年12月份数据;第2次调查要求回顾采集和统计2019年6月份数据。
2)年度指标15项(8项必填+7项选填)(以年为单位统计):
必填项:室内质控项目开展率、室内质控项目变异系数不合格率、室间质评项目参加率、室间质评项目不合格率、实验室间比对率(用于无室间质评计划检验项目)、分析设备故障数、国家级室间质评项目参加率(三级公立医院)和国家级室间质评项目不合格率(三级公立医院)。
选填项:针刺伤害发生率、实验室人员培训合格率、医护满意度、患者满意度、不良事件发生次数、实验室人员培训次数、实验室信息系统(LIS)故障数。
第1次调查要求回顾采集和统计2018年一整年数据;第2次调查不需要进行年度指标的数据上报。
二、回报方式
与常规室间质量评价计划相同,参加实验室通过在线EQA回报结果。
用户以所在省临床检验中心提供的室间质量评价用户名及密码登录“室间质评用户登录”,进入“室间质评”—“质评试验上报”上报结果。
网上上报后请在“已上报数据”中核对数据。
回报表分为三部分:(一)医院和实验室基本信息、(二)检验全过程质量指标和(三)新增检验全过程质量指标,其中前两部分为必填项,第三部分为选填项,前两项均填完才为上报成功。
三、调查对象
所有医院的检验科(包括有医疗机构许可证的独立实验室,厂家除外)
四、回报截止时间
第1次调查:2019.04.20
第2次调查:2019.10.20
五、注意事项
所有上报数据均应真实,并可靠统计。
如确实无相关记录或未统计,请在相应表格处填写未统计。
最后我们将对数据进行统计分析,并将统计结果通过您省临床检验中心网站反馈给各上报单位。