专题:离子大量共存的条件与判断 课件
- 格式:ppt
- 大小:140.50 KB
- 文档页数:8

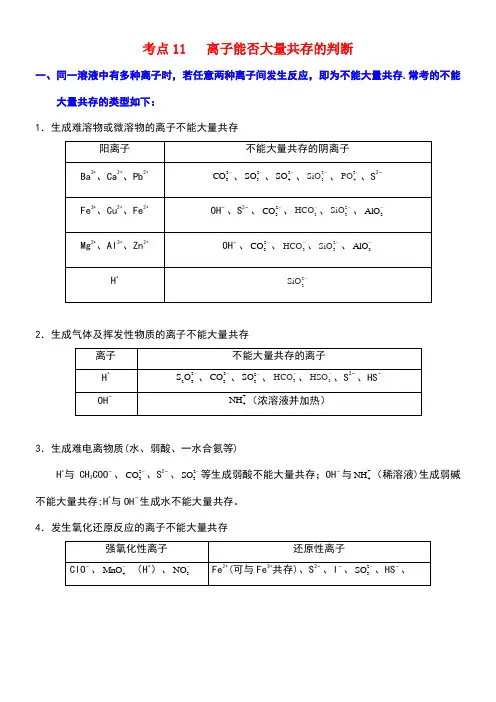
考点11 离子能否大量共存的判断一、同一溶液中有多种离子时,若任意两种离子间发生反应,即为不能大量共存.常考的不能大量共存的类型如下:1.生成难溶物或微溶物的离子不能大量共存2.生成气体及挥发性物质的离子不能大量共存3.生成难电离物质(水、弱酸、一水合氨等)H +与CH 3COO −、23CO -、S 2−、23SO -等生成弱酸不能大量共存;OH −与+4NH (稀溶液)生成弱碱不能大量共存;H +与OH −生成水不能大量共存。
4.发生氧化还原反应的离子不能大量共存5.发生相互促进水解反应的离子不能大量共存6.发生络合反应的离子不能大量共存7.离子共存题中的常见“陷阱”二、离子共存的判断方法1.离子间相互结合呈沉淀析出时不能大量共存。
如形成BaSO 4、CaSO 4、H 2SiO 3、MgCO 3、Ag 2SO 4等。
2.离子间相互结合呈气体逸出时不能大量共存。
如H +与S 2−、HS −、23CO -、3HCO -、23SO -、3HSO -,OH −与+4NH 等.3.离子间相互结合成弱电解质时不能大量共存. 如H +与CH 3COO −、OH −、ClO −、F −、24H PO -、24HPO -、34PO -。
4.离子间发生双水解反应析出沉淀或逸出气体时不能大量共存。
如Al 3+ 分别与2AlO -、23CO -、3HCO -、23SO -、23SiO -、C 6H 5O −;Al 3+与S 2−、HS −等。
5.离子间发生氧化还原反应时不能大量共存。
如:4MnO -、ClO −、Fe 3+分别与I −、S 2−、23SO -等。
6.在酸性介质中由于发生氧化还原反应而不能大量共存。
如3NO -和I −、S 2−、23SO -、Fe 2+在中性或碱性溶液中可以共存,但在有大量H +存在的情况下则不能共存。
7.离子间相互结合成络合离子时不能大量共存.如Fe 3+与SCN −络合,Ag +、+4NH 、OH −生成[Ag(NH 3)2]+,Fe 3+与C 6H 5O −(H +)也络合等.8.注意题目的前提设置.颜色:Cu 2+、Fe 3+、Fe 2+、4MnO -等有颜色;酸碱性:直接/间接——指示剂的颜色,水电离出H +或OH −,与Al 反应产生H 2等.考向一无限制条件的离子共存的判断典例1水溶液中能大量共存的一组离子是A.NH错误!、Ba2+、Br-、CO错误!B.Cl-、SO错误!、Fe2+、H+C.K+、Na+、SO错误!、MnO错误!D.Na+、H+、NO错误!、HCO错误!【答案】C1.水溶液中能大量共存的一组离子是A.Na+、Ca2+、Cl-、SO错误!B.Fe2+、H+、SO2-3、ClO-C.Mg2+、NH错误!、Cl-、SO错误!D.K+、Fe3+、NO错误!、SCN-练后归纳判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。


第五讲离子共存【教学目标】1、应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存2、能够离子共存的规律进行离子推断【知识梳理】一、离子共存1、概念:所谓几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若离子之间能发生离子反应,则不能大量共存2、在溶液中离子不能大量共存的条件(1)离子间反应生成沉淀:如Ca2+与CO2-3、Ag+与Cl-、Mg2+与OH-等(2)离子间反应生成气体:如H+与CO2-3、H+与HCO-3等(3)离子间反应生成难电离的物质:如H+与OH-、H+与CH3COO-、OH-与NH+4等3、常见的离子不共存归纳(1)在“无色透明”溶液中,不能存在有色离子,如:MnO4—(紫红色)、Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)(2)在酸性(H+)溶液中(pH=1、pH<7、紫色石蕊试液变红的溶液中)不能共存的离子有①氢氧根离子:OH—②弱酸根离子:CO32—、S2—、SO32—、ClO—、F—、CH3COO—、PO43—③弱酸酸式酸根离子:HCO3—、HS—、HSO3—、HPO42—、H2PO4—(3)在碱性(OH—)溶液中(pH=13、pH>7、紫色石蕊试液变蓝、酚酞变红的溶液中)不能共存的离子有①氢离子:H+②弱碱阳离子:NH4+、Mg2+、Al3+、Cu2+、Fe2+、Fe3+③弱酸酸式酸根离子:HCO3—、HS—、HSO3—、HPO42—、H2PO4—(4)弱酸的酸式根离子既不能与H+离子大量共存,又不能与OH—大量共存如:HCO3—、HS—、HSO3—、HPO42—、H2PO4—与H+、OH—不共存HCO3— + H+===CO2↑+ H2O HCO3— + OH—===CO32— + H2OHSO3— + H+===SO2↑+ H2O HSO3— + OH—===SO32— + H2OHS— + H+===H2S↑HS— + OH—===S2— + H2O(5)离子间反应生成沉淀,则不能大量共存①Ag+与Cl—、Br—、I—、CO32—②Ba2+与SO42—、CO32—、SO32—③Ca2+与CO32-、SO32—、F—④Mg2+、Al3+、Cu2+、Fe2+、Fe3+与OH—⑤SiO32—、AlO2—、S2O32—与H+⑥Cu2+、Fe2+与S2—(6)离子间反应生成微溶物,则不能大量共存①Ag+、Ca2+与SO42—②Mg2+与CO32—③Ca2+与OH—(7)离子间反应生成气体物质,不能大量共存①CO32—、HCO3—、S2—、HS—、SO32—、HSO3—与H+不能大量共存②NH4+与OH—(加热)二、解答离子共存问题的方法1、一是判断离子共存,还是判断不共存,注意题目要求是“一定大量共存”、“可能大量共存”还是“不能大量共存” 等要求2、二是看是否有隐含限制条件,如:碱性、酸性、无色等。


离子共存的条件与判断离子共存:所谓离子共存实质上就是看离子间是否发生反应。
若离子在溶液中发生反应,就不能共存。
(1)生成沉淀即生成难容物或微容物的离子不能大量共存。
常见的微容物有:CaCO3、CaSO4、MgCO3、Ag2SO4等。
这部分内容可参见教科书后面的部分酸、碱和盐的溶解性表。
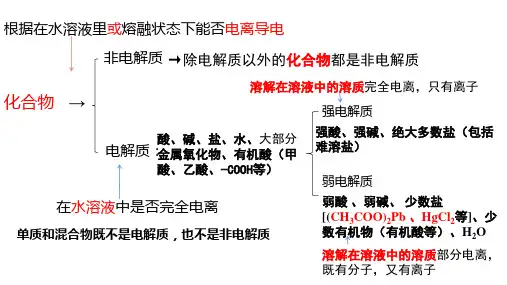
(2)生成弱电解质即弱酸、弱碱和水等的离子不能大量共存。
如:H+与ClO-、PO43-、HPO42-、H2PO4-、C6H5O-、CH3COO-、F-等生成的弱酸;OH-与NH4+、Cu2+、Fe2+、Fe3+、Al3+等生成的弱碱;还有H+与OH-结合生成水而不能大量共存。
(3)生成挥发性物质即气体的离子不能大量共存。
如H+与CO32-、HCO3-、SO32-、HSO32-、S2-、HS-、S2O32-等均能生成气体而不能大量共存;OH-与NH4+在受热的条件下或是浓度较大的情况下也能生成气体而不能大量共存。
(4)能发生双水解的离子不能大量共存。
如Fe3+、Al3+与CO32-、HCO3-、ClO-、SO32-、HSO3-、SiO32-、AlO2-等;还有Al3+与S2-、HS-、以及NH4+与AlO2-、S2O32-等也能发生双水解而不能大量共存。
(5)能发生氧化还原反应的离子不能大量共存。
如氧化性的离子Fe3+、ClO-、MnO4-与还原性离子SO32-、S2-、I-不能大量共存;还有在酸性条件下NO3-也具有氧化性如与Fe2+、S2-等还原性离子不能大量共存,另外还有SO32-、S2-与H+;MnO4-与Cl-、Br-、I-(酸性条件)等。
(6)能结合生成络合物的离子不能大量共存。
如:Fe3+与SCN-;Ag+与NH4+(碱性条件);Al3+与F-等。
(7)一般来说,所有的弱酸的酸式根离子在酸性或碱性溶液中均不能大量共存。
如:HCO3-、HS-、HSO3-、HPO42-、H2PO4-等。
(8)有条件限定的,如在无色透明的溶液中肯定没有如:Cu2+、Fe2+、Fe3+、MnO4-、Fe(SCN)2+等这样的有色离子;强酸性溶液中就不能大量存在能和H+发生反应的离子;强碱性溶液中就不能大量存在能和OH-发生反应的离子等。

离子在溶液中大量共存的条件所谓离子共存,实质上就是看离子间是否发生反应的问题.若在溶液中发生反应,就不能共存.看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等.一般注意以下几点:①在强酸性溶液中,不能大量存在弱酸根离子:如CO32-、HCO3-、S2-、HS-、SO32-、SiO32-、AlO2-、F-等,也不能有大量的OH-.②强碱性溶液中,不能大量存在弱碱金属离子.如:Mg2+、Fe2+、Al3+、Cu2+及NH4+等,也不能大量存在H+及酸式根离子:HCO3-、HSO3-、HS -、H2PO4-等.③能发生氧化还原反应的离子也不能共存:如:Fe3+与I-,Cu2+与I -,Fe2+与NO3-,H+与S2O32-,ClO-与S2-,ClO-与Fe2+,H+、I-与NO3-,H+、I-与SO32-或S2-等.④能形成络离子的也不能共存:如:Fe3+与SCN-,Ag+与S2O32-,Fe3+与C6H5O-等.1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存.(1)生成难溶物或微溶物:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存.(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等不能大量共存.(3)生成难电离的物质:如H+与Ac-(即醋酸根离子)、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水,这些离子不能大量共存.(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存.注意Fe2+与Fe3+可以共存.(5)形成配合物:如Fe3+与SCN-反应生成配合物而不能大量共存.2.附加隐含条件的应用规律:(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等.(2)强碱性溶液中肯定不存在与OH-起反应的离子!(3)强酸性溶液中肯定不存在与H+起反应的离子!(4)离子能够大量共存,包括离子相互间不会发生化学反应,不会生成沉淀,不会生成气体挥发。



化学高三复习第二章元素与物质世界第7讲离子共存 离子的检验和推断1.宏观辨识与微观探析:能从宏观和微观相结合的视角理解离子反应,并运用离子反应解决实际问题(大量共存问题,离子检验及推断)。
2.证据推理与模型认知:能利用正确的模型理解离子的推断。
1、了解离子反应发生的条件。
2、掌握常见离子的检验方法。
3、能鉴别常见离子并进行综合判断。
一、 离子共存1、离子共存的本质和常见的离子反应类型⑴复分解反应:生成难溶、难电离、挥发性物质;⑵氧化还原反应:较强的氧化性和较强的还原性的离子;⑶络合反应:能形成配合物(络合物)的离子;⑷相互促进水解的反应。
2、判断离子能否共存题的四步骤第一步:仔细阅读题干关键点审题①注意“一定大量共存”“可能大量共存”“不能大量共存”“因发生氧化还原反应而不能大量共存”等关键点。
②注意“透明溶液”意味着无难溶物和微溶物,但并不意味着溶液无色。
若限定溶液无色,则Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、CrO42-(黄色)、MnO4-(紫红色)、 Cr2O72-(橙色)、Cr3+(绿色)等有色离子不能大量存在。
“透明溶液”并不代表无色,也可以有色。
第二步:分析限制条件“酸性”或“碱性”等限制性(隐含)条件分析解读无色溶液使甲基橙呈红色或pH=1遇酚酞呈红色或pH=13与Al反应放出H2由水电离出的c(H+)=1×10-13 mol·L-1通入足量的CO2(或NH3)有色离子不能大量存在溶液显酸性,无大量的OH-及弱酸的酸根离子或酸式酸根离子溶液显碱性,无大量的H+及弱碱的阳离子、弱酸的酸式酸根离子溶液可能显酸性,也可能显强碱性,显酸性时不能含NO3-溶液可能显酸性,也可能显碱性溶液显酸性(或碱性)隐含条件分析解读因发生氧化还原反应而不能大量共存“一定”“可能”还是“不能”大量共存加水稀释,减小某溶液的,Fe3+大量存在[Al(OH)4]_、SiO32-能发生氧化还原反应的氧化性离子和还原性离子不能共存,不是复分解反应等其他离子反应类型确定是“可能性”还是“肯定性”说明该溶液显酸性[稀释的是溶质,溶质c(H+)减小,而c(OH-)增大]该溶液显酸性该溶液PH≤3.1溶液显碱性第三步:抓住反应发生条件(1)清楚生成气体、沉淀、弱电解质的复分解反应。
离子能否大量共存的判断溶液中离子大量共存指离子浓度均相当大,若离子间发生反应使离子浓度有些降低,也就是离子不能大量共存。
下面是十条规律可作为离子不能大量共存的判断依据1 声称气体不能大量共存如:硫离子,硫氢根离子,亚硫酸根离子,亚硫酸氢根,碳酸根,碳酸氢根等离子都能和氢离子反应生成气体,故均不能和氢离子大量共存;而铵根和氢氧根易产生氨气,故二者也不能大量共存。
2 生成沉淀不能大量共存溶解性表中不溶或微溶物质的阴阳离子不能大量共存。
如:a 氢氧根和铁离子,亚铁离子,铜离子,锌离子,铝离子,镁离子,银离子,汞离子易发生难容的氢氧化物或氧化物而不能大量共存。
b 硫离子和亚铁离子,锌离子,铜离子,汞离子,银离子等易结合成难容的硫化物沉淀,不能共存c 银离子和氯离子,溴离子,碘离子会形成卤化银沉淀,不能共存。
d 镁离子,钙离子,钡离子,铅离子易和碳酸根,亚硫酸根,硫酸根,磷酸根生成难溶盐(硫酸镁除外)而不能共存;钙离子与氟离子,四氧化二镉不能共存;镁离子,钙离子与C17H35COO- 不能共存;镁离子,钙离子,钡离子与磷酸一氢根等不能大量共存。
e 氢离子与硅酸根,硫代硫酸根,偏铝酸易发生沉淀不能共存。
f 两种离子相遇能结合生成微溶物时,也不能大量共存。
如:钙离子与氢氧根离子,硫酸根;银离子与硫酸根;铅离子与氯离子;镁离子与碳酸根离子,亚硫酸根离子;汞离子与硫酸根离子等均不能大量共存。
3 生成难电离物质不能大量共存如:氢离子与氢氧根离子,氟离子,次氯酸根,碳酸根,硫离子,硫氢根离子,亚硫酸根离子,偏铝酸根离子,磷酸根,氢青根,硫青根,醋酸根,甲酸根,四氧化二镉等易结合成难电离弱电解质,因而不能大量共存。
4 发生双水解反应不能大量共存溶解性表中"-"符号对应的阴离子和阳离子绝大多数因发生双水解而不能大量共存。
因弱碱的阳离子水解呈酸性,弱酸阴离子水解呈碱性,两类离子在溶液中相遇因中和反应促进双水解强烈进行或不能共存。