元素周期表专题复习共19页
- 格式:ppt
- 大小:1.61 MB
- 文档页数:10


第一章物质结构元素周期律期末复习学案何祥2010-6-24第一元素周期表复习重点:元素周期表的结构;元素在元素周期表中的位置及其性质的递变规律。
复习难点:元素在元素周期表中的位置及其性质的递变规律。
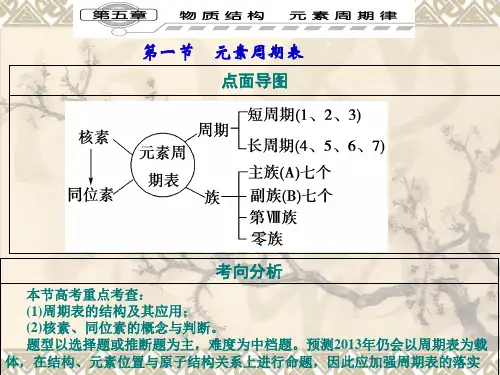
一、元素周期表的结构 (三短四长(一不全);七主七副八和零)1.周期:周期序数=电子层数, 共个周期(、、短周期;、、、长周期;不完全周期)。
2.族:(1)由构成的族,叫做主族;构成的族,叫做副族。
(2)元素周期表的中部从族到族10个纵行,包括了族和全部副族元素,共六十多种元素,通称为过渡元素。
因为这些元素都是,所以又把它们叫做过渡金属。
(3)主族元素的族序数=元素原子的最外层电子数。
周期表共18个纵行(个主族;个副族;一个族;一个族(、、三个纵行))。
二、元素性质与原子结构(一)碱金属元素结构异同:异:核电荷数:由_→_;电子层数:由_→_;同:最外层电子数均为_个。
单质密度逐渐,熔沸点逐渐。
2、碱金属的化学性质:钾的保存及取用方法:。
(1)与氧气反应差异性:Li+O2_(_色、氧化锂);_Na+O2__(_色、过氧化钠);_K+O2_(_色,_氧化钾);_Rb+_O2_(棕色、_氧化铷);_C S+_O2_(_色、_氧化铯)。
(2)与水反应差异性:(填反应现象)2Li+2H2O=2LiOH+H2↑(__);2Na+2H2O=2NaOH+H2↑(剧烈);2K+2H2O=2KOH+H2↑(____、__);2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸)。
(二)卤族元素(详见学案二的内容)第二元素周期律复习重点:原子核外电子层排布和元素金属性、非金属性变化的规律。
复习难点:元素金属性、非金属性变化的规律。
一、原子核外电子的排步规律1.核外电子排布规律电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为__,最外层电子数≤_。
(K层为最外层不超过_个)。
次外层电子数≤__,倒数第三层电子数≤__。




第一章第二节元素周期律知识点归纳总结(总7页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除高中化学必修2知识点归纳总结 第一章 物质结构 元素周期律第二节 元素周期律知识点一 原子核外电子的排布一、 电子层1. 概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作电子层。
2. 表示方法:通常吧能量最低、离核最近的电子层叫做第一层。
能量稍高、离核稍远的电子层叫做第二层,由里往外以此类推。
二、 原子核外电子的排布规律(一低三不超)1. 能量最低原理:原子核外电子总是尽可能优先排布在能量低的电子层里,然后由里向外,一次排布在能量逐步升高的电子层里,即电子最先排满K 层,当K 层排满后再排布在L 层,依此类推。
2. 原子核外各电子层最多容纳2n 2个电子(n 为电子层序数)3. 原子核外最外层电子不超过8个(K 层作为最外层时,不超过2个)次外层电子不超过18个,倒数第三层电子不超过32个。
三、原子核外各电子层的电子排布原子核外电子的排步层序数 1 2 3 4 5 6 7电子层符号 K L MN O P Q离核远近 由近到远 能量 由低到高各层最多容纳的电子数2×12=2 2×22=8 2×32=18 2×42=32 2×52=50 2×62=72 2×72=981.原子结构示意图: 粒子符号2.离子结构示意图:原子通过得失电子形成离子,因此,原子结构示意图的迁移应用于表示离子的结构。
Cl-五、元素周期表中1-20号元素原子的结构特征1.最外层电子数和次外层电子数相等的原子有Be 、Ar 。
2. 最外层电子数和次外层电子数2倍的原子是C 。
3. 最外层电子数和次外层电子数3倍的原子是O 。
4. 最外层电子数和次外层电子数4倍的原子是Ne 。
2014高考化学必备专题——元素周期表元素周期律【考纲解读】1.掌握元素周期表的结构。
2.掌握周期表中原子结构和位置、价态、元素数目等之间的关系3.了解周期表中各区、周期、族元素的原子核外电子排布的规律4.理解原子的组成及同位素的概念。
掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
5.以第1、2、3周期的元素为例,掌握核外电子排布规律。
6.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
7.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅡA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
8.电离能、电负性及其周期性变化9.以上各部分知识的综合应用。
【高考预测】本部分高考重现率几乎为100%,且常考常新,现将近两年全国各地高考试题中有关考点试题分类如下:历年考查的重点是:①同位数概念;②原子序数、核电荷数、质子数、核外电子数、中子数、质量数之间的关系;③短周期原子(或离子)核外电子排布;④元素周期表的结构;⑤同周期或同主族元素间原子半径、元素化合价、金属性非金属性(表现为单质及化合物的某些性质)的递变规律。
新教材增加的考点有:①核外电子运动的原子轨道和电子自旋;②核外电子的能级分布;③核外电子排布三原理;④第一电离能及其周期性变化,并用以说明元素的某些性质。
;⑤元素电负性的周期性变化。
一元素周期表1.原子序数原子中:原子序数=_______=________=________=______-_______。
2.元素周期表(1)编排原则:①按____________递增顺序从左到右排列;②将__________相同的元素排成一横行,共有____个横行。
③把________________相同的元素按____________递增的顺序从上到下排成一纵列,共有____列。


元素周期表、周期律复习第一部分基础知识梳理元素周期表一、元素周期表(一).编排规则:1.横行:把具有的元素按照递增的顺序排成横行。
2.纵行:把不同横行中最外层的电子数元素,按电子层数的顺序由排成纵行。
(二).周期表的结构:1.周期:①含义:把具有的元素按照递增的顺序排成横行,每一横行是。
②分类:短周期:周期长周期:③规律:周期数=注意问题:镧系元素位于第周期第格,有种元素锕系元素位于第周期第格,有种元素2.族:①定义:除 3个纵行外,其余每一个纵行标作一族。
②分类:含义:主族表示:组成:含义:族副族表示:组成:第VIII族:零族:注意过度元素:元素周期表的中部从IIIB到IIB共10个纵行,包括第族和全部共六十多元素,通称,这些元素都是金属,所以又把它们叫做。
练习1:元素周期表共个周期,其中短周期有个,长周期个;共有个族,其中主族个,副族零族个,3个纵行合称。
练习2:从左到右写各族的族序数:纵行数:1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18族序数:练习3:画出周期表的轮廓图:(三)、核素:1.质量数、质子数、中子数的关系:2.核素的定义:把具有一定数目和一定数目的一种原子叫做。
3.同位素:⑴.定义:人们把原子里具有相同和不同的原子互称为同位素。
如:⑵.同位素原子的性质:①物理性质:②化学性质:③同位素原子在自然界中的原子个数百分含量始终为。
⑶.相对原子质量的计算:已知同位素A1Z1X A2Z2X A13Z3X个数百分含量 a% b% c%原子的相对原子质量 m n p①原子的相对原子质量:②元素的相对原子质量:③元素的近似相对原子质量:元素周期律(一)元素周期律的内容及实质1.内容:__________随着原子序数的递增而呈________变化的规律。
2.实质:元素原子______________的周期性变化。
的周期性元素周期律的周期性的周期性元素性质的递变规律------同周期、同主族元素性质的递变规律注:1. 微粒半径大小的比较(1)不同种微粒一看电子层数:电子层数越多,半径。