电泳图谱的图像分析及蛋白质消化技术
- 格式:ppt
- 大小:4.67 MB
- 文档页数:15

浅谈蛋白质质谱分析方法及应用董义龙(单位:毕节学院,化学与化学工程学院,2009级化学教育本科三班,学号:06320904031)摘要:随着科学的不断发展,运用质谱法进行蛋白质的分析日益增多,本文简要的综述了肽和蛋白质等生物大分子质谱分析的特点,方法及蛋白质质谱分析的原理,方式和应用,并对其发展前景着出展望。
关键词:蛋白质质谱分析原理与方法蛋白质是生物体中含量最高,功能最重要的生物大分子,存在于所有生物细胞,约占细胞干质量的50%以上。
作为生命的物质基础之一,蛋白质在催化生命体内各种反应进行,调节代谢,抵御外来物质入侵及控制遗传信息等方面都起着至关重要的作用,因此,蛋白质也是生命科学中极为重要的研究对象。
关于蛋白质的分析研究,一直是化学家及生物学家极为关注的问题,其研究的内容主要包括分子量测定,氨基酸鉴定,蛋白质序列分析及立体化学分析等。
随着生命科学的发展,仪器分析手段的更新,尤其是质谱分析技术的不断成熟,使这一领域的研究发展迅速。
1 蛋白质组学研究的背景和意义1.1蛋白质组学的产生20世纪90年代开始的人类基因组计划(}Iuman Genome Project,HGP)是人类有史以来最伟大的认识自身的世纪工程,旨在阐明人类基因组DNA3×109核苷酸序列,希望在分子水平上破译人类所有的遗传信息。
经过各国科学家十几年的努力,HGP已取得了巨大的成绩。
在揭示基因组精细结构的同时,也凸现了基因数量有限性和基因结构的相对稳定性,这与生命现象的复杂和多交性之间存在着巨大的反差。
这种反差促使人们认识到:基因只是遗传信息的载体。
要研究生命现象,阐释生命活动的规律,只了解基因组的结构是远远不够的。
对于生命活动的主要体现者——蛋白质进行更全面和深入的研究是目前生命科学研究的迫切需要和重要任务。
后因组时代中功能基因组(Functional Genomics)的研究采用一些新的技术,如微阵列,DNA芯片对成千上万的基因表达进行分析比较,并从基因整体水平上对基因的活动规律进行阐述。



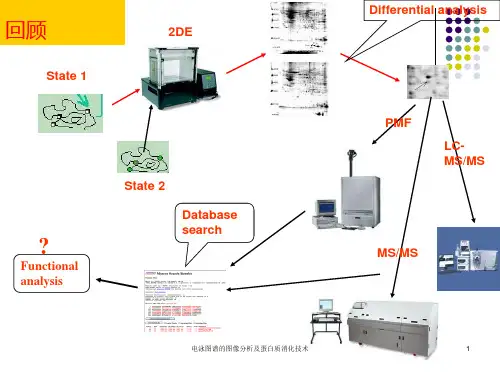
技术与方法蛋白质双向电泳图像分析3贾宇峰1) 林秋霞1) 郭尧君2)33 郭 鹞3) 刘少君1)33(1)军事医学科学院基础医学研究所神经生物学研究室,北京100850;2)中国科学院生物物理研究所,北京100101;3)第四军医大学预防医学系放射医学教研室,西安710032)摘要 随着人类基因组计划的接近完成,蛋白质组(proteome)研究成为新的热点.其中高分辨率的双向电泳(two2dimensional gel electrophoresis,22DE)技术使对组织或细胞的整个蛋白质组的综合分析成为可能.近年来这一技术有了很大的改进和提高,特别是图像分析系统,算法更为先进,功能日益强大,操作也更简便,为大规模研究提供了良好的工具.使用新一代的2D图像分析系统,对离体培养的雪旺氏细胞的蛋白质样品双向电泳结果进行了初步分析,探讨了在图像扫描、点检测、背景消除、匹配、结果报告和数据分析各步中的技术问题,并报告了进行2D图像分析的体会.关键词 双向电泳,蛋白质组,图像分析,软件,雪旺氏细胞学科分类号 Q51 双向电泳(two2dimensional gel electrophoresis, 22DE)技术是蛋白质组研究中最为广泛应用的蛋白质分离方法[1].而2D图像分析作为22DE的重要一步,其作用是评价和量化电泳结果.在蛋白质组研究中,从样品制备、第一向等电聚焦(IEF)、第二向SDS聚丙烯酰胺凝胶电泳(SDS2PA GE)、2D图像分析到基质辅助激光解析电离2飞行时间质谱仪(MALDI2TOF2MS)或液相色谱2串联质谱连用(LC2MS/MS)分析,整个技术过程环环相扣,更加复杂.在各个环节中,图像分析既要对上游各步的结果做出定性和定量的评价,将一个直观的蛋白质二维图谱数字化,还要为下一步的分析提供依据.特别是在表达蛋白质组学研究中,需要用图像分析软件通过正常和异常细胞、组织等电泳图谱间的匹配,找出差异蛋白质点:哪些点消失了?哪些点是新出现的?哪些点是相同蛋白,而表达水平有差异等等.将这些目标点切下,通过氨基酸组成分析、N端测序或质谱分析,确定是何种蛋白质,再结合图像分析数据和与内部和外部数据库比较的结果,做出结论.由此可见,2D图像分析在蛋白质组研究中是不可或缺的.正当人类基因组计划即将完成之时,越来越多的实验室开始涉足后基因组(post2genome)领域,蛋白质组研究正在升温.在一些科研机构和生物技术公司的努力下,22DE技术不断出现突破性进展, 2D凝胶的分辨率也越来越高.在这种情况下,简单的图像比较是远远不能满足研究需要的,图像采集系统和分析软件必须能够检测到最小的差别和获取最多的信息[1].随着22DE技术和计算机技术的发展,2D图像分析系统的性能有了很大的提高,高分辨率高速度的扫描仪如ImageScanner、STORM scanner和Model GS2710Imaging Densitometer等,再加上新一代功能强大的软件如ImageMaster2D、PDQuest[2]、MelanieⅡ[3,4]等,为大规模分析做好了准备.我们的实验室正在利用22DE技术开展神经生物学方面的蛋白质组研究工作,已经建立了全套22DE系统,并且应用图像扫描系统和2D图像分析软件对提取的雪旺氏细胞蛋白质样品电泳结果进行了初步分析研究. 3国家自然科学基金资助项目(39928015). 33通讯联系人. 刘少君Tel:010*********,E2mail:liusj@ 郭尧君Tel:010*********,E2mail:yaojun.g@ 收稿日期:2000204224,接受日期:20002062071 材料与方法111 22DE本文中22DE使用蛋白质样品提取自原代培养的雪旺氏细胞,上样量80μg(Bradford法[5], Unicam UV300紫外2可见分光光度仪定量);第一向IEF使用Immobiline TM p H3~10线性IP G预制凝胶条(购自Amersham Pharmacia Biotech Inc.),在IP G phor 电泳仪(APB公司)上完成,第二向SDS2PA GE使用自制SDS凝胶(250mm×180mm ×015mm,T=13%)[6,7],在MultiphorⅡ 电泳仪(L K B公司)上进行;Hoefer凝胶自动染色仪(APB公司)银染[8];染色完成后玻璃纸覆盖,室温下放置数天干胶.112 软件与硬件ImageMaster2D Elite3101(图像分析软件)和LabScan(扫描控制和分析前处理软件)是由Nonlinear Dynamics Ltd.开发,购自APB公司.工作站为联想奔月2000电脑,(Pentium II 350MHz CPU,64M内存,30G硬盘空间,17寸显示器,显示分辨率1024×768),Windows98操作系统.ImageScanner扫描仪(最高分辨率为9600dpi(H)×9600dpi(V)),购自APB公司. 113 图像采集与分析使用Labscan控制ImageScanner扫描图像, ImageMaster2D Elite3110分析.2 结果与讨论211 分析过程21111 图像扫描:在LabScan中,执行扫描.大多数情况下,300DPI(dot per inch)比较合适,但对于过大或过小的凝胶,就应该根据实际情况调节DPI值.不过相对于凝胶而言,缩小的图像会导致图像质量的损失或无法分辨;而放大的图像则会由于多余的象素而出现内插值(interpolated values),甚至会出现象素效应(pixellation),影响测定.因此扫描时图像与凝胶大小最好是1∶1.本文分析采用300DPI扫描的图像(图1a). 应该强调的是,强度校正(intensity calibration)是很重要的,特别是要使用图像做光密度测定时,一般是分析凝胶图像的第一步.强度校正可把以任意单位测得的强度值与实际的光密度(optical density)或散射密度(diffuse density)值匹配.这可以解决图像扫描设备的非线性应答问题,即图像中的象素值和实际光密度之间无线性关系.由于光密度仪能够直接提供图像的校正数据,用此种设备扫描时通常不需要校正[8].另外,也可用扫描软件校正图像.校正一般使用已知光密度的灰度尺(step wedge),即一组灰度呈梯度变化的条带.在软件中可定义灰度尺列表,添加和删除值.21112 点检测:可自动执行,同时也可调节灵敏度和算子大小,在高级设置中更有灵敏度、算子大小、背景和噪声四项供调节.使用点检测向导很方便,首先在整个图像上框选一片区域,进入下一步,出现九格窗口,各个窗格显示的是根据不同灵敏度和算子大小检测得到的效果图,选择最满意的窗格或直接调节下侧和右侧的灵敏度和算子大小,直到中间窗格的检测结果达到最佳而其他各窗格结果也较为满意为止,进入再下一步,就是消除背景,最后显示检测结果.上述过程中有两点需要说明,一是框选区域越小,图像处理时间越短,反之亦然;二是ImageMaster2D除有图像翻转功能外,不提供任何其他图像调整工具,因此提交分析的基本是扫描后的原始图像,一些杂质点和明显的瑕疵也会被误认为是蛋白质点,这些将在下面的手工编辑和背景消除中得到纠正.初步检测结果,包括蛋白质点的编号、面积、量、以及峰值用表格的形式列出,图像上所有检测到的点都可用同形色块覆盖、轮廓线圈围、十字线或标记等显示(图1b).自动检测完成后,仍有一些点未被识别出,还有一些是“假点”,另有一些因距离过近被识别成一个点,需要手工添加、删除或分割. ImageMaster2D中提供了一些很好用的编辑工具:画点、删除点、提高峰值、边缘增加、分割点、选择点等(图2).21113 背景消减:扫描后的图像一般都有不同程度的背景,从而影响蛋白质点的精确检测.一些2D图像分析软件有较强大的图像调整功能,可在分析前对图像作平滑、对比增强、消减背景等处理.而ImageMaster2D原则上在检测前不对图像作任何处理(除了图像翻转),而是在点检测完成后消减背景,共有五种方式:手工消减、边界最低强度消减、边界平均象素值消减、非点模式消减,后三种均是完全自动的,如果上述四种方式均不能满足要求,也可以直接编辑某个点的背景水平. 21114 匹配:上文已经提到,匹配是2D图像分析中很重要的一步.在ImageMaster2D Elite中,这也是一个交互式的过程.匹配时首先要创建参考凝胶,参考凝胶可以是要分析比较的一组凝胶中的一张,也可以是几张凝胶合并而成的平均胶.用户可以通过改变向量框(vector box)和搜索框(search box)的大小来操纵匹配.由于电泳过程中的一些影响因素的作用,即使是同一样品两次电泳图像之间也存在移位或扭曲.在这种情况下,可以调整上述两个参数得到较好的匹配效果(图3). 21115 结果报告:在图像分析的过程中,会产生大量的数据.数据的存储和输出是很重要的. ImageMaster2D在整个分析过程中,无论是图像窗口还是测量窗口的内容变化,随时都可以拷贝到剪贴板和文件,其中数据列表还可拷贝到Excel文档.检测结果还可生成凝胶报告或蛋白质点报告,包括图像和列表,并可存储为rtf文件.另外,软件还可将分析数据自动创建成网页,点击参考胶任何一个蛋白质点就可以访问相关数据.21116 1D和2D校正:可通过已知分子质量的标准蛋白确定凝胶上蛋白质点的大致的分子质量(M r),等电点(p I)可通过在第一向加入的等电聚焦标准蛋白(一系列分子质量相同而等电点不同的蛋白).2D 校正首先要创建一个蛋白质列表,这些蛋白质的特性,主要是分子质量和等电点都是已知的,并将这些蛋白质与凝胶上的点关联起来(即该种蛋白质在凝胶上形成的点),软件据此进行校正.21117 数据分析和数据库查询:在因特网上有许多蛋白质数据库和22DE 数据库,这些数据库中存储着不同来源的和不同形式的蛋白质信息.2D 分析软件基于分析所产生的蛋白质点的数据,再通过数据库中的查询,可以做出更全面的分析.软件现提供Biobase 、Swiss 2D Page 等5个数据库的查询.212 问题与展望21211 图像调整:扫描时,杂质和蛋白质点的拖尾会影响图像的质量,使分析效率与准确性大大降低.一些2D 图像分析软件有较强大的图像调整工具,可对图像作平滑、对比增强、消减背景等处理,如PDQuest 在点检测时,生成2D scan 、gel image 和gel spots 三幅图像,其中2D scan 是扫描的原始图像,gel spots 是经图像调整后提交检测的图像,gel image 是用于编辑的图像,也经过了图像调整.而ImageMaster 2D 原则上不对图像作任何处理.在实验初期,我们为了提高图像分析的效率,尝试使用Photoshop 510的图像调整工具和噪声滤镜消减背景和去除杂质点,但是发现图像调整后蛋白质点的量值(volume )明显变化.同时我们发现,即使不调整图像,通过优化灵敏度、算子大小、背景和噪声等变量的设置,在点检测时就可排除一些杂质点,其后的手工编辑也可再作甄别.21212 校正和标准化:影响双向电泳重复性的因素很多,包括样品制备与上样方式的不同,染色方法和扫描方式的差异等等.为了准确地比较分析,必须采用校正标准化的方法.首先是强度校正(intensity calibration ),在扫描前,使用灰度尺解决图像扫描设备的非线性应答问题.同时可把图像中的象素值转换为实际的光密度(optical density ,OD );在匹配时,可建立平均凝胶(averaged gel ).所谓平均凝胶,并非是真的凝胶,而是通过把一组凝胶经统计学处理合并在一起生成的模拟凝胶.创建平均凝胶可在同一样品的一组凝胶中生成一张有代表性的凝胶.如果将其作为参考凝胶进行匹配,则能得到更多的信息.21213 自动化:但是我们也应该看到,一张凝胶上大约总有一些点未被检测到,另外一些检测到的却是“假点”等等,这些都必须手工调整,非常耗时间费精力.另外,手工匹配也需要大量时间,而且会导致错配发生.因此,22DE分析软件的自动化程度还需提高,应向高分辨率、高灵敏度、智能化的方向发展.参 考 文 献1 Quadroni M,James P.Proteomics and automation.Electro2 phoresis,1999,20:664~6772 Collins P J,J uhl C,Lognonn′e J L.Image analysis of2D gels: considerations and in2sights.Cell Mol Biol,1994,40(1):77~833 Appel R D,Palagi P M,Walther D,et al.MelanieⅡ:a third2 generation software package for analysis of two2dimensional electrophoresis images:Ⅰ.Features and user interface.Electrophoresis,1997,18(15):2724~27344 Appel R D,Vargas J R,Palagi P M,et al.MelanieⅡ:a third2 generation software package for analysis of two2dimensional electrophoresis images:Ⅱ.Algorithms.Electrophoresis,1997, 18(15):2735~27485 Bollag D M,Rozucki M D,Edelstein S J.Protein Methods.2nd.USA:Wiley2Liss,Inc,626 G rg A,Boguth G,Obermaier C,et al.Two2dimensional polyacrylamide gel electrophoresis with immobilized p H gradients in the first dimension(IPG2Dalt):The state of the art and the controversy fo vertical versus horizontal systems.Electrophoresis, 1995,16:1079~10867 G rg A,Boguth G,Obermaier C,et al.Two2dimensional electrophoresis of proteins in an immobilized p H4~12gradient.Electrophoresis,1998,19:1516~15198 郭尧君.蛋白质电泳实验技术.北京:科学出版社.1999.142 Guo Y J.Experimental Techniques of Protein Electrophoresis.Beijing:Science Press,1999.142The Image Analysis of Two2Dimensional G el Electrophoresis3J IA Yu2Feng1),L IN Qiu2Xia1),GUO Yao2J un2)33,GUO Yao3),L IU Shao2J un1)33(1)Instit ute of Basic Medical Sciences,Academy of Military Medical Sciences,Beiji ng100850,China;2)Instit ute of Biophysics,The Chi nese Academy of Sciences,Beiji ng100101,China;3)Depart ment of Radiation Medici ne,The Fourth Military Medical U niversity,Xi’an710032,China)Abstract Proteome research has become a new hot spot in the post2genome era.High2resolution two2 dimensional gel electrophoresis(22DE),which provides the most comprehensive analysis system of the whole proteome,was highly improved in recent years.With the development of computer techniques,the powerful and user2friendly image analysis systems appeared to help high2throughput,large2scale proteomic ing new generation two2dimensional image analysis software,ImageMaster2D Elite,the2D gels of proteins extracted from cultured Schwann’s cells were processed.The analysis procedure,including image acquirement, spot detection,match,background subtraction,p I/M r calibration,analysis results report and database query, were reported and discussed.K ey w ords two2dimensional gel electrophoresis,proteome,image process,software,Schwann’s cell 3This work was supported by a grant from National Nature Science Foundation of China(39928015). 33Corresponding author.Liu S J,Tel:86210266930304,E2mail:liusj@ Guo Y J,Tel:010*********,E2mail:yaojun.g@ Received:April24,2000 Accepted:J une7,2000。





电泳图片光密度分析原理与方法无论是DNA电泳图片还是RNA电泳图片,或者是蛋白的凝胶电泳图片包括Western blot膜、或者是化学发光膜图片,在图像分析的角度来看,都是同样的一种条带光密度分析的问题。
分析电泳条带有专门的一类图像分析软件。
常见的是Bandscan,Quantity One,而由各个凝胶电泳成像系统厂商自己编制的软件就更多了。
其中Labworks是UVP公司生产的凝胶电泳成像系统上配用的拍摄与分析软件,实际上就是传说中大名鼎鼎的gel-pro。
这个软件可以看作是Image-pro plus应用在电泳条带分析上的专业版。
实际上所有的电泳条带分析软件在分析原理与功能上都没什么差别。
只是软件界面与操作程序上各有不同。
所以,了解了条带的分析原理后也就能自己学会各种软件的使用了。
分析电泳条带也是从拍摄电泳照片开始的,用平时的数码相机拍摄的电泳条带一般不能用来进行定量的分析,而必须使用专门的拍摄设备,大家一般称它为“凝胶成像系统”。
它集中了观察,拍摄与分析凝胶的所有功能。
一个凝胶成像系统包括了三个部分,暗箱,相机与电脑上的控制分析程序。
让我们从使用成像系统的操作方法中来了解如何正确地拍摄与分析凝胶吧。
一、暗箱一个最简单的暗箱就是个不透光的箱子里面放了一个紫外灯箱,高级一点的暗箱则有好几组灯光照明。
当然,在箱子上面会有一个安放相机的地方。
紫外灯箱是观察与拍摄凝胶的必需照明设备。
它是用来观察EB染色的凝胶条带的。
里面的紫外灯光能提供256nm,302nm 及365nm的紫外光。
在观察EB的红色荧光条带时,一般用302nm。
在观察与拍摄蛋白凝胶的时候,必须使用透射白光照明。
有的暗箱里会有白板照明灯,平时向上掀起靠在后壁上,使用时拉下来。
简单的暗箱则是用一块荧光板放在紫外灯箱上面,用紫外光照射荧光板,发出白色光。
用白板的透射光照明来拍摄蛋白凝胶的道理有点像医院里用灯箱来观察X光片。
只有在透射光下,才能正确地反映凝胶上条带的光密度分布。

双向电泳图谱的图像分析技术进展李赫;邹黎明【摘要】@@ 1引言rn双向电泳技术虽然已发展成为蛋白质组研究中的三大核心技术之一[1](另外两种分别是质谱技术和蛋白质组信息学),但实验最终结果是很大程度上依赖于后期的图像分析,只有较为精确地对蛋白点进行识别、对比、定量,才可能有效地分析各组凝胶上的蛋白数据,从而得到有意义的生物学信息.【期刊名称】《沈阳医学院学报》【年(卷),期】2006(008)001【总页数】3页(P74-76)【关键词】双向凝胶电泳(2-DE);图像分析;软件包;蛋白点【作者】李赫;邹黎明【作者单位】上海交通大学,上海,200240;沈阳医学院医学基础部生物化学教研室【正文语种】中文【中图分类】医药卫生•74 •沈阳医学院学报 Journal of Shenyang Medical College 第 8 卷第 1 期2(刷年 3 月4概要和结论越来越多的人相信,诱导机体产生强有力的细胞免疫应答是获得针对 HIV-1 的保护性免疫的必要条件。
长期以来,这种观念促进了多种疫苗构建技术的快速发展。
包含较少数目抗原表位的疫苗可以通过合成肤的方式来构建。
而对于较多的抗原表位则使用 DNA 疫苗;病毒载体疫苗或重组蛋白疫苗的方式来构建更为合适。
由于需要对蛋白体进行处理和随后表位肤的呈递进行优化,所以使设计和构建包含抗原表位的疫苗的过程显得非常复杂。
然而,有相当多的技术工具和设计原则可用于简化上述操作。
如:细胞内靶向信号或分泌信号和氨基酸间隔的联合应用,可以使蛋白体的处理效率达到最大值。
以DNA 质粒和重组蛋白形式呈递的基于 CTL 和 HTL 抗原表位构建的疫苗已经进入临床研究阶段,将为人类征服上述顽疾做出重大贡献。
参考文献:[ 1]PINTOLA,BERZOFSKYJA,FOWKEKR,et al.HIV-s严C温c immuni可following immunization 明白HIV synthetic envelope pep tides in 町mptomatic HIV-infected patients(J].AIDS,1” 9,13( 15) :2003 -2012.(2]GAHERY-SEGARDH,PIALOUXG,CHARME四AU B,et al.Multiepitopic B 皿d T-cell respon回s induced in humans by ahu manimmunodeficiencyvirustype1lipopeptidevaccine[ J ].JVirol,2α>0,74 (4): 1694-1703.[3]ANLL,RODRIGUEZF,HARKINSS,etal.Quantitativeand qualitative analyses of the immune respon回s induced by a multiva lent minigeneDNA vaccine(J].Vaccine,2仪泊, 18(20): 2132.[4]ANLL,WHπTONJL.Muitivalent minigenevaccin田 a萨inst in fectious di酣臼 [J].Curr Opin Mol Tuer,1朔,1 ( 1):“-21.(5) HAN阻 T, NEUMANNVC,BLANCHARD 晖, et al.团团live induction of HIV-sp四ific CTL bymulti-epitope using gene gunina co础i时咄咄nationregime[ J].Vaccine,1粥, 17 (的: 589.[ 6)UVINGSTON BD,CRIMI C,GREY H, et al.The hepatitis B vi rus-specific CTL respo阳回 indue。