极化曲线在电化学腐蚀中的应用资料
- 格式:doc
- 大小:85.00 KB
- 文档页数:6

实验一:恒电位法测定阳极极化曲线一.实验目的1. 熟悉恒电位仪测定极化曲线的方法;2. 了解金属钝化现象及活化钝化转变过程二.基本原理极化曲线测量是金属电化学腐蚀和保护中一种重要的研究手段。
测量腐蚀体系的极化曲线,实际就是测量在外加电流作用下,金属在腐蚀介质中的电极电位与外加电流密度之间的关系。
某些金属在特定介质中存在钝化现象,表面生成一层具有保护作用的钝化膜,其阳极极化曲线如图所示:图1-1. 具有活化钝化转变的阳极极化曲线图中Ⅰ区为活化区,Ⅱ区为钝化过渡区,Ⅲ区为钝化区,此时金属表面生成一层具有保护性的钝化膜,Ⅳ区为过钝化区,钝化膜破裂,极化电流增大。
图中a 点所对应的电流密度为维钝电流密度,b 点所对应的电流密度为致钝电流密度。
为了判定金属在电解质溶液中采用阳极保护的可能性,选择阳极保护的三个主要技术参数——致钝电流密度、维钝电流密度和钝化电位,必须测定阳极极化曲线。
三.实验仪器及用品恒电位仪,极化池,参比电极,辅助电极,工作电极,天平,量筒,水浴锅,温度计,搅拌棒,碳酸氢铵,氨水,无水酒精棉,水砂纸,四.实验步骤1. 配制实验溶液100毫升去离子水在水浴中加热至40度左右,放入22.9克碳酸氢铵,用玻璃棒搅拌至完全溶解,再加入9毫升氨水;2. 测定阳极极化曲线用水砂纸打磨工作电极至光亮,用无水酒精棉擦干待用;按照仪器要求连线,盐桥尖端与研究电极齐高,经教师确认无误方可开始实验;极化速度100mv/分钟。
实验完毕后拆线,整理实验台。
lgiab五.实验报告要求1.姓名、学号、班级2.试验目的:根据自己的理解简述3.实验原理:根据自己的理解简述,请勿抄书或实验讲义4.仪器药品及实验步骤:简述5.实验数据在表中列出实验数据6.数据处理作E-lgi曲线图,在图中标明致钝电流密度、维钝电流密度及钝化电位区间,并附表列出。
7.结果分析要求对所得的试验结果进行讨论分析,得出最终结论,文中引用参考文献处用上角标[1]的格式标明,并在试验报告后列出所引用的文献。

极化曲线在电化学腐蚀中的应用娄浩(班级:材料化学13-1 学号:9)关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。
其中电化学腐蚀是金属腐蚀的一种最普遍的形式。
论文分析了电化学腐蚀的机理以及极化曲线的理论基础。
利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。
1.金属腐蚀的电化学原理金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。
通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。
所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。
其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。
腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。
电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。
任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属部的电子流和介质中的离子流形成回路[4]。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。
例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即阳极反应:Fe - 2e →Fe2+阴极反应:2H+ + 2e →H2总反应:Fe + 2H+ →Fe2+ + H2与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。
由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生[6]。



极化曲线分析钢筋的腐蚀过程极化曲线分析钢筋的腐蚀过程摘要:为了确定混凝土中钢筋锈蚀速率的控制因素,运用腐蚀极化曲线图分析活化钢筋阴阳极极化曲线和腐蚀电流随环境相对湿度的变化规律,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程。
结果表明,有锈蚀产物存在时,锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程的阴极去极化剂,钢筋的总腐蚀电流为氧去极化和锈蚀产物去极化产生的腐蚀电流的加和。
钢筋的总腐蚀电流随着环境相对湿度的提高而增大,和氧在混凝土中的扩散速率的变化趋势截然相反,从而证明氧仅是混凝土内钢筋开始的锈蚀的必备条件,但却不是混凝中钢筋锈蚀过程控制素。
关键词:混凝土;钢筋;极化曲线;氧;腐蚀产物混凝土中钢筋的锈蚀是一个非常复杂的电化学过程,目前国内外学者在建立钢筋锈蚀速率模型时,普遍借鉴了金属腐蚀学的研究成果,假定混凝土中钢筋的锈蚀速率受氧扩散速率所控制[1-7],这种假定的正确和合理性直接决定了由此建立的理论模型的适用程度.由于金属腐蚀学研究的对象,大都是金属处于溶液、水或土壤中,整个腐蚀过程受氧扩散控制已为无数的研究所证实。
然而大气环境混凝土中钢筋的腐蚀和前几种不同,目前已有的研究发现钢筋的锈蚀速率随混凝土湿含量增大而增大,直至混凝土饱水,钢筋锈蚀速率也没有出现下降[8-9],和混凝土中氧扩散速率的变化趋势[10]截然相反,这是上述假定所无法解释的.姬永生等[11]通过试验研究和钢筋锈蚀产物物相组成的变化分析证明锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程阴极反应的新的去极化剂,传统的氧作为单一阴极去极化剂的锈蚀机理面临着严峻的挑战。
因此,探究高湿供氧困难情况下混凝土内钢筋仍高速锈蚀的内在机理,对于建立正确、合理钢筋锈蚀速率模型具有重要的意义。
腐蚀极化曲线图是进行金属腐蚀机理分析的重要工具之一。
本文在文献[11]研究的基础上,运用腐蚀极化曲线图全面解释混凝土中钢筋锈蚀过程,探究混凝土由干燥到饱水变化过程混凝土内钢筋锈蚀速率变化的内在机理,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程,为预测钢筋混凝土的使用寿命奠定基础。
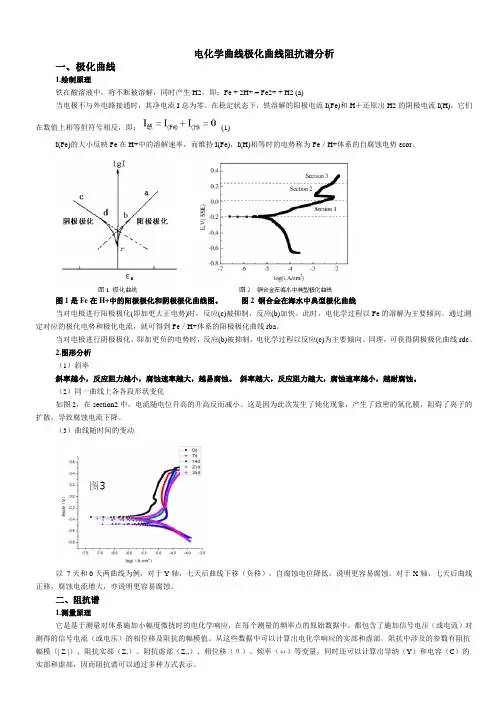
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。

极化曲线腐蚀电流与腐蚀电位介绍极化曲线是研究腐蚀电流与腐蚀电位之间关系的重要工具。
本文将从极化曲线的定义、测量方法以及与腐蚀电流、腐蚀电位的关系等方面进行详细探讨。
一、极化曲线的定义极化曲线是指在某一刺激作用下,随着刺激量的变化,所得到的反应物性质与刺激量间的关系曲线。
在腐蚀研究中,极化曲线描述的是电流与电位之间的关系。
二、极化曲线的测量方法1. 三电极系统为了测量极化曲线,通常使用一个工作电极、一个参比电极和一个对电极组成的三电极系统。
工作电极是被测样品,参比电极提供参比电位,对电极则是为了维持电路的稳定性。
2. 实验条件在测量极化曲线时,需要控制一些实验条件,比如溶液的组成、温度、电极表面的状态等。
这些条件的变化会对极化曲线产生影响,所以在测量过程中要保持这些条件的稳定性。
3. 电位扫描在测量极化曲线时,常用的方法是通过改变工作电极的电位来扫描整个电位范围。
通过记录工作电极的电流响应,可以得到不同电位下的腐蚀电流。
三、极化曲线与腐蚀电流的关系极化曲线中的腐蚀电流对应着电位上的表面腐蚀速率。
当电位越正时,腐蚀电流也越大,表示腐蚀速率增加。
而当电位越负时,腐蚀电流较小,腐蚀速率减小。
1. 极化曲线的形状极化曲线的形状可以反映出腐蚀行为的特点。
常见的极化曲线形状有Tafel曲线、线性极化曲线和非线性极化曲线等。
2. 极化曲线的参数极化曲线可以通过一些参数来描述。
常见的参数有Tafel斜率、交流阻抗和腐蚀电位等。
这些参数可以用来研究腐蚀行为及其机制。
3. 极化曲线的应用极化曲线在腐蚀研究和工程实践中有着重要的应用。
通过分析极化曲线,可以评估材料的腐蚀性能、预测腐蚀速率以及设计腐蚀防护措施等。
四、腐蚀电位与腐蚀电流的关系腐蚀电位是触发腐蚀过程的电位,而腐蚀电流是腐蚀过程中产生的电流。
腐蚀电位与腐蚀电流之间有一定的关系。
1. 过电位理论过电位理论是解释腐蚀电位与腐蚀电流关系的一种理论模型。
根据该理论,腐蚀过程中的电位是由电化学反应的阻抗决定的,而腐蚀电流则是由电化学反应的速率决定的。

极化曲线求自腐蚀电流密度1. 引言自腐蚀电流密度是表征金属在自腐蚀环境中的腐蚀性能的重要参数。
通过测量极化曲线,可以获得金属在自腐蚀条件下的电流密度,进而评估其腐蚀倾向和腐蚀速率。
本文将介绍极化曲线的概念和测量方法,并详细探讨如何通过极化曲线求得自腐蚀电流密度。
2. 极化曲线的概念极化曲线是描述金属在电化学腐蚀条件下的电流密度与电位之间关系的曲线。
它是通过在不同电位下测量金属电流密度的变化来得到的。
一般来说,极化曲线可以分为两个区域:阳极极化区和阴极极化区。
在阳极极化区,金属电流密度随着电位的增加而增加;在阴极极化区,金属电流密度随着电位的增加而减小。
3. 极化曲线的测量方法测量极化曲线的方法有很多种,其中最常用的是三电极法和双电极法。
以下将详细介绍这两种方法的原理和步骤。
3.1 三电极法三电极法是通过在被测金属表面插入一个参比电极和一个工作电极,通过控制参比电极和工作电极之间的电位差来测量金属的电流密度。
具体步骤如下:1.准备工作电极、参比电极和电解质溶液。
2.将工作电极和参比电极插入电解质溶液中,使其与溶液充分接触。
3.通过外部电源控制参比电极和工作电极之间的电位差,并测量工作电极的电流响应。
4.通过改变电位差,测量不同电位下的电流密度。
5.根据测量数据绘制极化曲线。
3.2 双电极法双电极法是通过在被测金属表面插入一个工作电极和一个参比电极,通过改变工作电极的电位来测量金属的电流密度。
具体步骤如下:1.准备工作电极、参比电极和电解质溶液。
2.将工作电极和参比电极插入电解质溶液中,使其与溶液充分接触。
3.通过外部电源控制工作电极的电位,并测量工作电极的电流响应。
4.通过改变工作电极的电位,测量不同电位下的电流密度。
5.根据测量数据绘制极化曲线。
4. 极化曲线求自腐蚀电流密度的方法通过测量得到的极化曲线,可以通过以下方法求得金属的自腐蚀电流密度。
4.1 Tafel斜率法Tafel斜率法是通过极化曲线的斜率来求得自腐蚀电流密度的方法。

极化曲线分析钢筋的腐蚀过程极化曲线分析钢筋的腐蚀过程摘要:为了确定混凝土中钢筋锈蚀速率的控制因素,运用腐蚀极化曲线图分析活化钢筋阴阳极极化曲线和腐蚀电流随环境相对湿度的变化规律,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程。
结果表明,有锈蚀产物存在时,锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程的阴极去极化剂,钢筋的总腐蚀电流为氧去极化和锈蚀产物去极化产生的腐蚀电流的加和。
钢筋的总腐蚀电流随着环境相对湿度的提高而增大,和氧在混凝土中的扩散速率的变化趋势截然相反,从而证明氧仅是混凝土内钢筋开始的锈蚀的必备条件,但却不是混凝中钢筋锈蚀过程控制素。
关键词:混凝土;钢筋;极化曲线;氧;腐蚀产物混凝土中钢筋的锈蚀是一个非常复杂的电化学过程,目前国内外学者在建立钢筋锈蚀速率模型时,普遍借鉴了金属腐蚀学的研究成果,假定混凝土中钢筋的锈蚀速率受氧扩散速率所控制[1-7],这种假定的正确和合理性直接决定了由此建立的理论模型的适用程度.由于金属腐蚀学研究的对象,大都是金属处于溶液、水或土壤中,整个腐蚀过程受氧扩散控制已为无数的研究所证实。
然而大气环境混凝土中钢筋的腐蚀和前几种不同,目前已有的研究发现钢筋的锈蚀速率随混凝土湿含量增大而增大,直至混凝土饱水,钢筋锈蚀速率也没有出现下降[8-9],和混凝土中氧扩散速率的变化趋势[10]截然相反,这是上述假定所无法解释的.姬永生等[11]通过试验研究和钢筋锈蚀产物物相组成的变化分析证明锈蚀产物中FeOOH可以取代氧成为钢筋锈蚀过程阴极反应的新的去极化剂,传统的氧作为单一阴极去极化剂的锈蚀机理面临着严峻的挑战。
因此,探究高湿供氧困难情况下混凝土内钢筋仍高速锈蚀的内在机理,对于建立正确、合理钢筋锈蚀速率模型具有重要的意义。
腐蚀极化曲线图是进行金属腐蚀机理分析的重要工具之一。
本文在文献[11]研究的基础上,运用腐蚀极化曲线图全面解释混凝土中钢筋锈蚀过程,探究混凝土由干燥到饱水变化过程混凝土内钢筋锈蚀速率变化的内在机理,并讨论在干湿循环过程中混凝土中钢筋的锈蚀过程,为预测钢筋混凝土的使用寿命奠定基础。

实验27 极化曲线的测定及应用一、目的要求1.掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定金属铁在H 2SO 4 溶液中的阴极极化和阳极极化曲线求算铁的自腐蚀电位、自腐蚀电流和钝化电位范围、钝化电流等参数。
2.了解不同pH 值、Cl -浓度、缓蚀剂等因素对铁电极极化的影响。
3.讨论极化曲线在金属腐蚀与防护中的应用。
二、原理Fe 在H 2SO 4 溶液中会不断溶解,同时产生H 2。
Fe 溶解:Fe -2e =Fe 2+。
H 2析出:2H ++2e = H 2。
Fe 电极和H 2电极及溶液构成了腐蚀原电池。
其腐蚀反应为:Fe +2H + = Fe 2+ + H 2 。
这是Fe 在酸性溶液中腐蚀的原因。
当电极不与外电路接通时,阳极反应速率和阴极反应速率相等,Fe 溶解的阳极电流I Fe 与H 2析出的阴极电流I H 在数值上相等但方向相反,此时其净电流为零。
I 净=I Fe + I H =0。
I corr =I Fe =-I H ≠0。
I corr 值的大小反映了Fe 在H 2SO 4 溶液中的腐蚀速率,所以称I corr 为Fe 在H 2SO4溶液中的自腐蚀电流。
其对应的电位称为Fe 在H 2SO 4 溶液中的自腐蚀电位E corr ,此电位不是平衡电位。
虽然,阳极反应放出的电子全部被阴极还原所消耗,在电极与溶液界面上无净电荷存在,电荷是平衡的。
但电极反应不断向一个方向进行,I corr ≠0,电极处于极化状态,腐蚀产物不断生成,物质是不平衡的,这种状态称为稳态极化。
它是热力学的不稳定状态。
自腐蚀电流I cor r 和自腐蚀电位E corr 可以通过测定极化曲线获得。
极化曲线是指电极上流过的电流与电位之间的关系曲线,即I=f (E )。
图27-1是用电化学工作站测定的Fe 在1.0mol/L H 2SO 4 溶液中的阴极极化和阳极极化曲线图。
ar 为阴极极化曲线,当对电极进行阴极极化时,阳极反应被抑制,阴极反应加速, 电化学过程以H 2析出为主。

一、目的和要求1、 掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定Fe 在NaCl 溶液中的极化曲线,求算Fe 的自腐蚀电位,自腐蚀电流 2、论极化曲线在金属腐蚀与防护中的应用 二、基本原理当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H +或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。
此时,金属发生阳极溶解,去极化剂发生还原。
在本实验中,镁合金和钢分别与L 的NaCl 溶液构成腐蚀体系。
镁合金与NaCl 溶液构成腐蚀体系的电化学反应式为:阳极: Mg= Mg 2++2e阴极: 2H 2O+2e=H 2+2OH -钢与NaCl 溶液构成腐蚀体系的电化学反应式为:阳极: Fe= Fe 2++2e阴极: 2H 2O+2e=H 2+2OH - @腐蚀体系进行电化学反应时的阳极反应的电流密度以 i a 表示, 阴极反应的速度以 i k 表示, 当体系达到稳定时,即金属处于自腐蚀状态时,i a =i k =i corr (i corr 为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位c ϕ。
根据法拉第定律,即在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。
金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。
因此求得金属腐蚀电流即代表了金属的腐蚀速度。
金属处于自腐蚀状态时,外测电流为零。
极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。
测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。
在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。
在活化极化控制下,金属腐蚀速度的一般方程式为:其中 I 为外测电流密度,i a 为金属阳极溶解的速度,i k 为去极化剂还原的速度,βa 、βk 分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。
实验8 极化曲线评选缓蚀剂一.目的要求:1.掌握用极化曲线Tafel区外推法测定金属腐蚀速度的原理及方法。
2.掌握评选缓蚀剂的原理及方法。
3.评定乌洛托品在盐酸中的缓蚀效率。
二.基本原理:利用近代的电化学测试技术,可以测得以自然腐蚀电位为起点的完整的极化曲线。
如图8—1所示:图8—1 外加电流的活化激化曲线在开始时,把极化电位控制的很低,然后逐渐提高极化电位,这样的极化曲线可以分三个区:(1)线性区——直线AB段(2)弱极化区——曲线BC段(3)Tafel区——直线CD段把Tafel区CD段(在ф——㏒I图上)的切线外推与自然腐蚀电位фc的水平线相交于O点,此点所对应的电流密度即为金属的自然腐蚀电流密度i c,根据法拉第定律,即可以把i c换算为腐蚀重量或腐蚀深度。
对于阳极极化曲线不易测准的体系,常常只由阴极极化曲线的Tafel直线外推与фc的水平线相交以求出i c 这种以利用极化曲线的Tafel区直线外推以求腐蚀速度的方法称之为极化曲线法或Tafel线外推法。
它有许多局限性:它只适用于在Tafel区的电极过程服从于指数定律的腐蚀体系,如放氢型的腐蚀。
对于浓差极化较大的体系,对于电阻较大的溶液在强烈激化时金属表面发生较大变化(如膜的生成或溶解)的情况就不适用。
此外,在外推做图时也回引入较大的误差。
用极化曲线评选缓蚀剂是基于缓蚀剂回阻滞腐蚀的电极过程,降低腐蚀速度,从而改变受阻滞的电极过程的极化曲线的走向,见图8—2图8—2缓蚀剂阻滞电极过程的极化曲线由图8—2可见,未加缓蚀剂时,阴极阳极极化曲线相交于S0点,腐蚀电流为I0,加缓蚀剂之后,阴极阳极极化曲线相交于S点,腐蚀电流为I,而I比I0要小的多。
可见缓蚀剂明显地减缓了腐蚀。
根据缓蚀剂所阻滞的电极过程,可以把缓蚀剂分为阴极型,阳极型和混合型。
缓蚀剂的缓蚀率也可以直接用腐蚀电流来计算:Z=(I0-I)/I0×100%式中:Z——缓蚀剂的缓蚀效率(%)I0——不加缓蚀剂时金属在介质中的腐蚀电流I——加缓蚀剂之后在腐蚀介质中的腐蚀电流(也可以用电流密度来表示)。
极化曲线腐蚀电流与腐蚀电位1. 引言极化曲线是研究金属腐蚀过程中重要的工具之一。
通过测量极化曲线,可以了解金属在不同电位下的腐蚀行为,并确定其腐蚀电流和腐蚀电位。
本文将介绍极化曲线的概念、测量方法以及与腐蚀电流和腐蚀电位的关系。
2. 极化曲线的概念极化曲线是描述金属在外加电势下的电流密度变化情况的曲线。
它通常由三个区域组成:主动区、过渡区和从动区。
•主动区:当金属处于正常工作状态时,其表面通常保持较低的电流密度,这个区域被称为主动区。
•过渡区:当金属表面开始发生氧化或还原反应时,其电流密度逐渐增大,这个过程称为过渡区。
•从动区:当金属表面完全被氧化或还原时,其电流密度达到最大值,这个区域称为从动区。
3. 极化曲线的测量方法测量极化曲线通常使用电化学工作站或极谱仪。
以下是一般的测量步骤:1.准备工作:清洗待测试的金属样品,确保其表面干净无杂质。
2.设置电化学工作站或极谱仪:根据实验要求设置工作站的参数,如扫描速率、起始电位等。
3.测量极化曲线:将待测试的金属样品放置在电解槽中,通过改变外加电势的大小并记录对应的电流密度,得到极化曲线。
4.数据处理:根据测得的数据绘制极化曲线,并计算腐蚀电流和腐蚀电位。
4. 腐蚀电流与腐蚀电位的关系腐蚀电流和腐蚀电位是描述金属在腐蚀环境中耐久性能的重要参数。
4.1 腐蚀电流腐蚀电流是指金属在给定环境条件下发生氧化或还原反应时所产生的电流密度。
它可以通过测量极化曲线中从动区对应点处的电流密度来确定。
腐蚀电流的大小与金属的耐蚀性能密切相关,一般情况下,腐蚀电流越大,金属的耐蚀性能越差。
4.2 腐蚀电位腐蚀电位是指金属在给定环境条件下开始发生氧化或还原反应的电势。
它可以通过测量极化曲线中过渡区对应点处的电势来确定。
腐蚀电位的高低决定了金属在给定环境中是否会发生腐蚀反应。
一般情况下,腐蚀电位越低,金属的耐久性能越差。
4.3 腐蚀电流与腐蚀电位的关系在极化曲线上,从动区对应点处的电流密度与过渡区对应点处的电势之间存在一种关系。
极化曲线年腐蚀速率
极化曲线和年腐蚀速率是描述金属腐蚀行为的两个重要概念。
极化曲线:
极化曲线是一种电化学测量方法,用于描述电极电位与电流之间的关系。
在金属腐蚀过程中,极化曲线可以用来研究金属的腐蚀和防护机制。
通过测量不同时间点的电流和电位,可以获得金属腐蚀速率与电化学参数之间的关系。
极化曲线通常可以通过线性拟合或非线性拟合方法进行处理和分析。
年腐蚀速率:
年腐蚀速率是指金属材料在特定环境条件下,每年被腐蚀的平均速率。
它是一个衡量金属耐蚀性的重要指标,通常以质量损失或厚度损失的形式来表示。
年腐蚀速率可以通过对金属材料进行长期腐蚀试验或现场腐蚀监测来获得。
在实际应用中,年腐蚀速率可以用来评估金属材料的耐久性和使用寿命,并指导防腐措施的选择和应用。
两者关系:
极化曲线和年腐蚀速率之间存在密切的关系。
极化曲线可以用来预测金属在不同环境条件下的年腐蚀速率。
通过比较不同环境下的极化曲线,可以评估不同环境对金属耐蚀性的影响。
此外,年腐蚀速率也可以用来验证和校准极化曲线模型的准确性。
在实际应用中,极化曲线和年腐蚀速率可以结合起来指导金属材料的防腐措施和选材。
总的来说,极化曲线和年腐蚀速率是两个相互关联的概念,它们共同描述了金属腐蚀行为和耐蚀性能。
通过测量和分析这两个参数,可以更好地理解和预测金属在各种环境条件下的腐蚀行为,为防腐措施和选材提供重要的依据。
极化曲线在电化学腐蚀中的应用娄浩(班级:材料化学13-1 学号:120133202059) 关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。
其中电化学腐蚀是金属腐蚀的一种最普遍的形式。
论文分析了电化学腐蚀的机理以及极化曲线的理论基础。
利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。
1.金属腐蚀的电化学原理金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。
通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。
所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。
其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。
腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。
电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。
任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属内部的电子流和介质中的离子流形成回路[4]。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。
例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即阳极反应:Fe - 2e →Fe2+阴极反应:2H+ + 2e →H2总反应:Fe + 2H+ →Fe2+ + H2与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。
由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生[6]。
2极化曲线在电镀中的应用镀层质量与电极极化有极其密切的联系,如镀层结晶的细致程 度、光亮度、整平度与分散能力等评定镀层质量的主要指标,都直 接受电极极化行为的影响,而电极的极化行为,则依赖于极化曲线 的测量。
一般地,凡能适当增大阴极极化度的各种因素,均能提高镀层 的细致程度、光亮度、整平度与分散能力,因此,通过极化曲线可 从理论上直观地分析各种工艺条件对镀层质量的影响,并进行选 择,然后结合赫尔槽试验和电镀生产实践确定最优的工艺参数。
下 面分别叙述极化曲线在电镀中的应用。
(1) 镀液性能的比较与选择图2 — 4所示为室温下测得的五种镀锌液的阴极极化曲线,可 见在相同的电流密度下(如2A / dm ?),它们所对应的阴极电位依次 趋负,这说明在1〜5号溶液中,第5号溶液产生的阴极极化作用 最大,其余依次递减。
从镀液的组成可见,单纯的氧化锌溶液不如 加入氯化铵的溶液极化作用大,但这种极化的增大,又不如再加入 氨三乙酸后显著。
由此可见,氨三乙酸是无氰镀锌的一种较好的络 合剂。
同时添加剂聚乙二醇和硫脲可使极化进一步提高,从而可能 获得细致、光亮与分散能力强的镀锌层。
通过上述分析可知第4号 溶液可初步定为较理想的无氰镀锌溶液,其实用性如何,有待生产 实践的检验。
图中曲线5是在氰化物镀液中测得的,它的极化作用 最大,这正是它易获得优质锌层的主要原因。
图2—4镀锌溶液极化曲线1 一 ZnCl2 50g / L 2--ZnCI ?50g / L+NH 4CJ50g / L ;3 — ZnCI 2 50g/ L+NH 4C1250g / L+ 氨三乙酸 40g / L;4 一 ZnCI 250g / L+NH 4Ch50g /L+氨三乙酸40g / L+硫脲2g / L+聚乙二醇2g / L ; 5 一氰化镀锌液锌液0 -1 4 -16 -IB -20 吋招对傅刚扌4电IftZ 图2 — 5几种碱性镀锌液的阴极极化曲线1 一 Zn010g / L+NaOH lOOg/ L; 2 一 Zn 010g / L+NaOH 70g / L+ 三乙醇胺 20g / L+ 乙二胺 5g /L+ 六次甲基次胺 3g / L+ 明胶 lg / L ; 3 一 Zn0 20g / L+KOH 70g / L+三乙醇胺l00g / L+KCl l0g / L+添加剂(环氧氯丙烷与六次甲基四胺的 反应物)适量;4 一 Zn035g / L+NaCN 90g / L+NaOH 75g / L+Na2S 2g / L图2-5所示为几种碱性镀锌液的阴极极化曲线。
极化曲线在电化学腐蚀中的应用娄浩(班级:材料化学13-1 学号:120133202059) 关键词:电化学腐蚀;极化;极化曲线;极化腐蚀图据工业发达国家统计,每年由于腐蚀造成的损失约占国民生产总值的l~4%,世界钢铁年产量约有十分之一因腐蚀而报废,因此研究金属腐蚀对于国民经济发展和能源的合理利用具有重大意义。
其中电化学腐蚀是金属腐蚀的一种最普遍的形式。
论文分析了电化学腐蚀的机理以及极化曲线的理论基础。
利用测量极化曲线的方法,研究金属腐蚀过程,已经得到广泛的应用。
1.金属腐蚀的电化学原理金属腐蚀学是研究金属材料在其周围环境作用下发生破坏以及如何减缓或防止这种破坏的一门科学[1]。
通常把金属腐蚀定义为:金属与周围环境(介质)之间发生化学或电化学而引起的破坏或变质。
所以,可将腐蚀分为化学腐蚀和电化学腐蚀[2]。
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。
其反应的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成腐蚀产物[3]。
腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。
电化学腐蚀是指金属表面与电子导电的介质(电解质)发生电化学反应而引起的破坏。
任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属内部的电子流和介质中的离子流形成回路[4]。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。
例如,碳钢[5]在酸中腐蚀,在阳极区Fe被氧化成Fe2+所放出的电子自阳极Fe流至钢表面的阴极区(如Fe3C)上,与H+作用而还原成氢气,即阳极反应:Fe - 2e →Fe2+阴极反应:2H+ + 2e →H2总反应:Fe + 2H+ →Fe2+ + H2与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。
由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生[6]。
电化学腐蚀是最普遍、最常见的腐蚀。
金属在大气、海水、土壤和各种电解质溶液中的腐蚀都属此类。
2.腐蚀电池的电极过程2.1 阳极过程腐蚀电池中电位较负的金属为阳极,发生氧化反应。
因此,阳极过程就是阳极金属发生电化学溶解或阳极钝化的过程。
M n+·ne + mH2O→M n+·mH2O + ne即金属表面晶格中的金属阳离子,在极性水分子作用下进入溶液,变成水化阳离子;而电子在阴、阳极电位差的作用下移向阴极,将进一步促进上述阳极反应的进行。
对于完整晶体的阳极溶解总是开始于晶格的顶端或边缘[7]。
而工业金属常存在异相析出或非金属夹杂,它们会引起晶格畸变,能量增高,使该处的金属原子容易溶解到溶液中去。
同样,晶格缺陷,如位错的露头点,滑移台阶处,也容易溶解。
溶液中的某些组分也容易吸附到这些晶体缺陷处,起到加速或抑制阳极溶解的作用。
当吸附的溶液在组分能与金属离子生成吸附络合物时,可降低阳极溶解活化能,从而促进阳极过程;反之,若溶液组分在金属表面上形成吸附阻挡层时,将妨碍金属离子进入溶液,从而抑制阳极过程。
2.2 阴极过程腐蚀电池的阴极过程指电解质溶液中的氧化剂与金属阳极溶解后释放出来并转移到阴极区的电子相结合的反应过程。
电化学腐蚀的阴极去极化剂和阴极还原反应主要是H+和溶液中的氧的还原反应。
(1)氢离子还原反应或析氢反应2H+ + 2e→H2此反应是电位较负的金属在酸性介质中腐蚀时常见的阴极去极化反应。
Zn、Al、Fe等金属的电极电位低于氢的电极电位。
因此这些金属在酸性介质中的腐蚀将伴随着氢气的析出,叫做析氢腐蚀。
腐蚀速度受阴极过程控制,且与析氢过电位的大小有关。
(2)溶液中溶解氧的还原反应在中性或碱性溶液中,发生氧化还原反应,生成OH- 离子:O2 + 2H2O + 4e→4OH-(3)在酸性溶液中发生氧还原反应,生成水:O2 + 4H++ 4e→2H2O阴极过程为氧的还原反应的腐蚀,叫吸氧腐蚀。
这是最普遍的一种电化学腐蚀。
大多数金属在大气、土壤、海水和中性盐溶液中的腐蚀主要靠氧的阴极还原反应,其腐蚀速度通常受氧扩散控制[8]。
在含氧的酸性介质中腐蚀时有可能同时发生上述H+离子和O2的两种还原反应。
3.金属腐蚀的极化现象当电极上有净电流通过时,电极电位显著偏离了未通电时开路电位(平衡电位或非平衡的稳态电位),这种现象叫做电极的极化。
3.1 阳极极化阳极上有电流通过时,其电位向正方向移动,称为阳极极化。
产生阳极极化的原因是:(1)活化极化因为阳极过程是金属离子从基体转移到溶液中,并形成水化离子的过程。
如果金属离子进入溶液的反应速度小于电子由阳极通过导线流向阴极的速度,则阳极就会有过多的正电荷积累,改变双电层电荷分布及双电层间的电位差,使阳极电位向正向移动,由于反应需要一定的活化能,使阳极溶解反应的速度迟缓于电子移去的速度,由此引起的极化叫活化极化。
(2)浓差极化阳极溶解产生的金属离子,首先进入阳极表面附近的液层中,使与溶液深处产生浓差。
在此浓度梯度下金属离子向溶液深处扩散。
但由于扩散速度不够快,致使阳极附近金属离子的浓度逐渐增高,阻碍阳极的进一步溶解。
这犹如该电极插入高浓度金属离子的溶液中,因此电位变正,产生阳极极化。
(3)电阻极化当金属表面有氧化膜,或在腐蚀过程中形成膜时,金属离子通过这层膜进入溶液中,或者阳极反反应生成的水化离子通过膜中充满电解液的微孔时,都有很大电阻。
阳极电流在此膜中产生很大的电压降,从而使电位显著变正。
由此引起的极化叫做电阻极化。
阳极极化可减缓金属腐蚀。
阳极极化程度的大小,直接影响阳极过程进行的速度。
通常用极化曲线来判断极化程度的大小。
极化曲线是表示电极电位与通过的电流密度之间的关系曲线。
曲线的倾斜程度表示极化程度,叫做极化度。
曲线越陡,极化度就越大,表示电极过程受阻滞程度越大,进行越困难。
3.2 阴极极化阴极上有电流通过时,电位向负方向移动,这种现象叫做阴极极化。
阴极极化的原因有:(1)活化极化(电化学极化)由于阴极还原反应需达到一定的活化能才能进行,使阴极还原反应速度小于电子进入阴极的速度,因而电子在阴极积累,结果使阴极电位向负方向移动,产生了阴极极化。
这种阴极极化是由于阴极还原反应本身的迟缓性造成的,称为活化极化或电化学极化。
(2)浓差极化.由于阴极附近反应物或反应产物扩散速度的缓慢,可引起阴极浓差极化。
例如,溶液中的氧或氢离子到达阴极的速度小于阴极反应本身的速度,造成阴极表面附近氧或氢离子的缺乏,结果产生浓差极化,使阴极电位变负。
阴极极化表示阴极过程受到阻滞,使来自阳极的电子不能及时被吸收,因此阻碍金属腐蚀的进行。
反之,消除阴极极化的过程叫做阴极去极化。
阴极去极化的作用,使阴极过程顺利进行,因此可维持或加速腐蚀过程。
4.腐蚀极化图图2-4为一腐蚀电池。
开路时,测得阴、阳极的电位分别为Eoc和EoA。
然后用高阻值的可变电阻把二电极连接起来,依次使电阻R值由大变小,电流则由零逐渐变大,相应地测出各电流强度下的电极电位,绘出阴、阳极电位与电流强度的关系图,如图2-5就是腐蚀极化图。
由图可见,电流随电阻尼减小而增加,同时电流的增加引起电极极化:使阳极电位变正,阴极电位变负,从而使两极间的电位差变小。
由于足是任意调节的,R 减小对电流的影响远远超过电位差减小对电流的影响。
故总结果使电流趋于增大。
当包括电池内、外电阻在内的总电阻减小趋近于零时,电流达到最大值Imax 。
此时阴、阳极极化曲线将交于S 点[9]。
这时阴、阳极电位相等,即电位差为零。
但实际上得不到交点S 。
因为总电阻不可能等于零,即使两电极短路,外电阻等于零,仍有电池的内阻存在。
因此,电流只能接近于Imax 。
腐蚀极化图是一种电位—电流图,它是把表征腐蚀电池特征的阴、阳极极化曲线画在同一张图上构成的。
为了方便起见,常常忽略电位随电流变化的细节,将极化曲线画成直线形式。
这样可得到如图2-6所示的简化的腐蚀极化图,也称为Evans图。
图中阴、阳极的起始电位为阴极反应和阳极反应的平衡电位,分别以Eoc和EoA 表示。
若忽略溶液电阻,图中简化的极化曲线可交于一点S。
交点对应的电位,叫混合电位,处于两电极电位之间。
由于此阴、阳极反应构成了腐蚀过程,所以混合电位就是自腐蚀电位,简称为腐蚀电位,用Ecorr表示。
显然,腐蚀电位是一种不可逆的非平衡电位,可由实验测得。
图中与腐蚀电位对应的电流叫做腐蚀电流。
金属就是以此电流表示的速度不断地腐蚀着。
一般情况下,腐蚀电池中阴极和阳极面积是不相等的,但稳态下流过的电流强度是相等的,因此用E-I 极化图较为方便。
对于均匀腐蚀和局部腐蚀都适用。
在均匀腐蚀条件下,整个金属表面同时起阴极和阳极的作用,可以采用电位一电流密度极化图。
5.结论腐蚀极化图是研究电化学腐蚀的重要工具[10],用途很广。
利用极化图可以确定腐蚀的主要控制因素,解释腐蚀现象,分析腐蚀过程的性质和影响因素,判断添加剂的作用机理,以及用图解法计算多电极体系的腐蚀速度等。
可以说,极化图构成了电化学腐蚀的理论基础,是腐蚀科学最终的理论工具。
参考文献:[1]刘永辉,张佩芬.金属腐蚀学原理[M].北京:航空工业出版社,1993:1-6[2]李荻主编.电化学原理[M].北京:北京航空航天大学出版社,2002:56—61[3]杨辉,卢文庆编著.应用电化学[M].北京:科学出版社,2002:82—91[4]吴开源,王勇,赵卫民.金属结构的腐蚀与防护[M].山东东营:中国石油大学出版社,2004:14-17[5]俞蓉蓉,蔡志章主编.地下金属管道的腐蚀与防护[M].北京:石油工业出版社,1998:2-3[6]Christopher M.A.Brett and Maria Oliveira Brett.Electrochemistry-Principles,Methodsand Applications[M].UK:Oxford University Press,1993.102-106[7]张祖训,汪尔康编著.电化学原理和方法[M].北京:科学出版社,2000:34-40[8]J.Wang.Analytical Electrochemistry[M].(2nd Ed.),John Wiley & Sons,Inc.,2001:71-74[9]彭图治,王国顺主编.分析化学手册,第四分层,电分析化学[M].北京:化学工业出版社,1999:63-65[10]高小霞等著.电分析化学导论[M].北京:科学出版社,1986:86—89。