九年级上册常见化合物的化学式及名称
- 格式:doc
- 大小:26.00 KB
- 文档页数:2
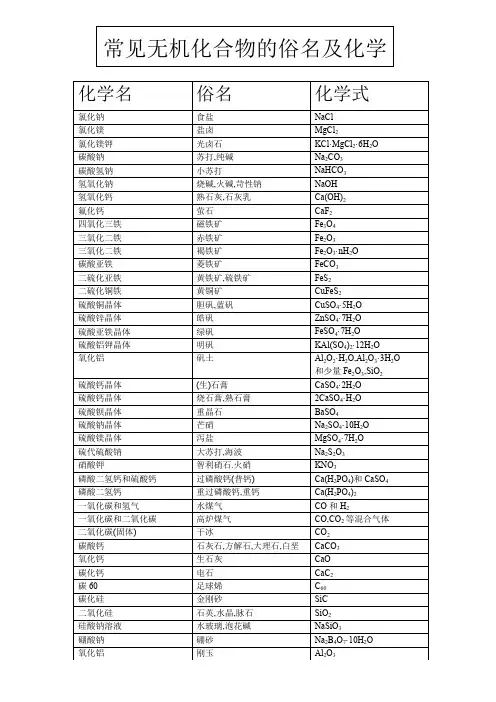
常见无机化合物的俗名及化学化学名俗名化学式氯化钠食盐NaCl氯化镁盐卤MgCl2氯化镁钾光卤石KCl·MgCl2·6H2O碳酸钠苏打,纯碱Na2CO3碳酸氢钠小苏打NaHCO3氢氧化钠烧碱,火碱,苛性钠NaOH氢氧化钙熟石灰,石灰乳Ca(OH)2氟化钙萤石CaF2四氧化三铁磁铁矿Fe3O4三氧化二铁赤铁矿Fe2O3三氧化二铁褐铁矿Fe2O3·nH2O碳酸亚铁菱铁矿FeCO3二硫化亚铁黄铁矿,硫铁矿FeS2二硫化铜铁黄铜矿CuFeS2硫酸铜晶体胆矾,蓝矾CuSO4·5H2O硫酸锌晶体皓矾ZnSO4·7H2O硫酸亚铁晶体绿矾FeSO4·7H2O硫酸铝钾晶体明矾KAl(SO4)2·12H2O氧化铝矾土Al2O2·H2O,Al2O3·3H2O和少量Fe2O3,SiO2硫酸钙晶体(生)石膏CaSO4·2H2O硫酸钙晶体烧石膏,熟石膏2CaSO4·H2O硫酸钡晶体重晶石BaSO4硫酸钠晶体芒硝Na2SO4·10H2O硫酸镁晶体泻盐MgSO4·7H2O硫代硫酸钠大苏打,海波Na2S2O3硝酸钾智利硝石.火硝KNO3磷酸二氢钙和硫酸钙过磷酸钙(普钙) Ca(H2PO4)和CaSO4磷酸二氢钙重过磷酸钙,重钙Ca(H2PO4)2一氧化碳和氢气水煤气CO和H2一氧化碳和二氧化碳高炉煤气CO,CO2等混合气体二氧化碳(固体) 干冰CO2碳酸钙石灰石,方解石,大理石,白垩CaCO3氧化钙生石灰CaO碳化钙电石CaC2碳60 足球烯C60碳化硅金刚砂SiC二氧化硅石英,水晶,脉石SiO2硅酸钠溶液水玻璃,泡花碱NaSiO3硼酸钠硼砂Na2B4O7·10H2O氧化铝刚玉Al2O3硅酸铝高岭石Al2(Si2O5)(OH)4或(Al2O·2SiO2·2H2O)硅酸铝钾正长石KAlSi3O8亚铁氰化钾黄血盐K4[Fe(CN)6]铁氰化钾赤血盐K3[Fe(CN)6]碱式碳酸铜铜绿Cu2(OH)2CO3---------------- 漂白粉Ca(ClO)2和CaCl2---------------- 王水浓HNO3和浓HCl(1:3)氧化砷砒霜As2O3硫化砷雄黄As2S3氧化亚汞甘汞Hg2Cl2常见有机化合物的俗名及化学式化学名俗名化学式甲烷沼气,坑气,天然气的主要成分CH4碳酰胺尿素CO(NH2)2甲醛福尔马林,蚁醛HCHO甲酸蚁酸HCOOH三氯甲烷氯仿CHCl3三碘甲烷碘仿CHI3乙炔电石气C2H2乙酸醋酸CH3COOH乙二酸草酸HOOC-COOH2-羟基丙酸乳酸CH3CHOHCOOH乙醇酒精,木精(工业酒精) CH3CH2OH六氯环己烷六六六C6H6Cl6丙三醇甘油C3H5(OH)3苯酚石炭酸C6H5OH苯甲酸安息香酸C6H5COOH十八碳-9-烯酸油酸C17H33COOH十八烷酸硬脂酸C17H35COOH十六烷酸软脂酸C17H31COOH2,4,6-三硝基甲苯TNT C6H2(CH3)(N02)3三硝酸甘油酯硝化甘油C3H5(ONO2)3氨基乙酸甘氨酸CH2(NH2)COOHα-氨基丙酸丙氨酸CH3CH(NH2)COOHα-氨基戊二酸谷氨酸HOOC(CH2)2CH(NH2)COOHα-氨基戊二酸单钠味精NaOOC(CH2)CH(NH2)COOH 二氟二氯甲烷氟利昂-12 CCl2F2。
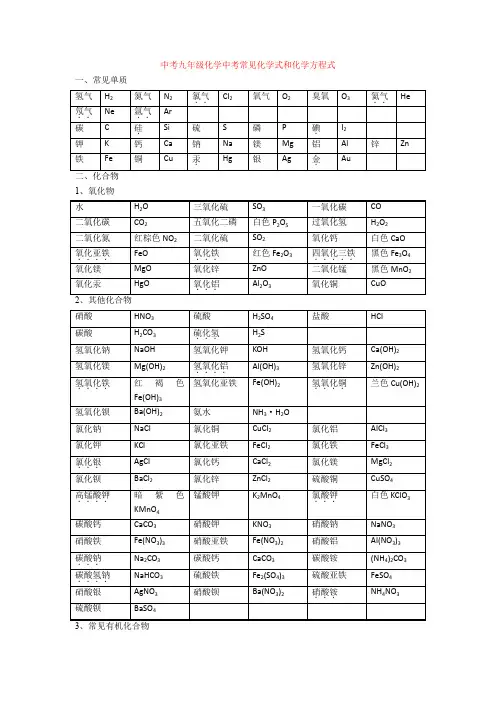
中考九年级化学中考常见化学式和化学方程式一、常见单质1、氧化物一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O 2 2P 2O 52、氢气在空气中燃烧生成水:2H 2 + O 2 2H O3、硫磺在空气(或氧气)中燃烧:S + O 2 SO 24、镁条在空气(或氧气)中燃烧:2Mg + O 2 2MgO5、铁丝在氧气..中燃烧:3Fe + 2O 2 Fe 3O 46、木炭在空气(或氧气)中完全燃烧:C + O 2 CO 27、木炭不充分燃烧:2C + O 2 2CO 8、一氧化碳燃烧:2CO + O 2 2CO 29、二氧化碳、二氧化硫三氧化硫分别和水反应生成相应的酸:CO 2 + H 2O == H 2CO 3 SO 2 + H 2O == H 2SO 3 (亚硫酸) SO 3 + H 2O == H 2SO 410、二氧化碳通过灼热的炭层:CO 2 + C 2CO11、生石灰与水反应:CaO + H 2O == Ca(OH)2 二、分解反应12、高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑13、氯酸钾制氧气:2KClO 3 2KCl + 3O 2↑14、双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 15、电解水:2H 2O 2H ↑+ O 2↑ 16、碳酸分解:H 2CO 3 H 2O + CO 2↑17、高温煅烧石灰石:CaCO 3 CaO +CO 2↑点燃点燃点燃点燃点燃点燃点燃 高温点燃△MnO 2△ MnO 2通电高温三、置换反应18、铜和硝酸银溶液反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)219、铁和硫酸铜溶液反应:Fe + CuSO 4 == Cu + FeSO 420、锌、铁、镁、铝分别和硫酸反应:Zn + H 2SO 4 == ZnSO 4 + H 2↑ Fe + H 2SO 4 == FeSO 4 + H 2↑ Mg + H 2SO 4 == MgSO 4 + H 2↑ 2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑21、锌、铁、镁、铝分别和盐酸反应:Zn + 2HCl == ZnCl 2 + H 2↑ Fe + 2HCl == FeCl 2+ H 2↑ Mg + 2HCl == MgCl 2 + H 2↑ 2Al + 6 HCl == 2AlCl 3 + 3H 2↑22、木炭还原氧化铁:3C + 2Fe 2O 3 4Fe + 3CO 2↑木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑ 四、复分解反应 (一)酸 + 碱 → 盐 + 水23、氢氧化钠分别与盐酸、硫酸反应:NaOH + HCl == NaCl + H 2O 2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O24、氢氧化铜分别与盐酸、硫酸反应:Cu(OH)2 + 2HCl == CuCl 2 + 2H 2O Cu(OH)2 + H 2SO 4 == CuSO 4 + 2H 2O25、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl 3 + 3H 2O26、氢氧化镁分别与盐酸、硫酸反应:Mg(OH)2 + 2HCl == MgCl 2 + 2H 2O Mg(OH)2 + H 2SO 4 == MgSO 4 + 2H 2O27、氢氧化铁分别与盐酸、硫酸反应:Fe(OH)3 + 3HCl == FeCl 3 + 3H 2O Fe(OH)3 + 3 H 2SO 4 == Fe 2(SO 4)3 + 3H 2O28、氢氧化钙分别与盐酸、硫酸反应:Ca(OH)2 + 2HCl == CaCl 2 + 2H 2O Ca(OH)2 + H 2SO 4 == CaSO 4 + 2H 2O(二)酸 + 盐 → 另一种酸 + 另一种盐29、盐酸与硝酸银溶液反应:HCl + AgNO 3 == AgCl ↓+ HNO 330、氯化钡溶液与硫酸溶液反应:BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl高温高温31、碳酸钠与稀盐酸:Na2CO3 + 2HCl == 2NaCl+ H2O + CO2↑32、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑33、碳酸氢钠用于治疗胃酸过多:NaHCO3 + HCl == NaCl+ H2O + CO2↑34、碳酸钡与盐酸反应:BaCO3+2HCl = BaCl2+H2O+CO2↑(三)碱溶液..→另一种碱 + 另一种盐.. + 盐溶液35、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓36、氯化铁溶液和氢氧化钠溶液反应:FeCl3+3NaOH==Fe(OH)3↓+3NaCl37、碳酸钠溶液和石灰水反应:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH(四)盐溶液..→两种新盐.. + 盐溶液38、硝酸银溶液与氯化钠溶液反应:AgNO3 + NaCl == AgCl↓+ NaNO339、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3 = BaCO3↓+ 2NaCl40、氯化钡溶液与硫酸钠溶液反应:BaCl2+ Na2SO4 = BaSO4↓+ 2NaCl(五)金属氧化物 + 酸→盐 + 水41、稀盐酸或稀硫酸清洗铁锈:6HCl + Fe2O3 == 2FeCl3 + 3H2OFe2O3 + 3 H2SO4 == Fe2(SO4)3 + 3H2O42、氧化铜分别与稀硫酸、稀盐酸反应:CuO + H2SO4== CuSO4+ H2OCuO + 2HCl == CuCl2 + 2H2O五、其他反应类型43、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2 == CaCO3↓+ H2O(验证二氧化碳)44、二氧化碳与氢氧化钡反应:CO2 + Ba(OH)2 == BaCO3↓+ H2O45、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3 + H2O(吸收二氧化碳)46、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O (用于吸收二氧化硫)(亚硫酸钠)47、氢氧化钠溶液吸收三氧化硫:SO3 + 2NaOH==Na2SO4+ H2O48、三氧化硫与氢氧化钡反应:SO 3+ Ba(OH)2 == BaSO 4↓+ H 2O49、一氧化碳还原氧化铜:CO + CuO Cu + CO 2 50、一氧化碳还原氧化铁:3CO + Fe 2O 3 2Fe+3CO 51、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O 52、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O一、初中化学常见物质的颜色(一)、固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁 (二)、液体的颜色 11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液(三)、气体的颜色 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体二、初中化学溶液的酸碱性1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠、碳酸钾等)△点燃点燃△3、显中性的溶液:水和大多数的盐溶液三、初中化学敞口置于空气中质量改变的(一)质量增加的1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙(二)质量减少的1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水2、由于风化而减少的:碳酸钠晶体四、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验. 6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl 17、检验三瓶试液分别是稀HNO3,稀HCl,稀H2SO4? 向三只试管中分别滴加Ba(NO3)2 溶液,若产生白色沉淀,则是稀H2SO4;再分别滴加AgNO3溶液,若产生白色沉淀则是稀HCl,剩下的是稀HNO318、淀粉:加入碘溶液,若变蓝则含淀粉19、葡萄糖:加入新制的氢氧化铜,若生成砖红色的氧化亚铜沉淀,就含葡萄糖五、初中化学之三1、我国古代三大化学工艺:造纸,制火药,烧瓷器。

人教版初三化学需要背诵的化学式一、介绍化学式是化学元素或化合物的符号表示法,是化学中的基本概念之一。
在初中化学学习中,掌握化学式是非常重要的,不仅是理论学习的基础,也是实验操作的必备知识。
人教版初三化学需要背诵的化学式,涉及到元素的符号、化合物的组成以及化学反应等内容。
二、常见元素的化学式1. 氢:H2. 氦:He3. 铍:Be4. 碳:C5. 氮:N6. 氧:O7. 氟:F8. 钠:Na9. 镁:Mg10. 铝:Al11. 锌:Zn12. 铁:Fe13. 铜:Cu三、常见化合物的化学式1. 氨气:NH32. 氯化钠:NaCl3. 氧化铜:Cu2O4. 二氧化碳:CO25. 一氧化碳:CO6. 亚硝酸盐:NO2-7. 硫酸:H2SO48. 碳酸钠:Na2CO39. 铝矾:Al2(SO4)310. 硫化氢:H2S11. 过氧化氢:H2O212. 白砷:As2O3四、化学反应中的化学式1. 直接组成反应:例如氢气与氧气的反应生成水,化学式为2H2 + O2 → 2H2O2. 分解反应:例如过氧化氢分解成水和氧气,化学式为2H2O2 → 2H2O + O23. 单一置换反应:例如锌与盐酸生成氢气和氯化锌,化学式为Zn + 2HCl → ZnCl2 + H24. 双置换反应:例如氯化钠与硫酸反应生成盐酸和硫酸钠,化学式为NaCl + H2SO4 → HCl + Na2SO45. 酸碱中和反应:例如氢氧化钠与硫酸反应生成水和硫酸钠,化学式为2NaOH + H2SO4 → 2H2O + Na2SO4五、总结人教版初三化学需要背诵的化学式,包括常见元素的化学式、常见化合物的化学式以及化学反应中的化学式。
通过背诵这些化学式,可以帮助学生牢固掌握这些基本的化学知识,为进一步深入学习化学打下坚实的基础。
在日常的学习中,可以通过多种方式来背诵和巩固这些化学式,如制作化学式卡片、做化学式练习题等。
希望学生们能够重视化学式的背诵,从而在化学学习中取得更好的成绩。

精心整理常用物质的化学名称、化学式及反应的化学方程式:一、单质:1、常见气体:氧气:O2氢气:H2氯气:Cl2氮气:N22、稀有气体:氦气:He氖气:Ne氩气:Ar3、金属和非金属单质(1)金属单质:锂:Li铍:Be钠:Na镁:Mg铝:Al钾:K钙:Ca铜:Cu铁:Fe锌:Zn钡:Ba 银:Ag汞:Hg(2)非金属单质:碳:C硅:Si磷:P硫:S二、化合物二、制取气体的化学方程式:1(1)2KClO 3↑(2)2MnO 4+MnO 2+O 2↑(3)2H 2O 2(4)2H 22(1)(2)(3)2(4)3、制取氢气的化学方程式:(1)镁、铝、铁、锌与稀盐酸反应制取H 2:Mg +2HCl =MgCl 2+H 2↑2Al +6HC l =2AlCl 3+3H 2↑ (24(1(2Na 2注意:①往NaOH 溶液中通入CO 2,会发生反应2NaOH+CO 2=====Na 2CO 3+H 2O ;若继续通入Na 2CO 3+H 2O +CO 2===2NaHCO 3而2CO 3+H 2O +CO 2↑②往Ca(OH)2溶液中通入CO 2,会发生反应Ca(OH)2+CO 2====CaCO 3↓+H 2O 若继续通入CO 2,CaCO 3会逐渐溶解,则会发生反应CaCO 3+2===2Ca(HCO 3)2Ca(HCO 3)3↓+H 2O +CO 2↑形成钟乳石、石笋等5、生成陈定的化学方程式:(1)生成BaSO4白色沉淀,不溶于稀HNO3。
离子方程式:Ba2++SO42—=BaSO4↓Ba(OH)2+H2SO4=BaSO4↓+2H2OBa(NO3)2+H2SO4=BaSO4↓+2HNO3Ba(OH)2+Na2SO4=BaSO4↓+2NaOHBa(NO3)2+Na2SO4=BaSO4↓+2NaNO3Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2Ba(OH)2+K2SO4=BaSO4↓+2KOHBa(NO3)2+K2SO4=BaSO4↓+2KNO3 BaCl2+H2SO4=BaSO4↓+2HClBaCl2+Na2SO4=BaSO4↓+2NaClBaCl2+CuSO4=BaSO4↓+CuCl2(2)生成AgCl白色沉淀,不溶于稀HNO3。

常见化学式和化学方程式含答案【常见化学式和化学方程式含答案】化学式和化学方程式是化学中常见的表达方式,用于表示化学物质的组成和反应过程。
它们是化学语言的基础,有助于我们理解和描述化学现象。
本文将介绍一些常见的化学式和化学方程式,并提供相应的答案。
一、常见化学式1. 金属氧化物:金属氧化物是由金属原子和氧原子结合形成的化合物,常见的有氧化钠(Na2O)、氧化铁(Fe2O3)、氧化铝(Al2O3)等。
2. 盐类化合物:盐类是由阳离子和阴离子组成的化合物,常见的有氯化钠(NaCl)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)等。
3. 碱金属:碱金属是指周期表第一族元素,常见的有锂(Li)、钠(Na)、钾(K)等。
它们的化学式为Li、Na、K。
4. 酸类:酸是指能够产生H+离子的化合物,常见的有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)等。
5. 水:水的化学式为H2O,它是一种无色、无味、无臭的液体,是地球上最常见的化合物。
二、常见化学方程式1. 酸碱中和反应:酸与碱反应会产生盐和水,简称为酸碱中和反应。
例如,盐酸与氢氧化钠的反应方程式为HCl + NaOH → NaCl + H2O。
2. 金属与酸反应:金属与酸反应会产生盐和氢气。
例如,锌与硫酸的反应方程式为Zn + H2SO4 → ZnSO4 + H2。
3. 双替换反应:双替换反应是指两种化合物中的阳离子和阴离子交换的反应。
例如,氯化银与硝酸钠的反应方程式为AgCl + NaNO3 → AgNO3 + NaCl。
4. 氧化还原反应:氧化还原反应是指物质失去电子(氧化)和物质获得电子(还原)的过程。
例如,铜与硝酸的反应方程式为Cu +2HNO3 → Cu(NO3)2 + H2O + NO2。
三、答案1. Na2O2. Fe2O33. Al2O34. NaCl5. CuSO46. NH4NO37. Li8. Na9. K10. HCl11. H2SO412. HNO313. H2O14. HCl + NaOH → NaCl + H2O15. Zn + H2SO4 → ZnSO4 + H216. AgCl + NaNO3 → AgNO3 + NaCl17. Cu + 2HNO3 → Cu(NO3)2 + H2O + NO2总结:本文介绍了一些常见的化学式和化学方程式,并提供了相应的答案,帮助读者更好地理解化学语言的表达方式。

九年级上册化学常见物质的化学式和名称九年级上册化学常见物质的化学式和名称化学是一门研究物质性质、组成和变化的科学。
在九年级的化学课程中,我们将学习许多常见物质的化学式和名称。
下面是一些常见物质和它们的化学式、名称以及一些相关性质的简要介绍。
1.水(H2O)水是人们日常生活中最常见的物质之一。
它的化学式是H2O,由两个氢原子和一个氧原子组成。
水是无色、无味、无臭的液体,是许多生物体所需的基本物质。
2.氧气(O2)氧气是空气中的主要成分之一。
它的化学式是O2,由两个氧原子组成。
氧气是无色、无味、无臭的气体,是许多生物体进行呼吸所需的重要物质。
3.二氧化碳(CO2)二氧化碳是一种常见的无机化合物。
它的化学式是CO2,由一个碳原子和两个氧原子组成。
二氧化碳是无色、无味的气体,在许多自然界中的过程中产生,比如动植物的呼吸和燃烧过程。
4.盐(NaCl)盐是一种常见的无机化合物,也是人们日常生活中常用的调味品。
它的化学式是NaCl,由一个钠离子和一个氯离子组成。
盐是白色晶体,可溶于水,常用于调味、腌制和防腐等用途。
5.铁(Fe)铁是一种常见的金属元素。
它的化学符号是Fe,原子序数为26。
铁是坚硬、有延展性和导电性的金属,广泛用于制造机械、建筑材料和电子设备等领域。
6.铜(Cu)铜也是一种常见的金属元素。
它的化学符号是Cu,原子序数为29。
铜是红褐色的金属,具有良好的导电性和导热性,常用于制造电线、管材和电子器件等。
7.铝(Al)铝是一种常见的轻质金属元素。
它的化学符号是Al,原子序数为13。
铝具有轻质、优良的导电性和导热性的特点,广泛用于制造飞机、汽车和建筑材料等。
8.纳(Na)纳是一种常见的金属元素。
它的化学符号是Na,原子序数为11。
纳是一种银白色的金属,具有很强的化学活性。
纳在化合物中常以正离子的形式存在,比如在盐中的钠离子。
9.氧(O)氧是一种常见的非金属元素。
它的化学符号是O,原子序数为8。
氧是无色、无味的气体,是许多燃烧和呼吸过程中必需的。
初中常见化学式 常见的化学式初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2点燃 2CO9、二氧化碳通过灼热碳层:2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211:CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K22+O2↑172O 通电 2H2↑+O2↑1823 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4== ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2+CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2+3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:23高温 2Fe+ 3CO233:Ca(OH)2+ CO2==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3+H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2+H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O+CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:2点燃 CO29. 碳在氧气中不充分燃烧:2点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO22O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO215.3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H232O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:34高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe23高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温 3Fe+ 4CO2(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4= FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4= MgSO4+H2↑29. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2=== Cu(NO3)2+Hg(3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4=== Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3+3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4+2H2O57. 硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4=== Na2SO4+H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4+BaCl2==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3=== CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO45H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体2点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O 3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水4氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ4MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu223Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H 2SO 4 =MgSO 4 +H 2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H 2SO 4=Al 2(SO4)3+ 3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe 2O 3+3H 2 Δ 2Fe +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译、试管壁有液体 冶炼金属、利用氢气的还原性WO 3 +3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的还原性 MoO 32 ΔMo +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸CuSO 4 +2NaOH=Cu(OH)2↓+ Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 2点燃2CO 2 蓝色火焰 煤气燃烧 C+ CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4 +2C 高温3Fe+ 2CO 2↑ 冶炼金属 C+ CO2 高温2COCO 2+ H 2O = H 2CO 3 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文 H 2CO 3 ΔCO 2↑+ H 2O 石蕊红色褪去2 +CO 2= CaCO 3↓+ H 2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 CaCO3 +H 2O+ CO 2 = Ca(HCO 3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 Ca(HCO 3)2Δ CaCO 3↓+ H 2O +CO 2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.2NaHCO 3ΔNa 2CO 3+ H 2O +CO 2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 CaCO 3 高温 CaO +CO 2↑ 工业制备二氧化碳和生石灰 CaCO 3 2+ H 2O +CO 2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg+ O 2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 2 点燃 Fe 3O 4 3. 铜在空气中受热:2Cu+ O 2 加热 2CuO 4. 铝在空气中燃烧:4Al +3O2 点燃2Al 2O 3 5. 氢气中空气中燃烧:2H 2 +O 2 点燃 2H 2O 6. :4P +5O 2 点燃 2P 2O 5 7. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:2 点燃 CO 2 9. 碳在氧气中不充分燃烧:2 点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 2 点燃 2CO 211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2↑14.加热高锰酸钾:2KMnO4加热 K242+O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:44+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO282CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3== H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33:Ca(OH)2 +CO2=== CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2+3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4= FeSO4+H2↑46. 镁和稀硫酸Mg +H2SO4= MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4+Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4+Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2== Cu(NO3)2+Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3+6HCl ==2FeCl3+3H2O57. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2+H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3+3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2+H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3+2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4+BaCl2== BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3+H2O70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4+H2O71.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO 2 == CaSO 3↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐 74. 铁和硫酸铜溶液反应:Fe+ CuSO 4 == FeSO 4 +Cu (2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl 一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。

初中化学常见物质的化学式和名称一、熟记下列物质的化学式:1、单质:是由同种元素组成的纯净物H2 氢气O2 氧气N2氮气CI2氯气He氦气Ne氖气Ar氩气C碳P磷S硫Fe铁Cu铜Hg 汞2、化合物(由两种或两种以上不同元素组成的纯净物)(1)氧化物:其组成中只含两种元素,其中一种一定为氧元素H2O水H2O2过氧化氢(双氧水)CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3三氧化二铁(氧化铁)Fe3O4四氧化三铁CaO氧化钙MgO氧化镁CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰Na2O氧化钠(2)酸:在水溶液中电离出的阳离子全部都是氢离子的化合物HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸CH3COOH醋酸(有机酸)(3)碱:指在水溶液中电离出的阴离子全部都是OH-的化合物NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁氨水NH3·H2O(4)盐:指一类金属离子或铵根离子(NH4+)与酸根离子(或非金属离子)结合的化合物NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸钠CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl氯化铵NH4NO3硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸铜NaNO2亚硝酸钠(5)有机物:狭义上的有机化合物主要是指由碳元素、氢元素组成,一定是含碳的化合物,但是不包括碳的氧化物和硫化物、碳酸、碳酸盐等CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2尿素(6)无机物: 指不含碳元素的纯净物以及部分含碳化合物,如一氧化碳、二氧化碳、碳酸、碳酸盐、碳化物等CH4甲烷(沼气天然气)CaO氧化钙(生石灰)Ca(OH)2氢氧化钙(熟石灰、消石灰)CaCO3碳酸钙(石灰石、大理石)NaCl氯化钠(食盐)KMnO4高锰酸钾(灰锰氧)二、熟记一些物质的学名、俗名及对应的化学式Hg汞(水银)CO2二氧化碳(干冰)CO一氧化碳(煤气)C2H5OH乙醇(酒精)CH3COOH乙酸(醋酸)NaOH氢氧化钠(烧碱、火碱、苛性钠)Na2CO3碳酸钠(纯碱、苏打)NaHCO3碳酸氢钠(小苏打)HCl氢氯酸(盐酸)CuSO4•5H2O五水硫酸铜(胆矾、蓝矾)(NH4)2SO4硫酸铵(硫铵)NH4HCO3碳酸氢铵(碳铵)Cu2(OH)2CO3碱式碳酸铜(铜绿)NH4NO3硝酸铵(硝铵)K2CO3碳酸钾(草木灰主要成分)。

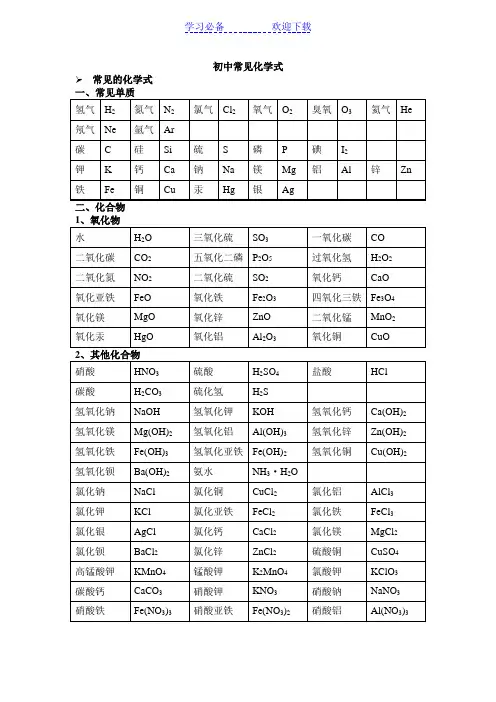
九年级上册化学必须记住的化学式和化学方程式化合价九年级上册化学必须记住的化学式以下是必须记住的单质和化合物的化学式:一、单质的化学式:(24个)1、氧气:O22、氮气:N23、氢气:H24、氯气:Cl25、固态非金属单质:碳:C、磷:P、硫:S、硅:Si6、稀有气体单质:氦:He、氖:Ne、氩:Ar7、金属单质:铁:Fe、铜:Cu、锌:Zn、铝:Al、银:Ag、镁:Mg、钡:Ba、金:Au、汞:Hg、钾:K、钙:Ca、锰:Mn、钠:Na二、化合物的化学式:(37个)1、氧化物:水:H2O、二氧化碳:CO2、过氧化氢:H2O2、二氧化锰:MnO2、一氧化碳:CO、二氧化硫:SO2、二氧化氮:NO2、氧化铜:CuO、氧化铁:Fe2O3、四氧化三铁:Fe3O4、氧化镁:MgO、氧化钙:CaO、五氧化二磷:P2O5、氧化铝:Al2O3、二氧化硅:SiO2、氧化汞:HgO、特殊:氨气:NH32、酸:硫酸:H2SO4、碳酸:H2CO3、盐酸:HCl、硝酸:HNO33、碱:氢氧化钠:NaOH、氢氧化钙:Ca(OH)2、氢氧化钾:KOH4、盐:氯化钠:NaCl、氯化钾:KCl、硫酸铜:CuSO4、碳酸钠:Na2CO3、氯酸钾:KClO3、高锰酸钾:KMnO4、锰酸钾:K2MnO4、碳酸钙:CaCO3、硫酸亚铁:FeSO4、硫酸铁:Fe2(SO4)35、有机物:甲烷:CH4、乙醇(俗名酒精):C2H5OH九年级上册化学必须记住的化学方程式(34个)以下是必须记住的化学方程式:1、镁燃烧:2Mg+O2→2MgO2、铁燃烧:3Fe+2O2→2Fe3O43、铝燃烧:4Al+3O2→2Al2O34、氢气燃烧:2H2+O2→2H2O5、红磷燃烧:4P+5O2→2P2O56、硫粉燃烧:S+O2→SO27、碳充分燃烧:C+O2→CO28、碳不充分燃烧:2C+O2→2CO9、一氧化碳不完全燃烧:2CO+O2→2CO210、一氧化碳燃烧:2CO+O2→2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O→H2CO3(溶液变红)12、生石灰溶于水:CaO+H2O→Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O→CuSO4·5H2O14、氢氧化钠和盐酸反应:XXX→NaCl+H2O15、氢氧化钠和硫酸反应:2NaOH+H2SO4→Na2SO4+2H2O16、氢氧化钙和盐酸反应:Ca(OH)2+2HCl→CaCl2+2H2O17、氢氧化钙和硫酸反应:Ca(OH)2+H2SO4→CaSO4+2H2O18、氢氧化钾和盐酸反应:XXX→KCl+H2O19、氢氧化钾和硫酸反应:XXX→K2SO4+2H2O20、氯化铁和氢氧化钠反应:FeCl3+3NaOH→Fe(OH)3+3NaCl21、氯化铜和氢氧化钠反应:CuCl2+2NaOH→Cu(OH)2+2NaCl22、硫酸铜和氢氧化钠反应:Cu SO4+2NaOH→Cu(OH)2+Na2SO423、硫酸铁和氢氧化钠反应:XXX→Fe(OH)2+Na2SO424、氯化钠和硫酸银反应:XXXNaNO325、氢氧化钡和硫酸反应:Ba(OH)2+H2SO4→BaSO4↓+2H2O26、氯化钾和硫酸反应:2KCl+H2SO4→K2SO4+2HCl27、碳酸钠和盐酸反应:Na2CO3+2HCl→2NaCl+H2O+CO228、碳酸钠和硫酸反应:Na2CO3+H2SO4→Na2SO4+H2O+CO229、氯酸钾和硫酸反应:KClO3+H2SO4→KHSO4+HClO330、高锰酸钾和盐酸反应:XXX→KCl+MnCl2+2H2O+Cl231、高锰酸钾和氢氧化钠反应:2KMnO4+2NaOH→K2MnO4+2MnO2+2H2O+O2↑32、二氧化碳通过灼热碳层:C+CO2→2CO33、硫酸和锌反应:Zn+H2SO4→ZnSO4+H2↑34、碳酸钙和盐酸反应:XXX→CaCl2+H2O+CO2↑1.实验室使用双氧水制取氧气,反应式为2H2O2 → 2H2O + O2.2.高锰酸钾加热反应,反应式为2KMnO4 → K2MnO4 + MnO2 + O2.3.水在直流电的作用下发生分解,反应式为2H2O → 2H2 + O2.4.碳酸不稳定,分解产生水和二氧化碳,反应式为H2CO3 → H2O + CO2.5.高温煅烧石灰石可以用于制取二氧化碳,反应式为CaCO3 → CO2 + CaO。
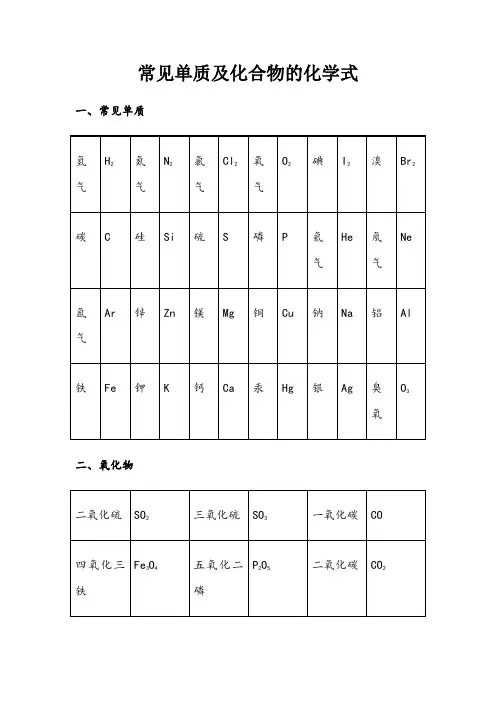

初中化学常见化学物质的化学式、名称和俗称初中常见化学物质的化学式、名称、俗称1. A l(OH)3:氢氧化铝、胃舒平的主要成分;2. B aSO4:硫酸钡、钡餐、重晶石3. C:碳、金刚石、石墨、木炭、活性炭、焦炭、煤的主要成分;4. C aO:氧化钙、生石灰;5. C aO、NaOH:氧化钙和氢氧化钠混合物、碱石灰;6. C a(OH)2: 氢氧化钙、消石灰、熟石灰;石灰浆、石灰乳、石灰水的主要成分;7. C aCO3:碳酸钙、大理石、石灰石的主要成分;8. C H4:甲烷、天然气、瓦斯、沼气的主要成分;9. C2H5OH :乙醇、酒精;10. Hg: 汞、水银;11. HCl:氢氯酸、盐酸、胃酸的主要成分;12. H2O2:过氧化氢、双氧水;13. H2和O2混合气:爆鸣气;14. KAl(SO4)2.12H2O:十二水硫酸铝钾、明矾;15. K2CO3:碳酸钾、草木灰主要成分;16. KOH:氢氧化钾、苛性钾;17. NaOH:氢氧化钠、苛性钠、烧碱,火碱;18. Na2CO3:碳酸钠、纯碱、苏打;19. NaHCO3:碳酸氢钠、小苏打20. Na2CO3.10H2O:纯碱晶体、21. NaCl:氯化钠、食盐;22. Na2S2O3:硫代硫酸钠、大苏打、海波;硫酸铜)、KCl、NaCl等黄色的固体—— S蓝色的固体——CuSO4•5H2O蓝色絮状沉淀——Cu(OH)2红褐色絮状沉淀——Fe(OH)3常见不溶于酸的白色沉淀——BaSO4、AgCl溶于酸并二氧化碳气体的白色沉淀——BaCO3、CaCO3等不溶性碳酸盐的沉淀溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀蓝色的溶液:CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液碘遇到淀粉溶液浅绿色的溶液:FeSO4、FeCl2、Fe(NO3)2等含Fe2+溶液黄色的溶液:FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液紫红色溶液:KMnO4等含MnO4-的溶液三、常见气体(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)化学式大全硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸(常见的酸)H2SO4HCl HNO3H3PO4H2S HBr H2CO3硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4 BaSO4CaSO4K2SO4MgSO4FeSO4Fe2(SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3NaHSO4KHSO4Na2SO3NaNO3KNO3AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁MgNO3 Cu(NO3)2Ca(NO3)2NaNO3Na2CO3CaCO3MgCO3碳酸钾(常见的盐)K2CO3氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH Ca(OH)2 Ba(OH)2Mg(OH)2Cu(OH)2KOH Al(OH)3氢氧化铁氢氧化亚铁(常见的碱)Fe(OH)3 Fe(OH)2甲烷乙炔甲醇乙醇乙酸 (常见有机物)CH4 C2H2CH3OH C2H5OH CH3COOH碱式碳酸铜石膏熟石膏明矾绿矾Cu2(OH)2CO3CaSO4•2H2O 2 CaSO4•H2O KAl(SO4)2•12H2O FeSO4•7H2O蓝矾碳酸钠晶体(常见结晶水合物)CuSO4•5H2O Na2CO3•10H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾(常见化肥)CO(NH2)2NH4NO3(NH4)2SO4NH4HCO3KH2PO4初中化学物质的溶解性1、盐的溶解性含有钾、钠、铵根的物质都溶于水含Cl的化合物只有AgCl不溶于水,其他都溶于水;含SO42-的化合物只有BaSO4 不溶于水,其他都溶于水。
化学式化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S + O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O22CO29、二氧化碳和水反应生成碳酸:CO2+ H2O == H2CO310、二氧化碳通过灼热炭层:CO2+ C 2CO11、氧化钙及水反应:CaO+ H2O == Ca(OH)212、铝及氧气反应:4Al + 3O2== 2Al2O3二、分解反应13、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑14、氯酸钾制氧气:2KClO3 2KCl + 3O2↑15、双氧水制氧气:2H2O22H2O + O2↑16、电解水:2H2O 2H2↑+ O2↑17、碳酸分解:H2CO3H2O + CO2↑18、高温煅烧石灰石:CaCO3CaO +CO2↑三、置换反应19、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)220、铜和硝酸汞溶液反应:Cu + 2HgNO3 == 2Hg + Cu(NO3)221、锌和硫酸铜溶液反应:Zn + CuSO4 == Cu + ZnSO422、锌和氯化铜溶液反应:Zn + CuCl2== Cu + ZnCl223、铁和氯化铜溶液反应:Fe + CuCl2 == Cu + FeCl224、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO425、铝和硫酸铜溶液反应:2Al + 3CuSO4 == Cu +Al2(SO4)326、锌和稀硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑27、铁和稀硫酸反应制取氢气:Fe + H2SO4== FeSO4+ H2↑28、镁和稀硫酸反应制取氢气:Mg + H2SO4== MgSO4+ H2↑29、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑30、锌和稀盐酸反应制取氢气:Zn + 2HCl== ZnCl2+ H2↑31、铁和稀盐酸反应制取氢气:Fe + 2HCl== FeCl2+ H2↑32、镁和稀盐酸反应制取氢气:Mg + 2HCl== MgCl2+ H2↑33、铝和稀盐酸反应:2Al + 6HCl == 2AlCl3+ 3H2↑34、木炭还原氧化铜:C + 2CuO 2Cu + CO2↑35、木炭还原氧化铁:3C + 2Fe2O34Fe + 3CO2↑36、木炭还原四氧化三铁:2C + Fe3O43Fe + 2CO2↑37、氢气还原氧化铜:H2+ CuO Cu + H2O↑点燃点燃点燃点燃点燃点燃点燃△MnO2△MnO2通电高温高温高温CuS高温高温点燃点燃3 / 4四、复分解反应(一)酸 + 碱→盐 + 水38、氢氧化钠及盐酸反应:NaOH + HCl == NaCl + H2O39、氢氧化钠及硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O40、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O41、氢氧化镁及硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O42、氢氧化钙及硫酸反应:Ca(OH)2 + H2SO4== CaSO4+ 2H2O43、氢氧化钙及盐酸反应:Ca(OH)2 +2HCl == CaCl2+ 2H2O44、氢氧化铜及硫酸反应:Cu(OH)2 + H2SO4== CuSO4+ 2H2O45、氢氧化铜及盐酸反应:Cu(OH)2 + 2HCl == CuCl2+ 2H2O46、氢氧化铁及盐酸反应:Fe(OH)3 + 3HCl == FeCl3+ 3H2O47、氢氧化铁及硫酸反应:Fe(OH)3 + 3H2SO4== Fe2(SO4)3+ 3H2O(二)酸 + 盐→另一种酸 + 另一种盐48、盐酸及硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO349、氯化钡溶液及硫酸溶液反应:BaCl2 + H2SO4== BaSO4↓+ 2HCl50、硝酸钡溶液及硫酸溶液反应:Ba(NO3)2+ H2SO4== BaSO4↓+2HNO351、碳酸钠及稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑52、碳酸钠及稀硫酸:Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑53、碳酸氢钠及稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑54、碳酸氢钠及稀硫酸:2NaHCO3+ H2SO4== Na2SO4+ 2H2O + 2CO2↑55、石灰石及稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑56、碳酸钾及稀盐酸:K2CO3+ 2HCl == 2KCl+ H2O + CO2↑57、碳酸钾及稀硫酸:K2CO3+ H2SO4== K2SO4+ H2O + CO2↑(三)碱 + 盐→另一种碱 + 另一种盐58、硫酸铜溶液和氢氧化钠溶液:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓59、氯化铜溶液和氢氧化钠溶液:CuCl2+2NaOH = 2NaCl+Cu(OH)2↓60、氯化铁溶液和氢氧化钠溶液:FeCl3+3NaOH==Fe(OH)3↓+3NaCl61、硫酸铁和氢氧化钠溶液:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO462、碳酸钠溶液及氢氧化钙溶液:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH63、碳酸钠溶液及氢氧化钡溶液:Na2CO3+ Ba(OH)2== BaCO3↓+2NaOH64、硫酸铜和氢氧化钡溶液:CuSO4+ Ba(OH)2== BaSO4↓+ Cu(OH)2↓(四)盐 + 盐→两种新盐65、硝酸银溶液及氯化钠溶液反应:AgNO3+ NaCl == AgCl↓+ NaNO366、氯化钡溶液及硫酸钠溶液反应:BaCl2+ Na2SO4= BaSO4↓+ 2NaCl67、氯化钙溶液及碳酸钠溶液反应:CaCl2+ Na2CO3= CaCO3↓+ 2NaCl68、氯化钡溶液及碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl五、其他反应类型(一)金属氧化物 + 酸→盐 + 水69、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O70、稀硫酸清洗铁锈:3H2SO4+ Fe2O3== Fe2(SO4)3+ 3H2O71、氧化铜及稀硫酸反应:CuO + H2SO4== CuSO4+ H2O72、氧化铜及稀盐酸反应:CuO + 2HCl== CuCl2+ H2O73、氧化钙及稀硫酸反应:CaO + H2SO4== CaSO4+ H2O74、氧化钙及稀盐酸反应:CaO + 2HCl== CaCl2+ H2O(二)非金属氧化物 + 碱→盐 + 水75、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O76、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O77、澄清石灰水吸收二氧化硫:SO2+ Ca(OH)2== CaSO3↓+ H2O78、氢氧化钠溶液吸收二氧化硫:SO2+ 2NaOH = Na2SO3+ H2O79、氢氧化钠溶液及三氧化硫:SO3+ 2NaOH = Na2SO4+ H2O(三)其它80、一氧化碳还原氧化铜:CO + CuO Cu + CO281、冶铁原理(赤铁矿):3CO + Fe2O32Fe +3 CO282、冶铁原理(磁铁矿):4CO + Fe3O43Fe +4CO283、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O84、甲烷燃烧:CH4+ 2O2CO2+ 2H2O85、葡萄糖氧化:C6H12O6+ 6O26H2O +6CO2△点燃点燃△△酶4 / 4。
九年级化学常见物质的化学式和名称一、熟记下列物质的化学式:1、单质:H2氢气O2氧气N2氮气CI2氯气He 氦气Ne氖气Ar氩气C碳P磷S硫Fe铁Cu 铜Hg汞2、化合物(1)氧化物:H2O水H2O2过氧化氢(双氧水)CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3三氧化二铁(氧化铁)Fe3O4四氧化三铁CaO氧化钙MgO氧化镁CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰Na2O氧化钠(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸CH3COOH醋酸(有机酸)(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁氨水NH3·H2O(4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸钠CuSO4硫酸铜AgCl 氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl 氯化铵NH4NO3硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸铜NaNO2亚硝酸钠(5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2尿素CH4甲烷(沼气天然气)CaO氧化钙(生石灰)Ca(OH)2氢氧化钙(熟石灰、消石灰)CaCO3碳酸钙(石灰石、大理石)NaCl氯化钠(食盐)KMnO4高锰酸钾(灰锰氧)二、熟记一些物质的学名、俗名及对应的化学式Hg汞(水银)CO2二氧化碳(干冰)CO一氧化碳(煤气)C2H5OH乙醇(酒精)CH3COOH乙酸(醋酸)NaOH氢氧化钠(烧碱、火碱、苛性钠)Na2CO3碳酸钠(纯碱、苏打)NaHCO3碳酸氢钠(小苏打)HCl 氢氯酸(盐酸)CuSO4?5H2O五水硫酸铜(胆矾、蓝矾)(NH4)2SO4硫酸铵(硫铵)NH4HCO3碳酸氢铵(碳铵)Cu2(OH)2CO3碱式碳酸铜(铜绿)NH4NO3硝酸铵(硝铵)K2CO3碳酸钾(草木灰主要成分)常见原子团OH-1价(氢氧根)NO3-1价(硝酸根)SO4-2 价(硫酸根)CO3-2 价(碳酸根)NH4+1价(铵根)ClO3-1 价(氯酸根)MnO4-1价(高锰酸根) MnO4-2价(锰酸根)PO4-3价(磷酸根)HCO3-1价(碳酸氢根)。
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH
1. 常见单质的化学式
物质名称木炭硫磺白磷氦气水银金属镁化学式C S P He Hg Mg
物质名称金属铁金属铜氢气氧气氮气氯气
化学式Fe Cu H2O2N2Cl2 2. 常见化合物的化学式
物质名称水氧化镁氧化钙二氧化碳二氧化锰
化学式H2O MgO CaO CO2MnO2物质名称碳酸钙氢氧化钙盐酸氯化钙氢氧化钠化学式CaCO3Ca(OH)2HCl CaCl2NaOH。
常见物质的化学式及名称
一单质
1 气体分子
H2 氢气O2氧气N2氮气O3臭氧
2 金属单质
Fe 铁等等与其元素符号读法一致
3 稀有气体
He 氦Ne 氖Ar 氩Kr 氪(ke) Xe 氙(xian) Rn 氡(dong)
二化合物
1 常见氧化物读作“氧化某”
H2O 水CaO 氧化钙CuO 氧化铜CO2二氧化碳CO 一氧化碳SO2二氧化硫P2O5五氧化二磷MgO 氧化镁
Fe2O3氧化铁(三氧化二铁)Fe3O4四氧化三铁
Al2O3氧化铝ZnO 氧化锌MnO2二氧化锰
2 常见酸根离子的读法
CO32-碳酸根离子SO42-硫酸根离子NO3-硝酸根离子
PO43-磷酸根离子MnO4-高锰酸根离子MnO42-锰酸根离子
3 常见酸根离子与金属构成的化合物读作“某酸某”CaCO3碳酸钙CuSO4硫酸铜KMnO4高锰酸钾K2MnO
4 锰酸钾KClO3氯酸钾ZnSO4硫酸锌Fe2(SO4)3硫酸铁FeSO4硫酸亚铁
4 常见的氯化物读作“氯化某”
CaCl2氯化钙KCl 氯化钾HCl 氯化氢FeCl3氯化铁FeCl2氯化亚铁
5 常见的氢氧化物(OH-)“氢氧化某”
Ca(OH)2氢氧化钙Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Cu(OH)2氢氧化铜KOH 氢氧化钾NaOH氢氧化钠
6 常见的酸
HCl 盐酸H2SO4硫酸HNO3 硝酸
7 常见的铵根离子化合物(NH4+)读作“某化铵”
NH4Cl 氯化铵NH4NO3硝酸铵等。