鲁教版九年级第五单元《第三节 酸和碱的性质》
- 格式:ppt
- 大小:367.00 KB
- 文档页数:32

酸和碱的性质课题§5-3 酸和碱的性质内容标准知道常见酸碱的主要性质和用途,认识酸碱的腐蚀性。
知道酸碱性对生命活动和农作物生长的影响。
教学目标知识与能力1、认识两种常见的酸的化学性质。
2、从结构的角度认识酸的化学性质,并得到酸的共性。
过程与方法1、初步学会运用分类研究的思想进行一类物质的化学性质探究。
2、鼓励学生参与探究活动的全过程。
3、鼓励学生发现问题,在交流和讨论中自主地解决问题。
情感、态度、价值观1、学习和感受化学特有的思维方式——宏观和微观相结合。
2、鼓励学生大胆猜想、勇于突破的科学精神。
3、感受化学与生活的紧密联系。
教学重点难点分析教法及学法重点:酸的化学性质及获取酸的化学性质的过程体验。
难点:实验探究,演绎分析。
教学法:实验探究归纳法课前准备运用计算机多媒体辅助教学,实物投影,学生分组实验。
板书设计§5-3 酸和碱的性质一、酸的性质2酸的化学性质(1)与酸碱指示剂反应(2)与碱反应生成盐和水(3)与某些金属反应生成盐和氢气(4)与某些金属氧化物反应生成盐和水(5)与某些盐反应生成新酸和新盐课后反思本节课最重要的特点就是加强化学与生活的联系。
所有的知识都尽量让学生通过已有经验自行体会,形成直观印象后,再来进行新知识的构建。
不断引导学生对自己的思考过程进行反思、对解题思路、推理过程语言表述进行反思、对本节课的知识与以前知识的联系进行反思,并试着对本节课的内容提出新的教学问题……帮助学生检视自我,树立方向,明了自己想要学什么,获得什么。
教学过程教学内容教师活动学生活动创设情景导入课题:在家中如何鉴别洁厕灵和餐具洗洁精?用语言叙述创设情景,通过演示实验让解决问题。
回答问题、遭遇困境、明确需要继续学习的内容。
学生在任务驱动下开始稀盐酸的化学性质探究。
问题引领:全面探究盐酸,你认为还缺哪些方面?你还想探究什么物质与盐酸的反应?为什么?思考、讨论、交流。
做实验验证。
从宏观深入到微观,寻找决定盐酸性质的结构原因。


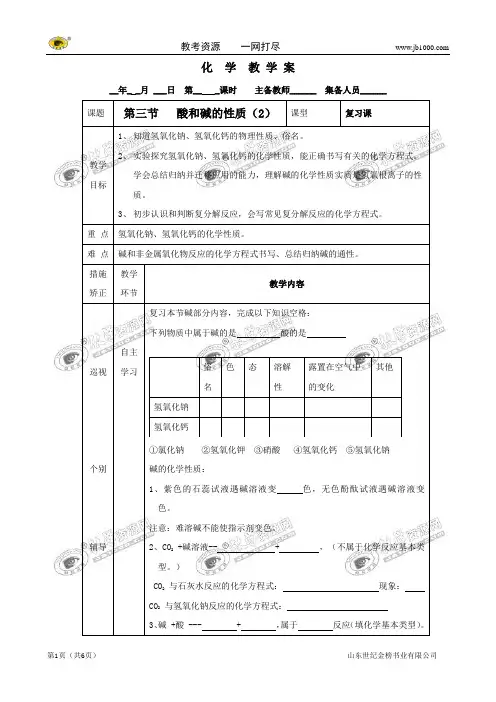
化学教学案__年_ _月 ___日第__ _课时主备教师______ 集备人员______ 课题第三节酸和碱的性质(2)课型复习课教学目标1、知道氢氧化钠、氢氧化钙的物理性质、俗名。
2、实验探究氢氧化钠、氢氧化钙的化学性质,能正确书写有关的化学方程式。
学会总结归纳并迁移应用的能力,理解碱的化学性质实质是氢氧根离子的性质。
3、初步认识和判断复分解反应,会写常见复分解反应的化学方程式。
重点氢氧化钠、氢氧化钙的化学性质。
难点碱和非金属氧化物反应的化学方程式书写、总结归纳碱的通性。
措施矫正教学环节教学内容巡视个别辅导自主学习复习本节碱部分内容,完成以下知识空格:下列物质中属于碱的是酸的是①氯化钠②氢氧化钾③硝酸④氢氧化钙⑤氢氧化钠碱的化学性质:1、紫色的石蕊试液遇碱溶液变色,无色酚酞试液遇碱溶液变色。
注意:难溶碱不能使指示剂变色。
2、CO2 +碱溶液-- + ,(不属于化学反应基本类型。
)CO2与石灰水反应的化学方程式:现象:CO2与氢氧化钠反应的化学方程式:3、碱 +酸 --- + ,属于反应(填化学基本类型)。
俗名色态溶解性露置在空气中的变化其他氢氧化钠氢氧化钙点拨讲解氢氧化铝、氢氧化镁分别与盐酸、硫酸反应:;;4、碱溶液 +盐溶液--- + 属于反应(填化学基本类型)。
碳酸钠和石灰水反应:;现象:氯化铜溶液和氢氧化钠反应:;现象:5、复分解反应。
发生条件:。
反应类型是指:、、、共四类反应。
合作探究1、氢氧化钙的制取。
2、二氧化碳能使澄清的石灰水变浑浊,那么二氧化碳与氢氧化钠溶液反应呢?你能否设计实验加以证明呢?实验:氢氧化钠与二氧化碳反应在充满二氧化碳的烧瓶中,加入少量氢氧化钠浓溶液,迅速塞紧带有玻璃管和气球的橡皮塞,振荡烧杯,观察现象、思考问题。
(1)为什么气球会逐渐涨大?。
(2)碱与非金属氧化物(CO2、SO2、)反应的化学方程式如何写?。
(3)怎样保存氢氧化钠?说明原因?。
3、有一杯污水如何鉴定它呈碱性?。

2021年九年级化学第五单元常见的酸和碱教案(全)鲁教版第三节酸和碱的性质第四节化学反应中的有关计算单元备课(下)二、溶液酸碱性的强弱程度创设问题:浓的盐酸比稀盐酸的酸性强,原因是什么呢?如何用化学的方法来检验溶液的酸碱性强弱?讨论、交流、猜测问题:1、溶液酸碱性的强弱与______________有关,______________越多酸性越强,______________越多,______________越强。
2、溶液的酸碱性强弱最常用______来表示,pH的范围通常在______之间,溶液的酸碱性与pH的关系是:_________________________________。
完成相关内容用数轴表示溶液的酸碱性与pH的关系在线测试:P120独立完成个别展示测定溶液pH的方法是:_____________________________________ 实验探究:(指导学生)测定生活中一些物质的pH,并将其分类。
你获得的结论是:____________________________________________。
测定生活中比较熟悉的物质,把理论应用于实际。
交流识别P120图判断酸碱性的强弱三、溶液的酸碱性与生命活动的意义(指导阅读相关资料)问题:1、在人体体液中酸性最强的是______,碱性最强的是________。
2、当人大量喝水时,胃液的pH与喝水量的变化关系,可用下列图像表示的是()。
认真阅读、了解酸和碱对生命活动的意义,丰富自己的头脑问题:从课本提供的两组pH范围的数据中你可以发现什么?思考、交流、发表见解挑战自我下列变化属于复分解反应的是()A、3NO2+H2O==2HNO3+NOB、CH4+2O2==CO2+2H2OC、CaCO3+2HCl==CaCl2+H2O+CO2↑D、2KMnO4==K2MnO4+MnO2+O2↑讨论,思考、交流并回答问题挑战自我:完成课后练习,检查一下你的学习效果如何。

第三节酸和碱的性质【我思我学】〖查一查〗二氧化碳溶解于水后产生了哪种新的物质?食醋中含有的哪种物质使食醋呈酸性?蓄电池中添加的液体是什么物质的水溶液?〖想一想〗你已经学过哪些包含酸类物质的化学反应了?试着写出它们的化学方程式。
〖试一试〗到学校边的建筑工地上找少量熟石灰,观察其颜色、状态,试验其溶解性,并观察向其水溶液中吹气时所发生的现象。
【同步导学】一.评价要点1.理解:常见酸的化学性质:与活泼金属反应产生盐和氢气;与金属氧化物反应产生盐和水;与碳酸盐反应产生盐和水和二氧化碳。
并能触类旁通,理解它们所能发生的其它类似反应。
2.知道:酸性溶液中含有的H+使它们具有了上述通性。
3.记住:氢氧化钙的两个俗名、颜色、状态、溶解性;氨水(氨气的水溶液)的气味;氨水的类别(也属于碱的溶液);氢氧化钠的三个俗名、颜色、状态、吸水性(易潮解)、溶解放热、溶解性。
4.理解:氢氧化钠、氢氧化钙、氢氧化钾水溶液及氨水的以下性质:与酸碱指示剂作用;与CO2反应;与硫酸铜反应生成碱和盐。
并能触类旁通,理解它们所能发生的其它类似反应,并能进行简单的迁移。
5.知道:碱性溶液中含有的OH—使它们具有了上述通性。
6.知道使用酸、碱时的注意事项。
7.理解:复分解反应的定义。
会分辨常见化学反应的基本类型,并知道复分解反应前后各种元素化合价不变的规律。
二.方法指引1.首先要能熟知稀(浓)盐酸、稀(浓)硫酸等常见酸的物理性质。
包括颜色、气味、状态、挥发性、溶解性等。
2.要能熟练地写出稀盐酸、稀硫酸与镁、铁等活泼金属反应的化学方程式。
、、、、3.要能熟练地写出稀盐酸、稀硫酸与氧化铁反应的化学方程式。
、。
4.要知道酸在水溶液中都能电离出,从而使它们具有了许多共同性质。
5.要熟悉几个主要反应的实验现象。
6.在认真实验的基础上,要能熟练说出氢氧化钙、氢氧化钠、二种重要碱的物理性质。
包括颜色、状态、溶解性、吸水性、挥发性等。
以及熟练说出它们的俗名。

第三节酸和碱的性质知识梳理1.浓盐酸具有______性,因此在空气里会形成白雾。
浓盐酸还具有强烈的______性。
答案:挥发腐蚀2.纯净的浓硫酸是______色、粘稠、______液体,不易挥发。
浓硫酸还具有______性和强烈的______性。
稀释浓硫酸时,一定要把______沿器壁慢慢注入______里,并不断搅拌。
答案:无油状脱水腐蚀浓硫酸水3.完成下列反应的化学方程式:①盐酸和金属锌____________________________________。
②实验室用大理石和稀盐酸制取二氧化碳____________________________________。
③用稀盐酸除铁锈____________________________________。
④稀盐酸和氧氧化钠____________________________________。
答案:Zn+2HCl====ZnCl2+H2↑ CaCO3+2HCl====CaCl2+H2O+CO2↑Fe2O3+3HCl====FeCl3+3H2O HCl+NaOH====NaCl+H2O4.氢氧化钠是______色固体,______溶于水。
暴露在空气中的固体氢氧化钠易______而逐渐溶解。
答案:白易吸收空气中的水分5.氢氧化钙俗称______或______,是______色粉末,______溶于水。
答案:熟石灰消石灰白微6.完成下列反应的化学方程式:①把二氧化碳通入澄清石灰水中____________________________________。
②氢氧化钠和氯化铜反应____________________________________。
③氢氧化钙和碳酸钠反应____________________________________。
④生石灰遇水反应放大量的热____________________________________。
答案:CO2+Ca(OH)2====CaCO3↓+H2O CuCl2+2NaOH====Cu(OH)2+2NaClCa(OH)2+2Na2====CO3CaCO3↓+2NaOH CaO+H2O====Ca(OH)27.复分解反应指两种化合物______,生成另外两种新的化合物的反应。

