载体、点突变
- 格式:ppt
- 大小:306.00 KB
- 文档页数:36

DNA定点突变实验具体步骤及详细说明定点突变是指通过聚合酶链式反应(PCR)等方法向目的DNA片段(可以是基因组,也可以是质粒)中引入所需变化(通常是表征有利方向的变化),包括碱基的添加、删除、点突变等。
一、引物设计每条引物都要携带有所需的突变位点,引物一般长25~45 bp,设计的突变位点需位于引物中部。
二、反应1. 使用高保真的pyrobest DNA聚合酶,循环次数少,一般为12个循环。
2. 反应体系:(1)10x pyrobest Buffer:5 ul(2)dNTP Mixture(10 mM) :1 ul(3)模板DNA(5~50 ng) :1ul(4)primer 1 (125 ng) :1 ul(5)primer 2 (125 ng) :1 ul(6)pyrobest DNA polymerase(TaKaRa)(5 U/ul):0.25 ul(7)加无菌蒸馏水至50ul.三、产物沉淀纯化1. 加1/10 体积的醋酸钠,1倍体积的异丙醇,混匀置冰上(或-20℃冰箱)5min,离心弃上清。
2. 70~75%乙醇洗盐两次,烘干后溶于无菌水中(此步可省略,直接用DpnI 酶切)。
四、DpnI酶切1. 酶切体系(1)Buffer :2 ul(2)BSA(100x):0.2 ul(3)DNA :x ul(4)DpnI:0.5 ul(5)加无菌去离子水至20 ul。
2. 30℃酶切1~4 h。
3. 65℃水浴15min 终止反应。
五、转化将酶切产物转化大肠杆菌DH5a菌株,利用抗生素筛选突变子。
六、测序验证注意事项1. 引物和质粒都准备好后,当然就是做PCR喽,不过对于PCR的酶和buffer,不能用平时的,我们做PCR把整个质粒扩出来,延伸长度达到几个K,所以要用那些GC buffer或扩增长片段的buffer,另外,要用保真性能较好的PFU酶来扩增,防止引进新的突变。
2. Quick change试剂盒分为几种不同的类型,QuikChange®、Site-Directed Mutagenesis Kit标准点突变试剂盒、QuikChange®、XL Site-Directed Mutagenesis Kit长模板单点突变试剂盒(>8kb)从原理上是一样的,只是PCR的酶和BUFFER不一样,后面用了比较适合长片段扩增的酶和BUFFER罢了,没什么特别的东西。

20世纪80年代以来,基因克隆技术与DNA化学合成方法相结合,建立和发展了定点突变技术。
可以按照预定设计,在已知的DNA序列中增删或转换核苷酸,精确地是靶基因在特定位点发生碱基序列的变化,进而使基因表达及调控,基因产物发生相应改变。
这种快速精确的基因突变已经被广泛地应用与基因工程和蛋白质工程之中。
定点突变有多种方法,有的改变特定核苷酸,有的则是对一段最可能影响蛋白质功能的基因序列进行随机突变,产生一系列突变蛋白质。
寡核苷酸诱导的定点突变基本上分两类:一类是用单链噬菌体M13作载体的寡核苷酸介导的单链模板定点突变;另一类用双链质粒作载体,双引物法定点突变。
为了在体外导入特定的点突变,小的限制性片段可以切除,并被包含所需要突变的合成接头所替代(称为盒式诱变)。
如果不行,插入片段可以克隆到产生单链DNA的噬菌粒载体中,由所设计的错配引物指导DNA复制,产生异源双链的复制型,并在下面的复制循环中产生野生型和突变的复制型。
单链噬菌体作载体的定点突变的基本原理是,用已知序列的环状DNA变性后为模板,人工合成一段引物,将所要设计的定点突变寡核苷酸置于引物中,也就是说人工所合成的引物不是完全和模板互补,而是在某个位点有意识地让碱基突变,和模板上的碱基不能配对,由于其他的碱基是互补的,所以任然可以通过复性,使引物和模板特异性结合。
在M13单链环状模板上杂交一段寡核苷酸引物,利用DNA聚合酶和连接酶的作用,从引物延伸合成链,得到一个闭合环状的异源双链分子。
由于预先在寡核苷酸引物中人为地引入碱基的错配对,插入或缺失,然后在将杂合双环DNA转化到细菌中,因此异源双链DNA经转化和筛选就可以分离到带有相应突变的DNA克隆。
由于复制是半保留复制,经克隆后将有一半的后代环状DNA产生了定点突变,另一半和正常的亲代链一样。
环状双链质粒DNA作为载体进行基因的改造有它的优点。
待改造基因中如有两个适当的限制性内切酶切点,可以用人工合成双链DNA片段置换两切点之间原有序列,在人工合成的双链DNA片段中包含有突变的序列。

20世纪80年代以来,基因克隆技术与DNA化学合成方法相结合,建立和发展了定点突变技术。
可以按照预定设计,在已知的DNA序列中增删或转换核苷酸,精确地是靶基因在特定位点发生碱基序列的变化,进而使基因表达及调控,基因产物发生相应改变。
这种快速精确的基因突变已经被广泛地应用与基因工程和蛋白质工程之中。
定点突变有多种方法,有的改变特定核苷酸,有的则是对一段最可能影响蛋白质功能的基因序列进行随机突变,产生一系列突变蛋白质。
寡核苷酸诱导的定点突变基本上分两类:一类是用单链噬菌体M13作载体的寡核苷酸介导的单链模板定点突变;另一类用双链质粒作载体,双引物法定点突变。
为了在体外导入特定的点突变,小的限制性片段可以切除,并被包含所需要突变的合成接头所替代(称为盒式诱变)。
如果不行,插入片段可以克隆到产生单链DNA的噬菌粒载体中,由所设计的错配引物知道DNA复制,产生异源双链的复制型,并在下面的复制循环中产生野生型和突变的复制型。
(图)单链噬菌体作载体的定点突变的基本原理是,用已知序列的环状DNA变性后为模板,人工合成一段引物,将所要设计的定点突变寡核苷酸置于引物中,也就是说人工所合成的引物不是完全和模板互补,而是在某个位点有意识地让碱基突变,和模板上的碱基不能配对,由于其他的碱基是互补的,所以任然可以通过复性,使引物和模板特异性结合。
在M13单链环状模板上杂交一段寡核苷酸引物,利用DNA聚合酶和连接酶的作用,从引物延伸合成链,得到一个闭合环状的异源双链分子。
由于预先在寡核苷酸引物中人为地引入碱基的错配对,插入或缺失,然后在将杂合双环DNA转化到细菌中,因此异源双链DNA经转化和筛选就可以分离到带有相应突变的DNA克隆。
由于复制是半保留复制,经克隆后将有一半的后代环状DNA产生了定点突变,另一半和正常的亲代链一样。
环状双链质粒DNA作为载体进行基因的改造有它的优点。
待改造基因中如有两个适当的限制性内切酶切点,可以用人工合成双链DNA片段置换两切点之间原有序列,在人工合成的双链DNA片段中包含有突变的序列。



构建点突变质粒步骤
一、引言
本文旨在介绍构建点突变质粒的具体步骤。
点突变是指在DNA的序列中改变单个碱基,通常用于研究蛋白质结构和功能。
点突变可以通过PCR扩增、纯化、定向克隆和测序等技术实现。
二、材料和方法
2.1 PCR扩增
PCR(聚合酶链式反应)是指在高温下使DNA变性,然后利用Taq聚合酶进行DNA扩增。
PCR扩增需要设计两个引物,引物的长度一般为20-30bp,引物的浓度一般为0.1uM。
PCR扩增的反应条件如下:94℃变性2min→94℃ 30s→58-65℃ 30s→72℃ 1min/kb(循环30-35次)→72℃5min停止反应。
PCR扩增的产物可以通过琼脂糖凝胶电泳分离。
2.2 DNA纯化
将PCR扩增产物从琼脂糖凝胶切下,用QIAquick凝胶提取试剂盒进行纯化。
将样品加入吸附柱,再加入洗涤缓冲液将杂质洗掉,最后加入洗脱缓冲液使DNA从柱子中洗脱出来。
2.3 定向克隆
定向克隆是指利用限制性内切酶切割DNA,然后进行质粒载体的克隆。
先将PCR产物与质粒载体酶切后连接,然后转化到大肠杆菌中,通过筛选获得阳性克隆子。
在定向克隆的过程中需要注意引物的合成和酶切位点的选择,以保证克隆效率和准确性。
2.4 测序
测序是指对克隆子的DNA序列进行测定和分析。
将克隆子的DNA片段进行扩增和纯化后送到生物技术公司进行二代测序,得到测序结果后进行序列比对和分析。
三、结论
通过PCR扩增、纯化、定向克隆和测序等技术,可以实现构建点突变质粒的目的。
本文介绍了具体的步骤和注意事项,希望能够对相关科研工作者提供一定的参考。

克隆点突变系列常见问题及解决方法一、克隆1)、平板上长不出克隆或克隆数目很少a)、感受态效率低:使用新制备或妥善冻存的感受态细胞,确保转化效率>107 cfu/μg。
每次可设置一组转化质粒的对照实验,以检测感受态细胞的转化效率。
b)、线性化克隆载体和插入片段扩增产物的使用量不足/过量,或者比例不佳:请务必预先检测线性化克隆载体和插入片段PCR产物的浓度。
常用的吸光度测量法极易受DNA纯度、DNA稀释液pH等因素影响,测定值和DNA实际浓度往往偏差非常大。
因此,我们强烈推荐您通过琼脂糖电泳来测定样品中的DNA浓度。
c)、载体和插入片段不纯,抑制反应:未纯化DNA加入重组反应体系内的总体积不应超过4 μl (反应体系体积1/5)。
尝试对线性化载体、PCR产物进行胶回收纯化。
d)、感受态细胞中加入了过多的反应产物:反应产物的转化体积不应超过感受态细胞体积的1/10,否则会降低转化效率。
e)、当载体和片段的均大于10K时,克隆效率下降,属正常情况。
f)、少数情况:插入基因本身含细胞毒性,即便有正确克隆也因为克隆细胞无法生长导致试验失败。
2)、多数克隆不含插入片段(假阳性)a)、克隆载体线性化不完全:即使是痕量未完全酶切的载体也会产生很高的转化背景。
提高限制性内切酶使用量、延长酶切反应时间、胶回收纯化酶切产物,都可以有效减少甚至消除环状质粒残留。
b)、反应体系中混入了相同抗性的质粒:PCR扩增模板(扩增克隆载体或者扩增插入片段)为环状质粒。
当扩增产物直接用于重组反应时,残留环状质粒模板会产生较高的转化背景。
尽量使用预线性化质粒作为扩增模板、扩增产物进行DpnI 消化、扩增产物进行胶回收纯化,都可以有效减少甚至消除环状模板质粒残留。
3)、克隆含有不正确的插入片段a)、PCR产物混有非特异扩增产物:优化PCR体系,提高特异性;胶回收PCR产物;鉴定更多的克隆。
b)、载体线性化不完全:如果线性化载体不是由空载体酶切或扩增制备,而是由已插入其他不同片段的载体酶切或扩增制备而成,不完全酶切或残留环状模板质粒将导致很高的转化背景,使部分克隆中含有不正确的插入片段。

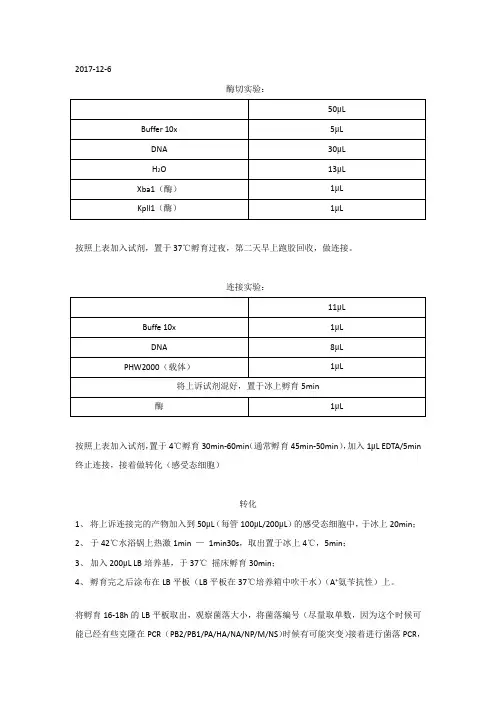
2017-12-6酶切实验:按照上表加入试剂,置于37℃孵育过夜,第二天早上跑胶回收,做连接。
连接实验:按照上表加入试剂,置于4℃孵育30min-60min(通常孵育45min-50min),加入1μL EDTA/5min 终止连接,接着做转化(感受态细胞)转化1、将上诉连接完的产物加入到50μL(每管100μL/200μL)的感受态细胞中,于冰上20min;2、于42℃水浴锅上热激1min —1min30s,取出置于冰上4℃,5min;3、加入200μL LB培养基,于37℃摇床孵育30min;4、孵育完之后涂布在LB平板(LB平板在37℃培养箱中吹干水)(A+氨苄抗性)上。
将孵育16-18h的LB平板取出,观察菌落大小,将菌落编号(尽量取单数,因为这个时候可能已经有些克隆在PCR (PB2/PB1/PA/HA/NA/NP/M/NS)时候有可能突变)接着进行菌落PCR,再将PCR产物进行琼脂糖电泳,确认该菌落是否是目的菌落。
PCR程序:95℃3min(2-3min是为了让大肠杆菌破裂释放核酸,如果95℃只设定了30s则大肠杆菌没法破裂,核酸释放不出来,PCR则很可能不成功;但是如果设立的时间为5min 则时间过于长,对酶不好);95℃30s,55℃30s;72℃1min30s,cycle x 30-35;72℃7min。
点突变(2017-12-18):设计引物:从需要突变的点左边和右边各选择12个碱基,碱基尽量以GC结尾(尽量不要以AT结尾)Sample(PR8 HA质粒)PCR体系(所用酶为PFu(F 530S (100))PCR程序:95℃30s;95℃30s,50℃(50-55)1min,68℃5min(载体3kb+ HA 1.7kb,该酶的效率为1kb/1min)cycle x 12-18(时常设定为15-18);72℃5min。
待PCR完毕,加入1uL DpnI(这种酶能特异性识别甲基化位点,当质粒进入细菌后会产生甲基化位点,所以新生成带突变位点的产物是不会被酶切的),置于37℃过夜(17:00放入孵箱,第二天早上8:00取出),接着做连接。

构建点突变实验报告1. 引物设计:根据需要验证的基因序列,设计需要扩增的基因片段引物。
引物设计方法如下:(1)引物F:5’端- 保护碱基序列+ 限制性内切酶1 酶切位点序列+ 基因正向引物序列- 3’端(2)引物R:5’端- 保护碱基序列+ 限制性内切酶2 酶切位点序列+ 基因反向引物序列- 3’通过加入基因组 DNA 模板以及设计好的引物进行目的基因的扩增,得到 PCR 产物后进行琼脂糖凝胶电泳验证条带大小,然后通过胶回收,获得纯化目的片段产物。
由于加入保护碱基,回收产物需要进行限制性内切酶切从而暴露黏性末端。
2. 线性化质粒:将原始的质粒载体,比如pcDNA3.1 质粒,选择合适的酶切位点,比如NheI/KpnI 进行酶切,获得线性化的质粒酶切体系一般选择50ul,试剂加好之后37°C 孵育6~8 小时,或适当延长时间,保证质粒酶切完全。
每隔一段时间振荡一下并离心以防液滴蒸发至管盖上。
酶切后载体通过切胶回收线性化载体3. 质粒连接:将线性化的载体与目的基因的连接,推荐在10~20μl 反应体系中进行连接反应,可以选择T4 酶进行黏性末端的连接4. 转化涂板:将连接产物转化到受体菌中(一般为DH5a),涂板,培养过夜。
次日,挑取平板上单克隆菌落进行摇菌, 送菌液测序,得到野生型质粒。
第二阶段: 突变型质粒构建在得到野生型质粒之后,下一步就是对目的基因片段进行突变啦,即将目的基因上面的一个碱基或多个碱基换成另外的碱基质粒突变的原理: 即通过设计引物, 并利用PCR 将模板扩增出来, 待突变的质粒通常来源于大肠杆菌等细菌,在细菌中会被甲基化修饰,而在体外通过PCR 扩增得到的质粒不会被甲基化这样用甲基化酶DpnI 酶处理,可以消化掉待突变的质粒模板,而使通过PCR 扩增出来的含有突变位点的质粒被选择性地保留下来。
1.突变引物设计: 向质粒进行单点或者多点突变,只需要设计一对引物,进行PCR 的扩增,替换掉野生型基因的突变位点碱基。

基因定点突变一、定点突变的目的把目的基因上面的一个碱基换成另外一个碱基。
二、定点突变的原理通过设计引物,并利用PCR将模板扩增出来,然后去掉模板,剩下来的就是我们的PCR 产物,在PCR产物上就已经把这个点变过来了,然后再转化,筛选阳性克隆,再测序确定就行了。
三、引物设计原则引物设计的一般原则不再重复。
突变引物设计的特殊原则:(1)通常引物长度为25~45 bp,我们建议引物长度为30~35 bp。
一般都是以要突变的碱基为中心,加上两边的一段序列,两边长度至少为11-12 bp。
若两边引物太短了,很可能会造成突变实验失败,因为引物至少要11-12个bp才能与模板搭上,而这种突变PCR要求两边都能与引物搭上,所以两边最好各设至少12个bp,并且合成多一条反向互补的引物。
(2)如果设定的引物长度为30 bp,接下来需要计算引物的Tm值,看是否达到78℃(GC含量应大于40%)。
(3)如果Tm值低于78℃,则适当改变引物的长度以使其Tm值达到78℃(GC含量应大于40%)。
(4)设计上下游引物时确保突变点在引物的中央位置。
(5)最好使用经过纯化的引物。
Tm值计算公式:Tm=0.41×(% of GC)–675/L+81.5注:L:引物碱基数;% of GC:引物GC含量。
四、引物设计实例以G CG→A CG为例:5’-CCTCCTTCAGTA TGTAG G CGACTTACTTA TTGCGG-3’(1)首先设计30 bp长的上下游引物,并将A (T)设计在引物的中央位置。
Primer #1: 5’-CCTTCAGTATGTAG A CGACTTACTTATTGC-3’Primer #2: 5’-GCAATAAGTAAGTCG T CTACATACTGAAGG-3’(2)引物GC含量为40%,L为30,将这两个数值带入Tm值计算公式,得到其Tm=75.5(Tm=0.41×40-675/30+81.5)。
1.染色体:在细胞分裂时形成的能被碱性染料着色的一类棒状小体。
2.同源染色体:形态和结构相同的一对染色体,其中一条来自父本,一条来自母本。
3.胚乳直感:在3n胚乳的性状上由于精核的影响而直接表现出父本的某些性状,称为胚乳直感或花粉直感。
4.直感现象:指杂交授粉后,父本花粉使母本所结杂交种子的胚以外组织直接表现父本性状的现象。
5.果实直感:如果种皮或果皮组织在发育过程中由于花粉影响而表现父本的某些性状。
6.转录:在细胞核内进行,以DNA的一条链为模板,按照碱基互补配对原则合成RNA的过程,通过转录,DNA的遗传信息传递到RNA上。
7.翻译:在细胞质中进行,以RNA为模板,在核糖体上把由tRNA运来的氨基酸按照mRNA上密码顺序,相互连接成为多肽链,并进一步折叠成为立体结构的蛋白质分子的过程。
8.点突变(基因突变):染色体上某一基因位点的内部发生了化学性质的变化,与原来基因形成对性关系,即一个基因变成了它的等位基因。
9.性状:生物所具有的形态结构特征和生理生化特性。
10.单位性状:在研究植物的性状遗传时,把植株所表现的性状总体区分为各个单位作为研究对象,区分开的性状称为单位性状。
11.相对性状:遗传学中把同一单位性状的相对差异称为相对性状。
12.显性性状:把杂种子一代中表现出的那个亲本性状称为显性性状。
13.隐性性状:把子一代中未表现出的性状称为隐性性状。
14.表现型:指生物体所表现的性状,包括形态特征和生理特征等。
15.基因型:指生物个体的基因组成。
16.不完全显性;杂种F1的性状表现是双亲性状的中间型,这称为。
17.☆复等位基因:同源染色体的相同座位上存在三个或三个以上的等位基因,这样的一组基因称为复等位基因,这种现象叫复等位现象。
18.连锁遗传:同一染色体上的某些基因以及他们所控制的性状结合在一起向后代遗传的现象。
19.相引相(相引组):不同的显性基因或不同的隐性基因联系在一起称相引相。
20.斥引相(斥引组):显性基因和隐性基因联合在一起称为斥引相。
定点突变和饱和突变是两种常用的蛋白质工程技术,它们都可以改变目标基因的序列,从而影响蛋白质的结构和功能。
但是,这两种技术也有很大的不同,主要体现在以下几个方面:突变的范围定点突变是指在目标基因的特定位点上,引入预先设计好的碱基替换、插入或缺失,从而产生特定的氨基酸替换、添加或删除的突变体。
定点突变的目的是根据已有的关于蛋白质结构、功能、催化机理等信息,有目的地改变蛋白质性能或特异性。
饱和突变是指在目标基因的某一位点或某几个位点上,将原来的碱基替换成所有可能的其他碱基,从而产生所有可能的氨基酸替换的突变体。
饱和突变的目的是探索蛋白质功能和结构之间的关系,以及寻找具有改善或新颖性能的蛋白质突变体。
因此,定点突变是一种有选择性的突变技术,它只改变目标基因中感兴趣的部分;而饱和突变是一种无选择性的突变技术,它改变目标基因中所有可能的部分。
突变的方法定点突变通常采用PCR方法来实现,即利用合成的含有突变碱基的引物来扩增目标基因片段,并将其克隆到载体中。
这种方法虽然能够在特定位点引入特定碱基突变,但一次只能引入一种突变碱基,若进行饱和突变需要合成多条突变引物。
这样做既费时又费力,而且容易出错。
饱和突变则采用其他更高效和简便的方法来实现,比如使用简并密码子、随机引物、DNA重组等技术。
简并密码子是指可以编码多种氨基酸的密码子,比如NNK或NNS(N表示任意碱基,K表示G或T,S表示G或C),它们可以编码20种氨基酸中的19种(除了色氨酸)。
随机引物是指含有随机碱基序列的引物,它们可以产生各种不同组合的密码子。
DNA重组是指利用限制性内切酶、连接酶等酶来切割和连接不同来源或不同位置的DNA片段,从而产生新型DNA序列。
这些方法都可以在目标基因上产生大量不同类型和位置的突变,并且操作简单快速。
突变的效果定点突变和饱和突变对蛋白质性能和稳定性的影响也不尽相同。
定点突变通常是根据已知信息进行设计和预测的,因此它们往往能够达到预期的效果,比如增强或减弱蛋白质活性、改善或降低蛋白质亲和力、增加或减少蛋白质稳定性等。
基因定点突变方法及其应用摘要:本文综述了基因定点突变的三种方法,在此基础上的一些改进方法及其应用,并对这三种方法进行了比较。
关键词:定点突变;寡核苷酸引物;PCR;盒式突变Methods of Site-directed Mutagenesis and Their ApplicationAbstract: In the paper,methods of site-directed mutagenesis,some advanced methods on the basic methods and their application are present. At the same time,the comparison are made .Key words: site-directed mutagenesis;oligonucleotide;PCR;cassette mutagenesis定点突变技术可以随心所欲地在已知DNA序列中取代、插入或缺失一定长度的核苷酸片段。
该方法比使用化学因素、自然因素导致突变的方法具有突变牢高、简单易行、重复性好的特点;除用于改变核苷酸序列获得突变基因、研究基因的结构与功能的关系之外,还能够通过改变特定的氨基酸获得突变蛋白质,研究蛋白质的结构与功能,从微观水平上阐明正常状态下基因的调控机理、疾病的病因和机理。
随着分子生物学研究的突飞猛进,基因定点突变技术成为一项重要的分子生物学实验技术手段,在生物和医学领域中的应用非常广泛。
目前常用的定点突变方法有寡核苷酸引物介导的定点突变、PCR介导的定点突变及盒式突变等[1]。
1常用定点突变方法1.1核苷酸引物介导的定点突变其原理是用含有突变碱基的寡核苷酸片段作引物,在聚合酶的作用下启动DNA分子进行复制。
主要的过程(见图1):①将待突变基因克隆到突变载体上;②制备含突变基因的单链模板;③引物与模板退火5’端磷酸化的突变寡核苷酸引物,与待突变的核苷酸形成一小段碱基错配的异源双链的DNA,④合成突变链:在DNA聚合酶的催化下,引物以单链DNA为模板合成全长的互补链,而后由连接酶封闭缺口,产牛闭环的异源双链的DNA分子;⑤转化和初步筛选异源双链DNA分子转化大肠杆菌后,产生野生型、突变型的同源双链DNA分子。
定点突变问题交流我现在做定点突变3个月,可是一直变不回去!我的基因长1700bp,要突变的碱基在600bp 处,用的宝生物的突变试剂盒,每次按说明书实验后一测序,就是没有突变掉.试剂盒里的酶用的是pyrobest高保真的,高保真的一般扩增长片断有点难,后来我又用了LA酶,但这个酶在扩增后产物末端会多个A,也不行!求高手指点一下,三个月过去了没有个结果,急啊!你的这个基因太长,而且你要突变的碱基在600多的位置,不好突变,也没有办法突变。
因为在中间没有办法通过引物来引入突变碱基。
我建议你把你的片断分成两端来扩,一段有突变,一段没有突变,分别设计引物,最后把这两段连起来就可以了,当然这样做是很麻烦,至少可以去试一试。
突变是可以的,把基因片段连接到一个载体上,然后在要突变处设计一对反向互不的引物,三十多个碱基的,把要突变的碱基放在正中间,然后拿构建好的载体当模板扩增,再用dpnI 消化掉质粒模板,将已经形成环状的PCR产物(带两个缺口)转化进大肠杆菌就可以。
具体的方法原因可以参考分子克隆,strategene公司、赛百盛公司也有这类的定点突变试剂盒。
takara的那个试剂盒应该也可以,但我总觉得那些步骤对操作要求太高,还要乙醇沉淀什么的,太麻烦。
我最近在做跟你一样的,基因也是1700,在600bp也有一个突变,不过还有其它的突变位点,我是这么做的:在突变位点设计两个引物,一个正义,一个反义,当然在引物中已经包含突变了,而且两个引物完全互补共25bp。
用这两个引物分别和上游和下游的另外两个不含突变的引物在模板也就是质粒上面扩增(用高保真酶),得到没有末端加A的600bp 和1100bp片段,然后重叠PCR得到突变的全长基因(因为他们有25bp的重叠),我现在已经做成功四个了,还有三个没有成功(共七个点突变),正在努力。
这种方法分子克隆上面有,另外我还试过另一种方法,大引物法,就是用刚才这个600bp的片段做引物在原模板质粒上面做单引物扩增20循环,然后加两边的引物,这样也能做出来,但是这里因为加了原模板,所以不能保证它完全突变了,需要筛克隆(这个分子克隆上面也有,你可以参考一下。
基因定点突变一、定点突变的目的把目的基因上面的一个碱基换成另外一个碱基。
二、定点突变的原理通过设计引物,并利用PCR将模板扩增出来,然后去掉模板,剩下来的就是我们的PCR 产物,在PCR产物上就已经把这个点变过来了,然后再转化,筛选阳性克隆,再测序确定就行了。
三、引物设计原则引物设计的一般原则不再重复。
突变引物设计的特殊原则:(1)通常引物长度为25~45 bp,我们建议引物长度为30~35 bp。
一般都是以要突变的碱基为中心,加上两边的一段序列,两边长度至少为11-12 bp。
若两边引物太短了,很可能会造成突变实验失败,因为引物至少要11-12个bp才能与模板搭上,而这种突变PCR要求两边都能与引物搭上,所以两边最好各设至少12个bp,并且合成多一条反向互补的引物。
(2)如果设定的引物长度为30 bp,接下来需要计算引物的Tm值,看是否达到78℃(GC含量应大于40%)。
(3)如果Tm值低于78℃,则适当改变引物的长度以使其Tm值达到78℃(GC含量应大于40%)。
(4)设计上下游引物时确保突变点在引物的中央位置。
(5)最好使用经过纯化的引物。
Tm值计算公式:Tm=0.41×(% of GC)–675/L+81.5注:L:引物碱基数;% of GC:引物GC含量。
四、引物设计实例以G CG→A CG为例:5’-CCTCCTTCAGTA TGTAG G CGACTTACTTATTGCGG-3’(1)首先设计30 bp长的上下游引物,并将A (T)设计在引物的中央位置。
Primer #1: 5’-CCTTCAGTATGTAG A CGACTTACTTATTGC-3’Primer #2: 5’-GCAATAAGTAAGTCG T CTACATACTGAAGG-3’(2)引物GC含量为40%,L为30,将这两个数值带入Tm值计算公式,得到其Tm=75.5(Tm=0.41×40-675/30+81.5)。