二氧化碳的制备性质及相对分子量的测定课件
- 格式:ppt
- 大小:719.00 KB
- 文档页数:16




实验项目二氧化碳的制备及其相对分子质量的测定二氧化碳(CO2)为空气中常见化合物之一,被认为是造成温室效应的主要来源。
常温下CO2是一种无色无味气体,密度略大于空气,能溶于水,并生成碳酸。
液态CO2和超临界CO2均可作为溶剂,其超临界比液体状态具有更高的溶解性(具有与液体相近的密度和高溶解性,并兼备气体的低粘度和高渗透力)。
液体CO2可作为织物的清洗剂,洗涤后液体CO2可通过减压变成气体很容易和织物分离,完全省去了用传统溶剂清洗带来的复杂后处理过程。
液态CO2蒸发时会吸收大量的热,当它释放大量的热则凝成固体CO2,俗称干冰。
干冰的使用范围很广,在食品、卫生、工业、餐饮及人工降雨等领域都有应用。
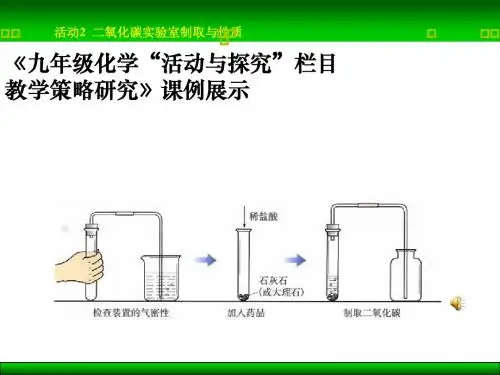
本实验由大理石和稀盐酸在启普气体发生器中反应制得二氧化碳,然后根据阿伏伽德罗定律的基本原理测定其相对分子质量。
一、实验目的1. 学习气体相对密度法测定相对分子质量的原理和方法。
2. 加深理解理想气体状态方程式和阿佛加德罗定律。
3. 巩固启普气体发生器的使用,熟练掌握气体的发生、净化、干燥和收集等基本操作。
二、实验原理阿伏伽德罗定律:同温、同压、同体积的气体含相同的分子数,即摩尔数相同。
根据阿伏伽德罗定律,对于p、V、T相同的A、B两种气体,若以m A、m B分别代表体积的A、B两种气体的质量,M A、M B分别代表A、B两种气体的相对分子质量。
其理想气体状态方程式分别为:对于气体A: p V=m A/M A RT对于气体B: p V=m B/M B RT由以上两式整理得:m A/ m B =M A /M B通过上式可知,利用相同温度、体积、压强下的二氧化碳质量(m CO2)、空气质量m空气和已知的空气平均相对分子质量可计算出二氧化碳的相对分子质量(M CO2)。
先根据实验时测得的大气压(p)和室温(T)由理想气体状态方程计算得到体积为V的空气质量m空气,再利用实验测得的(CO2 + 瓶+ 塞)的平均总质量及(空气+ 瓶+ 塞)的总质量G1(g)差值即m CO2﹣m空气,计算得到同体积的二氧化碳气体质量m CO2。




