利妥昔单抗说明书
- 格式:docx
- 大小:24.14 KB
- 文档页数:18

利妥昔单抗注射液生物类似药临床试验指导原则(征求意见稿)一、概述利妥昔单抗(Rituximab)是一种采用基因工程技术合成的人鼠嵌合单克隆抗体,由人源IgG1 kappa恒定区和鼠源CD20抗体可变区组成,可在中国仓鼠卵巢(CHO)细胞中表达,利妥昔单抗能特异性结合B细胞表面跨膜蛋白CD20,通过抗体依赖细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)两种途径杀伤CD20阳性的B淋巴细胞。
利妥昔单抗由Genentech公司原研,1997年获得美国FDA批准上市,通用名为利妥昔单抗(Rituximab),商品名为RITUXAN®,之后该药物在欧洲(商品名MabThera®)和日本等地相继上市,适应症为:(1) 非霍奇金淋巴瘤(NHL);(2) 慢性淋巴细胞白血病(CLL);(3) 类风湿性关节炎(RA);(4) 多血管性肉芽肿(GPA)和显微镜性多发性血管炎(MPA)。
2000年利妥昔单抗在中国上市,商品名为美罗华®,批准的适应症[1]:(1)非霍奇金淋巴瘤:先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤患者,应与化疗联合使用;初治滤泡性淋巴瘤患者经美罗华联合化疗后达完全或部分缓解后的单药维持治疗;复发或化疗耐药的滤泡性淋巴瘤;CD20阳性弥漫大B 细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
(2)慢性淋巴细胞白血病:与氟达拉滨和环磷酰胺(FC)联合治疗先前未经治疗或复发性/难治性慢性淋巴细胞白血病(CLL)患者。
利妥昔单抗注射液原研产品中国专利已于2013年到期,多家国内外制药企业加入其生物类似药的研发。
国家药品监督管理局(NMPA)于2019年2月批准上市的上海复宏汉霖生物制药有限公司的利妥昔单抗注射液(汉利康®),为国内首个获批的利妥昔单抗生物类似药。
为进一步明确技术审评标准,提高企业研发效率,本文在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》基础上(以下简称“指导原则”)[2],结合利妥昔单抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为国内利妥昔单抗生物类似药的临床研发提供参考。


利妥昔单抗 (Rituximab) 抗癌药物利妥昔单抗(Rituximab)抗癌药物利妥昔单抗(Rituximab)是一种被广泛应用于治疗恶性淋巴瘤的单克隆抗体药物。
本文将详细介绍利妥昔单抗的药理作用、临床应用和不同类型癌症的疗效,以及可能出现的副作用等。
一、药理作用利妥昔单抗通过靶向CD20抗原,作用于B淋巴细胞表面,并激活与之结合的免疫细胞,从而诱导细胞相关的免疫毒性。
其抗肿瘤机制包括:1. 诱导细胞凋亡:利妥昔单抗可以直接诱导B细胞凋亡,从而抑制肿瘤细胞增殖;2. 细胞相关的免疫毒性:利妥昔单抗激活免疫细胞(如自然杀伤细胞和巨噬细胞),促进其对肿瘤细胞的攻击;3. 通过抗体介导的依赖性细胞毒性(ADCC):利妥昔单抗激活免疫系统,使得肿瘤细胞遭受免疫细胞(如自然杀伤细胞和单核细胞)更多的攻击。
二、临床应用利妥昔单抗在治疗恶性淋巴瘤方面取得了显著的成果,尤其是对于CD20阳性(CD20+)的非霍奇金淋巴瘤。
其临床应用主要包括:1. 弥漫性大B细胞淋巴瘤(DLBCL):利妥昔单抗与化疗联合应用可作为DLBCL的一线治疗,同时也可用于复发或难治性病例的治疗。
2. 滑膜型大B细胞淋巴瘤(FL):利妥昔单抗可用于FL的一线治疗,也可用于复发或难治性FL的治疗。
3. 慢性淋巴细胞白血病(CLL):利妥昔单抗可与其它化疗药物联合应用,提高治疗效果。
同时,对于CD20阳性CLL的患者,利妥昔单抗也可作为首选单药治疗。
4. 自身免疫性血小板减少性紫癜(ITP):利妥昔单抗可用于ITP患者的二线治疗,对于对其他治疗方法无效的患者尤为适用。
三、疗效与副作用临床研究发现,利妥昔单抗在恶性淋巴瘤治疗中的有效率约为80%左右。
然而,利妥昔单抗也可能引起一些不良反应,包括:1. 过敏反应:包括寒战、低血压、皮疹等。
因此,使用利妥昔单抗前需要进行预防性药物治疗,以减轻过敏反应的风险;2. 感染:利妥昔单抗可能降低免疫功能,导致感染的风险增加。

利妥昔单抗注射液治疗慢性淋巴细胞白血病致过敏性休克1例彭晔;张旭刚;谢娜;韩轶超【期刊名称】《医药导报》【年(卷),期】2014(000)010【总页数】2页(P1325-1326)【关键词】利妥昔单抗注射液;过敏性休克;不良反应【作者】彭晔;张旭刚;谢娜;韩轶超【作者单位】哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000【正文语种】中文【中图分类】R979.1;R733.4患者,男,56岁。
主因肝脾大2个月入院。
腹部超声:肝脾大性质待定;血常规:白细胞4.79×109·L-1,红细胞3.33×1012·L-1,血小板26.2×109·L-1,淋巴细胞百分比0.578;北京协和医院骨穿刺结果:慢性淋巴细胞性白血病(chronic lymphocytic leukaemia,CLL);中国医学科学院血液病医院会诊骨穿刺检查:符合边缘区细胞淋巴瘤侵犯骨髓,免疫组化显示:CD3小灶阳性,CD5小灶阳性,CD20广泛阳性,CD10阴性,CD68少数阳性,CD138阴性,CD23阴性,CD43小灶阳性,CyclinD1阴性,PAX-5阴性,Bcl-6阴性;电子显微镜超微结构检查报告:骨髓含高分化幼稚淋巴细胞,不排除CLL。
既往身体健康,无药物过敏史。
诊断为:CLL、肝脏、脾脏、骨髓受侵。
给予R-FC方案两个疗程治疗,即利妥昔单抗注射液(商品名:美罗华,上海罗氏制药有限公司,批号:SH0025),首次应用375 mg·(m2)-1·d-1,第2个疗程500 mg·(m2)-1·d-1,iv,第1天;氟达拉滨25 mg·(m2)-1·d-1,iv,第2~3天;环磷酰胺250 mg·(m2)-1·d-1,iv,第2天。

血液肿瘤用药利妥昔单抗 rituximab
制剂与规格:针剂:100mg(10ml)/瓶、500mg(50ml)/瓶
适应证:
1. 有治疗指征的滤泡性非霍奇金淋巴瘤。
2.CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)。
合理用药要点:
1.接受利妥昔单抗治疗后最常见的不良反应是输注相关反应,主要在首次输注时发生,症状可表现为:恶心、瘙痒、发热、风疹/皮疹、畏寒、寒战、喷嚏、血管神经性水肿、咽喉刺激、咳嗽和支气管痉挛,同时伴有或不伴有与药物治疗相关的低血压或高血压。
每次滴注利妥昔单抗前应预先使用抗过敏药物。
如果所使用的治疗方案不包括糖皮质激素时,还应该预先使用糖皮质激素。
2.在接受利妥昔单抗和抑制细胞增殖药物化疗的患者中,已报告发生乙型肝炎再激活的病例。
应在开始利妥昔单抗治疗前对所有患者根据当地指南进行乙肝病毒(HBV)的筛查,至少应包括乙肝表面抗原(HBsAg)和乙肝核心抗体(HBcAb)
指标。
不应对活动性乙肝患者使用利妥昔单抗进行治疗。
3.禁用于严重活动性感染或免疫应答严重损伤(如低球蛋白血症,CD4或CD8细胞计数严重下降)患者及严重心衰[纽约心脏病学会(NYHA)分类Ⅳ级]患者;妊娠期间禁止利妥昔单抗与甲氨蝶呤联合用药。
4.利妥昔单抗给药需要严格遵循说明书用法用量,尤其需要注意起始滴速的控制。
5.对用药患者进行严密监护,监测是否发生细胞因子释放综合征及肿瘤溶解综合征。
6.预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部影像学检查。
7.各线治疗慢性淋巴细胞白血病/小淋巴细胞淋巴瘤以及CD20+的非霍奇金淋巴瘤(FDA批准的其他适应证)。

qd2001是一种新型的抗癌药物,它的主要成分包括一种叫做利妥昔单抗的药物,以及一些免疫调节剂。
利妥昔单抗是一种人鼠嵌合的抗CD20的单克隆抗体,可以特异性地与CD20抗原结合,从而清除体内的B细胞,减少肿瘤细胞的生长和扩散。
免疫调节剂则可以增强机体的免疫功能,提高机体的抗肿瘤能力。
利妥昔单抗和免疫调节剂的组合使用,可以有效地抑制肿瘤细胞的生长和扩散,提高患者的生存率和生活质量。
这种药物对淋巴瘤等癌症具有很好的治疗效果,目前已经得到了广泛的应用。
使用qd2001需要注意以下几点。
首先,患者在接受治疗前需要进行全面的身体
检查,确保没有严重的肝、肾、心等器官疾病。
其次,患者在治疗期间需要严格按照医生的建议进行用药,不能自行更改剂量或停药。
此外,患者在治疗期间需要注意保持良好的生活习惯,如饮食、运动等,以促进康复。
总之,qd2001是一种新型的抗癌药物,其主要成分包括利妥昔单抗和免疫调节剂,可以有效地抑制肿瘤细胞的生长和扩散,提高患者的生存率和生活质量。
使用qd2001需要注意身体检查、用药建议和良好的生活习惯等方面,以确保治疗的安全和有效性。

国家药监局关于修订注射用辅酶A说明书的公告美国警示阿替利珠单抗联合紫杉醇用于乳腺癌治疗的有效性和潜在安全性问题根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对注射用辅酶A 说明书警示语、【不良反应】、【注意事项】及特殊人群用药项进行修订。
现将有关事项公告如下。
警示语增加以下内容:本品可以起过敏性休克等严重过敏反应,严重者可导致死亡。
须在有抢救条件的医疗机构使用。
对本品过敏者禁用,本品禁用于静脉推注。
【不良反应】项增加以下内容:①全身性反应:寒战、胸痛、发热、高热、疼痛、乏力等。
②皮肤及其附件:皮疹(斑丘疹、荨麻疹、红斑疹等)、瘙痒、出汗增加、潮红等。
③消化系统:恶心、呕吐、腹痛、腹泻、口干等。
④免疫系统功能紊乱和感染:过敏样反应、过敏反应、输液反应、过敏性休克等。
⑤呼吸系统:呼吸困难、呼吸急促、咳嗽、通气过度、喉头水肿等。
⑥心血管系统:心悸、紫绀、高血压、心动过速、低血压等。
⑦神经系统:头晕、头痛、感觉消退、肌肉不自主收缩、震颤等。
⑧其他:静脉炎等。
【注意事项】增加以下内容:①对该药有过敏史禁用。
过敏体质者慎用。
②用药过程中要密切监测,如出现寒战、胸闷、呼吸困难、心悸、口唇紫绀、血压下降等症状和体征,应立即停药并及时治疗。
③静脉滴注速度不宜过快。
【孕妇及哺乳期妇女用药】增加以下内容:缺乏相关研究资料。
【儿童用药】增加以下内容:目前尚无儿童应用本品的系统性研究资料。
美国食品药品管理局(FDA )近期发布安全性沟通信息,警示医务人员、肿瘤临床试验研究者以及患者,一项临床试验显示,对于之前没有接受过治疗、且无法手术的局部晚期或转移性三阴性乳腺癌(mTNBC )患者,阿替利珠单抗(atezolizumab ,商品名Tecentriq 泰圣奇)与紫杉醇联合治疗不能发挥作用。
FDA 尚未批准阿替利珠单抗联合紫杉醇用于乳腺癌治疗,但已批准阿替利珠单抗联合白蛋白结合型紫杉醇(商品名Abraxane )用于肿瘤表达PD-L1的成年三阴性乳腺癌患者的治疗。


抗肿瘤药物的用药顺序及溶媒选择原则(1)药物相互作用原则? ?有的化疗药物之间会发生相互作用,从而改变药物的体内过程,可能影响疗效或毒性。
如顺铂影响紫杉醇的清除率,先用紫杉醇再用顺铂。
(2)刺激性原则? ?使用非顺序依赖性化疗药物时,应先用对组织刺激性较强的药物,后用刺激性小的药物。
由于治疗开始时静脉尚未损伤,结构稳定性好,药业渗出机会少,药物对静脉引起的不良反应较小如长春瑞滨和顺铂合用时,长春瑞滨刺激性强,宜先给药。
(3)细胞动力学原则? ? 生长较慢的实体瘤处于增殖期的细胞较少,G0期细胞较多,先用周期非特异性药物杀灭一部分肿瘤细胞,使肿瘤细胞进入增殖期再用周期特异性药物。
顺铂和依托泊苷合用时,先用顺铂后用VP-16。
? ? 生长快的肿瘤先用周期特异性药物大量杀灭处于增殖周期的细胞,减少肿瘤负荷,随后用周期非特异性药物杀灭残存的肿瘤细胞。
用药顺序1、联用顺铂化疗化疗方案? ? ? ???联用药物? ? ? ? 用药顺序? ? ? ? 原因GP? ? ? ? 吉西他滨? ? ? ? 先用GEM? ? ? ? 顺铂会影响吉西他滨的体内过程,加重骨髓抑制。
TP? ? ? ???紫杉醇? ? ? ? 先用PTX? ? ? ? 顺铂对细胞色素P450酶有调节作用,可使PTX清除率大约降低33%,产生更为严重的骨髓抑制FP ? ? ? ? 5-FU? ? ? ? 先用DDP? ? ? ? 小剂量DDP能够增加细胞内蛋氨酸, 使细胞内活性叶酸生成增加, 从而增加5-FU的抗肿瘤作用。
PP? ?? ?? ?培美曲塞? ? ? ? 先用Alimta,30min后用顺铂? ? ? ? 说明书2、联合长春新碱化疗化疗方案? ? ? ???联用药物? ? ? ???用药顺序? ? ? ?? ?? ?? ?? ?? ?? ?? ? 原因CHOP? ? ? ? 环磷酰胺? ? ? ? 先用VCR,6-8小时后在给CTX? ? ? ?? ?? ?VCR具有同步化作用,使细胞停滞在M期,约6~8h后细胞同步进入G1期,再用CTX可增效VCM? ? ? ???甲氨蝶呤? ? ? ???先用VCR? ? ? ?? ?? ?? ?? ?? ?? ?? ?? ?? ?? ?? ???VCR阻止甲氨蝶呤从细胞内渗出而提高细胞内浓度VDLP ? ? ? ? 门冬酰胺酶? ? ? ? 先用VCR? ? ? ?? ?? ?? ?? ?? ?? ?? ?合用加重神经系统血液系统毒性,先于门冬12~24小时给药3、甲氨蝶呤化疗方案? ? ? ???联用药物? ? ? ???用药顺序? ? ? ?? ?? ?? ?? ?? ?? ? 原因CMF? ? ? ? 5-FU? ? ? ? 用MTX4~6h后用5-FU? ? ? ? 序贯抑制 MTX----二氢叶酸还原酶抑制剂 5-FU-----胸腺嘧啶合成酶抑制剂VCM? ? ? ???甲氨蝶呤? ? ? ???先用VCR? ? ? ?? ?? ?? ?? ?? ?? ?? ?? ?? ?? ?阻止甲氨蝶呤从细胞内渗出而提高细胞内浓度,先注射VCR? ? ? ? 门冬酰胺酶??使用门冬酰胺酶10日后使用本品或者使用本品24小时后给予门冬酰胺酶? ? ? ? 门冬酰胺酶能抑制蛋白质的合成,使细胞停止于G 1 期,不能进入S期,从而降低其对MTX的敏感性。

•指南与共识•利妥昔单抗静脉快速输注中国专家共识(2020年版)扫码阅读电子版中国老年保健协会淋巴瘤专业委员会中华医学会血液学分会通信作者:黄慧强,中山大学胖瘤防治中心胖瘤内科,广州 510060,Email:huanghq@【摘要】利妥昔单抗上市20多年以来,在临床实践中疗效和安全性良好。
美国食品药品管理局(FD A)于2012年批准了利妥昔单抗的静脉快速输注用于第2个及后续疗程。
目前,利妥昔单抗90 min静脉快速输注方案已在国外成熟应用,美国国立综合癌症网络(NCCN)指南中也推荐第1个疗程利妥昔单抗输注未出现输注反应的患者,后续疗程可进行利妥昔单抗90 min静脉快速输注。
我国也有研究数据证实了利妥昔单抗90 1^»静脉快速输注方案的安全性和耐受性。
因此,基于国内外循证医学证据,为了提高患者的就诊质量以及节约医疗成本,本专家共识推荐,对于首次输注未发生明显不良反应的患者,后续疗程可使用利妥昔单抗90 min静脉快速输注方案。
【关键词】淋巴瘤,非霍奇金;利妥昔单抗;静脉快速输注;输注相关反应DOI: 10.3760/l 15356-20201030-00259Chinese expert consensus on rapid infusion of rituximab (2020 version)Lymphoma Committee of Chinese Aging Well Association, Chinese Society of Hematology, Chinese MedicalAssociationCorresponding author: Huang Huiqiang, Department of Oncology, Sun Yat-sen University Cancer Center,Guangzhou 510060, China, Email:******************.cn【Abstract】Rituximab has received marketing authorization for more than 20 years and has goodefficacy and safety in clinical practice. The U. S. Food and Drug Administration (FDA) approved a rapidinfusion of rituximab for the second and subsequent cycles of treatment in 2012. Nowadays, the 90-minuterapid infusion of rituximab in foreign countries has been maturely applied. The National Comprehensive CancerNetwork (NCCN) guidelines also recommend a 90 - minute rapid infusion of rituximab for the second andsubsequent cycles of rituximab to patients who do not experience infusion - related reactions during the firstcycle of rituximab infusion. In China, there are emerging research data confirming the safety and tolerability ofthe 90-minute rapid infusion of rituximab. Therefore, based on evidences from evidence - based medicine athome and abroad, in order to improve the quality of patients' hospital visits and further save healthcare costs,this expert consensus recommends the use of 90-minute rapid infusion of rituximab for patients who have noobvious adverse reactions during the first cycle of infusion.【Keywords】Lymphoma, non-Hodgkin; Rituximab; Rapid infusion; Infusion related reactionsDOI : 10.3760/l 15356-20201030-00259利妥昔单抗是一种靶向CD20的单克隆抗体,能 显著改善CD20阳性非霍奇金淋巴瘤(NHL)患者的预 后。
利妥昔单抗说明书 Document number:PBGCG-0857-BTDO-0089-PTT1998利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含0.9%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
如再次发生相同的严重不良反应,应考虑停药。
利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类 B 、C和D 亚型的 B 细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大 B 细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8 个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含0.9% 生理盐水或 5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为 1mg/ml 。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24 小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前 30 到 60 分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部 X 线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
利妥昔单抗致间质性肺炎1例晏远智1ꎬ马开利2(1.昆明医科大学第一附属医院药剂科ꎬ昆明㊀650031ꎻ2.中国医学科学院医学生物学研究所药物安全性评价研究中心ꎬ昆明㊀650000)关键词㊀利妥昔单抗ꎻ间质性肺炎ꎻ药品不良反应中图分类号㊀R979.1ꎻR969.3㊀㊀㊀文献标识码㊀B㊀㊀㊀文章编号㊀1004-0781(2020)05-0713-02DOI㊀10.3870/j.issn.1004 ̄0781.2020.05.031㊀㊀㊀㊀㊀开放科学(资源服务)标识码(OSID)1㊀病例介绍㊀患者ꎬ男ꎬ54岁ꎬ2016年5月因 不明原因头痛㊁头晕伴阵发性呕吐半个月余 就诊ꎬ行颅脑磁共振(MRI)检查提示:右侧小脑半球及蚓部区域占位病变ꎬ伴周围实质性水肿ꎬ考虑颅内原发肿瘤ꎬ行占位切除伴去骨瓣减压术ꎮ手术后病理检查提示:弥漫大B细胞淋巴瘤ꎬ骨髓未见明确淋巴瘤细胞浸润ꎬ全身CT平扫无明显肿大淋巴结ꎮ诊断:原发性中枢神经系统淋巴瘤ꎮ患者于2016年6月10日开始以大剂量甲氨蝶呤+地塞米松方案联合化疗6个周期ꎬ后予以全脑三维适形放疗ꎬ治疗后行颅脑MRI检查ꎬ评估结果为完全缓解ꎮ患者2017年1月 2018年1月在当地医院复查ꎬ病情稳定ꎮ2018年3月因 头痛伴视物模糊 再度入院ꎬ复查颅脑MRIꎬ提示原位复发ꎮ2018年3月21起以利妥昔单抗+替莫唑胺方案联合化疗2个周期ꎬ28d为1个疗程ꎮ具体用药方案为:利妥昔单抗(上海罗氏制药有限公司ꎬ批号:SH0130)600mgꎬ静脉滴注ꎬ第1天ꎬ替莫唑胺300mgꎬpoꎬqdꎬ第1~5天ꎮ2个疗程后复查颅脑MRIꎬ达到完全缓解ꎮ2018年5月26日开始患者出现间断性发热ꎬ约38.5ħꎮ偶有胸闷气促ꎬ未见恶心呕吐㊁咳嗽咯痰ꎮ听诊双肺呼吸音清ꎬ未闻及明显干湿啰音ꎻ血常规检查提示白细胞7.46ˑ109 L-1ꎬ红细胞4.06ˑ1012 L-1ꎬ中性粒细胞68.8%ꎻ辅助检查:降钙素原0.48ng mL-1ꎬ超敏C ̄反应蛋白0.88mg L-1ꎻ动脉血气:pH值7.42ꎬ血氧分压(PaO2)8.11kPaꎬ二氧化碳分压收稿日期㊀2019-02-27㊀修回日期㊀2019-06-12作者简介㊀晏远智(1984-)ꎬ女ꎬ云南昆明人ꎬ主管药师ꎬ硕士ꎬ主要研究方向:临床药理学及药物评价ꎮORCID:0000 ̄0002 ̄0747 ̄1599ꎮ电话:0871-65324888ꎬE ̄mail:82940860@qq.comꎮ通信作者㊀马开利(1981-)ꎬ男ꎬ云南昆明人ꎬ副研究员ꎬ硕士生导师ꎬ博士ꎬ主要研究方向:神经药理学㊁疫苗毒理学及疾病动物模型构建ꎮ电话:0871-68408567ꎬE ̄mail:makaili@imbcams.com.cnꎮ(PaCO2)3.99kPaꎬ血氧饱和度82%ꎮ经验性给予头孢哌酮钠舒巴坦钠(2 1)3g+0.9%氯化钠注射液100mLꎬ静脉滴注ꎬq12hꎬ抗细菌感染及其他支持治疗ꎬ并留取痰液及血样做病原微生物检测ꎬ治疗后患者仍然高热ꎬ且气促呈进行性加重ꎮ2018年9月9日复查胸部CTꎬ提示双肺纹理征网格状ꎬ紊乱不清ꎬ双侧肺门无淋巴结肿大及阴影形成ꎬ结合患者细菌㊁真菌㊁病毒等相关病原学检查均无阳性发现ꎬ考虑为间质性肺部炎性病变ꎮ立即调整治疗方案ꎬ采用大剂量糖皮质激素(注射用甲泼尼龙琥珀酸钠320mgꎬ静脉滴注ꎬqd)冲击治疗3dꎬ随后40mgꎬ静脉滴注ꎬqdꎬ维持治疗ꎬ6d后临床症状明显改善ꎬ10d后复查CTꎬ显示病灶较前明显吸收ꎬ肺功能指标改善ꎬ患者急性症状得到控制ꎬ而后改用口服类固醇激素序贯治疗ꎬ4周后停药ꎮ患者化疗前胸部CT片未见异常ꎬ无药物㊁食物过敏史或可能导致间质性肺炎的环境接触史ꎬ且病原微生物检测结果均为阴性ꎮ经查阅患者所用药物的美国食品药品管理局(FDA)说明书和相关文献ꎬ除利妥昔单抗之外ꎬ未发现所用替莫唑胺㊁甲泼尼龙琥珀酸钠㊁头孢哌酮钠舒巴坦钠和其他支持治疗药物有间质性肺炎的不良反应的报道ꎬ采用WHO ̄UMC推荐的 药品 ̄事件关联性评价方法 [1 ̄2]ꎬ按照其中因果关系评价准则:①用药与不良反应出现的时间顺序是否合理ꎻ②以往是否有该药不良反应的报道ꎻ③发生不良反应后撤药的结果ꎻ④不良反应症状消除后再次用药出现的情况ꎻ⑤有无其他原因或混杂因素进行分析ꎬ并结合利妥昔单抗可致药物性间质性肺炎的不良反应和患者使用利妥昔单抗与出现肺损伤的时间存在关联性ꎬ结论为 很可能 ꎬ因而临床最终诊断为:药物性肺损伤ꎮ2㊀讨论㊀间质性肺疾病(interstitiallungdiseaseꎬILD)是由程度不同的炎症与纤维化导致肺实质受损的一组非肿瘤性疾病ꎬ可累及肺间质㊁肺泡腔㊁周围气道和血管等部位ꎮ间质性肺炎是ILD最常见的一种表现形式ꎬ其317医药导报2020年5月第39卷第5期以弥漫性肺实质㊁肺泡炎和间质纤维化为基本的病理改变ꎬ早期症状通常不明显ꎬ随着病程发展可表现为活动性呼吸困难㊁气短㊁气促㊁胸闷等ꎻ胸部CT检查表现为双肺磨玻璃影㊁网格状㊁蜂窝状㊁斑片状影ꎻ肺功能检查可出现限制性通气障碍㊁弥散功能降低及低氧血症[3 ̄5]ꎮ病毒感染是其最常见的病因ꎬ少数可由药物引起[6]ꎬ如博莱霉素㊁环磷酰胺㊁利妥昔单抗㊁他克莫司等[7 ̄8]ꎮ利妥昔单抗是第一个针对B细胞淋巴瘤表面CD20抗原研制的人鼠嵌合性单克隆抗体ꎬ其不良反应大多轻到中度ꎬ最常见的是输液反应ꎬ包括发热㊁寒战等ꎬ严重呼吸道不良事件少见ꎮ利妥昔单抗相关的间质性肺炎的发病率在上市最初的报道中非常低ꎬ为0.01%~0.03%[9]ꎬ然而ꎬ在上市几年后的报道中呈现出较高的发病率ꎬ为3.7%~10.0%[9 ̄10]ꎬ其诱导间质性肺炎的发病机制尚不清楚ꎬ推测可能与细胞毒性T淋巴细胞的激活㊁细胞因子的释放和补体的活化有关[11]ꎬ此外ꎬ利妥昔单抗半衰期较长ꎬ其对B淋巴瘤细胞的持续杀伤作用对正常的体液免疫也有一定的抑制和损伤作用ꎬ可通过干扰淋巴细胞之间的串扰ꎬ使细胞毒性T淋巴细胞失衡ꎬ也可能导致间质性肺炎的发生[12]ꎮ根据相关文献报道ꎬ对于利妥昔单抗引起的间质性肺炎ꎬ建议给予大剂量糖皮质激素冲击治疗ꎬ但是对于其使用剂量及疗程尚无统一的标准ꎮ在本例中ꎬ先使用大剂量糖皮质激素冲击治疗3dꎬ后逐渐减量并维持治疗ꎬ同时预防性应用抗感染药物ꎬ患者预后良好ꎬ此外亦有大剂量糖皮质激素联合免疫抑制药治疗间质性肺炎的报道ꎮ综上所述ꎬ利妥昔单抗相关的间质性肺炎是一种由利妥昔单抗引起的罕见但有可能致命的肺毒性疾病ꎬ患者在发病初期通常表现为上呼吸道感染样症状ꎬ如咽痛㊁咳嗽㊁发热㊁寒战等ꎬ其临床症状的特异性差ꎬ诊治困难大ꎬ对此医生必须保持高度警惕ꎬ在使用利妥昔单抗前后及期间需密切监测患者肺功能的变化ꎬ对于使用利妥昔单抗后出现不明原因发热㊁胸闷气促㊁呼吸困难的患者ꎬ建议行常规胸部影像学检查ꎬ以便进行早期诊断ꎬ早期治疗以改善预后ꎮ此外ꎬ淋巴瘤患者长时间使用糖皮质激素ꎬ应警惕其不良反应的发生ꎮ参考文献[1]㊀WHO ̄UMC.TheuseoftheWHO ̄UMCsystemforstan ̄dardizedcasecausalityassessment[EB/OL].(2009-07-03)[2009-03-01].http://www.who ̄umc.org/graphics/4409.pdf.[2]㊀杨华ꎬ魏晶ꎬ王嘉仡ꎬ等.药品不良反应/事件报告评价方法研究[J].中国药物警戒ꎬ2009ꎬ6(10):581-584. [3]㊀TRAVISWDꎬCOSTABELUꎬHANSELLDMꎬetal.AnofficialAmericanThoracicSociety/EuropeanRespiratorySocietystatement:updateoftheinternationalmultidisciplinaryclassificationoftheidiopathicinterstitialpneumonias[J].AmJRespirCritCareMedꎬ2013ꎬ188(6):733-748.[4]㊀LISTEDN.Thediagnosisꎬassessmentandtreatmentofdiffuseparenchymallungdiseaseinadultsintroduction[J].Thoraxꎬ1999ꎬ54(Suppl1):S1-S14.[5]㊀温馨ꎬ杨勇ꎬ邓勋ꎬ等.他克莫司致间质性肺炎1例[J].中国新药与临床杂志ꎬ2018ꎬ37(11):662-664. [6]㊀ENOMOTOYꎬNAKAMURAYꎬENOMOTONꎬetal.Japaneseherbalmedicine ̄inducedpneumonitis:areviewof73patients[J].RespirInvestigꎬ2017ꎬ55(2):138-144. [7]㊀孙雪林ꎬ朱翊ꎬ封宇飞ꎬ等.靶向抗肿瘤药物致肺损伤分析[J].中国药学杂志ꎬ2018ꎬ53(16):1425-1430. [8]㊀赵美ꎬ王晓旋.免疫抑制患者间质性肺炎的药学监护[J].医药导报ꎬ2018ꎬ37(3):322-324.[9]㊀HADJINICOLAOUAVꎬNISARMKꎬPARFREYHꎬetal.Non ̄infectiouspulmonarytoxicityofrituximab:asystematicreview[J].Rheumatology(Oxford)ꎬ2012ꎬ51(4):653-662. [10]㊀LIUXꎬHONGXNꎬGUYJꎬetal.Interstitialpneumonitisduringrituximab ̄containingchemotherapyfornon ̄Hodgkinlymphoma[J].LeukLymphomaꎬ2008ꎬ49(9):1778-1783. [11]㊀NAQIBULLAHMꎬSHAKERSBꎬBACHKSꎬetal.Rituximab ̄inducedinterstitiallungdisease:fivecasesreports[J].EurClinRespirJꎬ2015ꎬ2.doi:10.3402/ecrj.v2.27178.[12]㊀HUANGYꎬLIUCꎬLIUCꎬetal.LowabsolutelymphocytecountandadditionofrituximabconferhighriskforinterstitialpneumoniainpatientswithdiffuselargeB ̄celllymphoma[J].AnnHematolꎬ2011ꎬ90(10):1145-1151.417 HeraldofMedicineVol 39No 5May2020。
利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含0.9%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
如再次发生相同的严重不良反应,应考虑停药。
利妥昔单抗说明书篇一:利妥昔单抗说明书利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含0.9%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
如再次发生相同的严重不良反应,应考虑停药。
利妥昔单抗绝不能未稀释就静脉滴注,制备好的注射液也不能用于静脉推注。
滤泡性非霍奇金淋巴瘤,成年患者利妥昔单抗单药治疗的推荐剂量为375mg/㎡体表面积,每周静脉滴注1次,在22天内使用4次。
弥漫大B细胞性非霍奇金淋巴瘤,利妥昔单抗应与CHOP化疗联合使用。
推荐剂量为375mg/㎡体表面积,每个化疗周期的第一天使用。
化疗的其它组分应在利妥昔单抗应用后使用。
初次滴注,推荐起始滴注速度为50mg/h;最初60分钟过后,可每30分钟增加50mg/h,直至最大速度400mg/h。
以后的滴注,利妥昔单抗滴注的开始速度可为100mg/h,每30分钟增加100mg/h,直至最大速度400mg/h。
治疗期间的剂量调整.不推荐利妥昔单抗减量使用。
利妥昔单抗与标准化疗合用时,标准化疗药剂量可以减少。
【不良反应】1、全身症状:腹痛、背痛、胸痛、颈痛、不适、腹胀、输液部位疼痛。
2、心血管系统:高血压、心动过缓、心动过速、体位性低血压、心律失常。
3、消化系统:腹泻、消化不良、厌食症。
4、血液和淋巴系统:淋巴结病。
5、代谢和营养疾病:高血糖、外周水肿、LDH增高、低血钙。
6、骨骼肌肉系统:关节痛、肌痛、疼痛、肌张力增高。
7、神经系统:头昏、焦虑、感觉异常、感觉过敏、易激惹、失眠、神经质。
8、呼吸系统:咳嗽增加、鼻窦炎、支气管炎、呼吸道疾病、阻塞性细支气管炎。
9、皮肤和附属物:盗汗、出汗、单纯疱疹、带状疱疹。
10、感觉器官:泪液分泌疾病、结膜炎、味觉障碍。
【禁忌】已知对本药的任何组份和鼠蛋白过敏的患者禁用利妥昔单抗。
【注意事项】1、循环中有大量恶性肿瘤细胞(>25,000/ml)或高肿瘤负荷(病灶>10cm)者,发生严重的细胞因子释放综合征或肿瘤溶解综合征的风险较高,使用利妥昔单抗应极其慎重,可给予其他治疗选择。
应该考虑降低肿瘤负荷的预备治疗。
这类患者在第1次滴注利妥昔单抗时应考虑减慢滴注速度。
肺功能不全或高肿瘤负荷者出现严重的细胞因子释放综合征或肿瘤溶解综合征的风险增加。
这些反应在临床上可能与超敏反应无法区别。
严重的细胞因子释放综合征以严重的呼吸困难(常伴支气管痉挛和低氧血症),发热(可能出现高热惊厥),寒战,荨麻疹和血管性水肿为特征。
还可伴随出现一些肿瘤溶解综合征的特征,例如高尿酸血症,高钾血症,低钙血症,LDH升高,急性肾功能衰竭以及危及生命的呼吸衰竭。
2、急性呼吸衰竭可伴有胸部X线可见的肺间质浸润和水肿。
出现严重细胞因子释放综合症的患者应立即停止滴注,并给予积极的对症治疗。
少数患者在临床症状开始好转后再次出现恶化,所以应严密监护这些患者,直至症状和体征完全消失。
在症状和体征完全消退后对患者继续进行治疗,很少导致严重的输液相关反应。
预先存在肺功能不全或肿瘤肺浸润的患者用利妥昔单抗治疗必须极其谨慎,尤其是万一出现上述严重症状和体征时。
静脉滴注蛋白可导致患者发生过敏样反应或其它超敏反应。
与细胞因子释放综合征不同,典型的超敏反应常于开始滴注的几分钟内发生。
过敏反应临床上可与细胞因子释放综合征表现相似。
在滴注利妥昔单抗的过程中发生过敏反应,应立即使用抗变态反应的药物,如肾上腺素,抗组胺药和皮质激素。
约50%接受利妥昔单抗治疗的患者会出现输液相关不良反应。
这些反应通常是轻微的,类似流感,但大约10%的患者较严重,出现低血压、呼吸困难和支气管痉挛。
这些症状是可逆的,通常在停止静滴利妥昔单抗,并给予退热药和抗组胺药后好转。
偶尔需要吸氧,静滴生理盐水,甚至可能给予支气管扩张药和皮质激素。
由于滴注利妥昔单抗期间可能出现一过性低血压,所以滴注利妥昔单抗前12小时以及滴注期间应该考虑停用抗高血压药。
3、有心脏病史的患者(例如心绞痛、房扑和心房纤颤等心律失常或心衰)在利妥昔单抗滴注过程中应严密监护。
虽然利妥昔单抗单药治疗不会导致骨髓抑制,但在中性粒细胞计数4、特别说明:对疫苗和基于抗原抗体反应的诊断性试验的可能反应尚未研究。
不相容性:未观察到利妥昔单抗与聚氯乙烯或聚乙烯袋或输液器之间的不相容性。
对驾驶和操作机器能力的影响:未知利妥昔单抗是否损害驾驶和操作机器的能力,尽管药理学特性和迄今为止报告的不良反应中没有显示上述的不良影响。
【进口药品】是【孕妇及哺乳期妇女用药】妊娠:利妥昔单抗尚未进行动物生殖毒性研究。
也不知妊娠妇女使用利妥昔单抗是否引起胎儿损害或利妥昔单抗是否影响生育能力。
但已知免疫球蛋白IgG可通过胎盘屏障,所以除非可能给患者带来的益处大于潜在的危险,利妥昔单抗不应用于妊娠妇女。
育龄妇女在使用利妥昔单抗的过程中及治疗后的12个月,应采取有效的避孕措施。
哺乳:尚不清楚利妥昔单抗是否分泌入乳汁。
已知母体的IgG可进入乳汁,那么利妥昔单抗就不能用于哺乳的母亲。
【儿童用药】利妥昔单抗应用于儿童的有效性和安全性尚未确定。
【老年用药】国外和国内临床研究中均纳入了老年患者,结果提示本品可用于老年患者,无特殊禁忌。
【药物相互作用】目前,尚无关于利妥昔单抗的可能药物相互作用的资料。
特别是利妥昔单抗与化疗(例如CHOP)合用的相互作用尚未研究。
人抗鼠抗体(HAMA)或人抗嵌合抗体(HACA)滴定阳性的患者(本文来自:小草范文网:利妥昔单抗说明书),在接受其他诊断性或治疗性单克隆抗体时可发生过敏反应。
同时或序贯使用利妥昔单抗和其他倾向于引起正常B细胞耗竭的药物的耐受性尚未得到足够的研究。
[查看]【药代动力学】对滤泡性非霍奇金淋巴瘤的患者,以125、250或375mg/㎡体表面积的利妥昔单抗治疗,每周静脉滴注一次,共4次,血清抗体浓度随着剂量的增加而增加。
对于接受375mg/㎡剂量的患者,第一次滴注后利妥昔单抗的平均血清半衰期是68.1小时,Cmax是238.7μg/ml,而平均血浆清除率是0.0459L/小时;第四次滴注后的血清半衰期、Cmax和血浆清除率的平均值分别为189.9小时、480.7μg/ml和0.0145L/小时,但血清水平的变异性较大。
其次,反应患者的利妥昔单抗血清浓度明显较高。
一般来说,3~6个月时利妥昔单抗仍能在血清中被检出。
在弥漫大B细胞性非霍奇金淋巴瘤患者中,利妥昔单抗与CHOP合用时的清除和分布尚未进行研究。
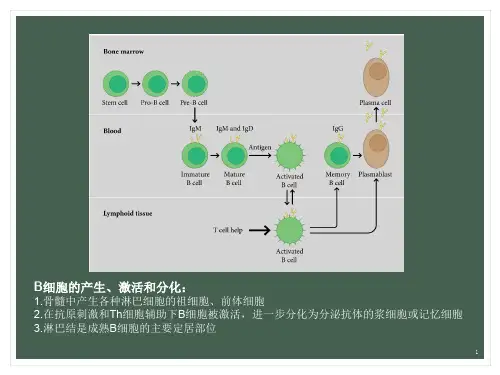
[隐藏]【药理毒理】利妥昔单抗是一种人鼠嵌合性单克隆抗体,能特异性地与跨膜抗原CD20结合。
CD20抗原位于前B和成熟B淋巴细胞的表面,而造血干细胞、前前B细胞、正常浆细胞或其它正常组织不表达CD20。
95%以上的B细胞性非霍奇金淋巴瘤瘤细胞表达CD20。
抗原抗体结合后,CD20不会发生内在化,或从细胞膜上脱落进入周围的环境。
CD20不以游离抗原的形式在血浆中循环,因此不可能与抗体竞争性结合。
利妥昔单抗与B细胞上的CD20抗原结合后,启动介导B细胞溶解的免疫反应。
B细胞溶解的可能机制包括:补体依赖的细胞毒作用(CDC),抗体依赖细胞的细胞毒作用(ADCC)。
第一次输注利妥昔单抗后,外周B淋巴细胞计数明显下降,低于正常水平,6个月后开始恢复,治疗完成后9~12个月之间恢复正常。
体外实验显示,利妥昔单抗可以使耐药的人B淋巴瘤细胞株对某些化疗药物细胞毒作用的敏感性增强。
[隐藏]【贮藏】瓶装制剂保存在2~8℃。
【包装】152支/箱【产地】瑞士篇二:利妥昔单抗注射液利妥昔单抗注射液药品名称药品名(中):利妥昔单抗注射液汉语拼音:Lituoxidankang Zhusheye商品名(中):英文名:Rituximab Injection英文商品名:Mabthera剂型:注射剂主要成份本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
性状为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
药理毒性利妥昔单抗是一种人鼠嵌合性单克隆抗体,能特异性地与跨膜抗原CD20结合。
CD20抗原位于前B和成熟B淋巴细胞的表面,而造血干细胞、前前B细胞、正常浆细胞或其它正常组织不表达CD20。
95%以上的B细胞性非霍奇金淋巴瘤瘤细胞表达CD20。
抗原抗体结合后,CD20不会发生内在化,或从细胞膜上脱落进入周围的环境。
CD20不以游离抗原的形式在血浆中循环,因此不可能与抗体竞争性结合。
利妥昔单抗与B细胞上的CD20抗原结合后,1 / 17启动介导B细胞溶解的免疫反应。
B细胞溶解的可能机制包括:补体依赖的细胞毒作用(CDC),抗体依赖细胞的细胞毒作用(ADCC)。
第一次输注利妥昔单抗后,外周B淋巴细胞计数明显下降,低于正常水平,6个月后开始恢复,治疗完成后9~12个月之间恢复正常。
体外实验显示,利妥昔单抗可以使耐药的人B淋巴瘤细胞株对某些化疗药物细胞毒作用的敏感性增强。
临床研究国外临床研究复发或难治的滤泡性非霍奇金淋巴瘤临床试验中,复发或难治的滤泡性非霍奇金淋巴瘤患者,这些患者既往均接受高强度的化疗。