(完整版)临床常见微生物标本的采集与运送
- 格式:doc
- 大小:46.51 KB
- 文档页数:7



临床微生物标本的采集与运送在医学临床的诊断过程中,微生物检验是不可缺少的一环。
临床微生物标本的采集与运送是保证准确诊断的关键步骤之一。
本文将介绍临床微生物标本的采集与运送的一些注意事项。
1. 标本类型临床微生物标本通常包括血液、尿液、粪便、血培养瓶、脑脊液、切口分泌物等。
2. 采集方法2.1 血液标本采集血液标本时,一定要做好消毒工作。
选择采血部位后,用酒精或碘酒消毒,再用无菌针头采血,避免受污染。
血液标本采集后可以分成两份,一份用于血常规,另一份用于血培养。
2.2 尿液标本收集尿液标本时,要让患者用清洁肥皂清洁外阴部,再用无菌尿杯收集尿液,避免手部直接触摸尿杯和尿液。
尽量将尿液标本送至检验室的时间控制在2小时之内。
2.3 粪便标本采集粪便标本时,要确定所采集的粪便样本来自于患者的肛门临近处。
最好不要使用纸巾,而是用无菌容器收集粪便。
粪便标本采集窗口为3天。
2.4 血培养瓶标本采集血培养瓶标本时,首先要选择采血部位进行消毒,然后将血培养瓶插入采血针器上,打开外部装置,使血液顺利流入血培养瓶中。
采集集中在早晨时段,每次采集2-3个血培养瓶。
2.5 脑脊液标本采集脑脊液标本需要医生进行,患者应严格卧床休息,医生在患者腰部,采用穿刺的方式进行脑脊液的采集。
2.6 切口分泌物标本采集切口分泌物标本时,需要选择无菌医用棉签,消毒采集部位。
在采集过程中,应尽量避免被采集部位感染污染到。
3. 运送方法临床微生物标本的运送是重要的环节。
标本在采集后应及时送至细菌学检验实验室。
并且在运送过程中需要遵循以下几点:3.1 收集后尽早送检临床微生物标本的采集窗口不长,应尽早将标本送至检验室进行分析。
3.2 标本容器和包装标本容器必须选择无菌容器,容器体积大小要相应合适。
送检前,要核对标本标签与标签上的医学记录是否一致。
标本包装时,应采取干燥、保温、防震、防漏、防碎的原则。
3.3 运输温度不同种类的标本,其运输温度介于4-25摄氏度之间。

临床微生物标本采集和运送基本原则一、临床微生物标本采集基本原则1.标本来源与采集部位临床微生物标本主要来源于患者体内的各类体液、组织和生物材料。
采集部位包括呼吸道、消化道、泌尿生殖道、皮肤、创伤、手术部位等。
采集时应选择感染灶、病变部位或易感部位,以确保标本的代表性和可靠性。
2.采集工具与消毒采集微生物标本时,应使用无菌、一次性采集器具。
采集器具在使用前应进行消毒处理,以确保不会引入外来微生物污染。
消毒方法可选用高温、高压、化学消毒剂等。
3.采集操作步骤(1)准备工作:评估患者病情,向患者及家属解释采集目的和注意事项,取得患者知情同意。
(2)佩戴个人防护装备:口罩、手套、护目镜或面罩。
(3)消毒:使用消毒剂对采集部位进行皮肤消毒。
(4)采集:根据不同标本类型,进行相应操作,如穿刺、刮片、抽取等。
(5)封装:将采集完成的标本放入无菌容器中,密封,注明患者信息、采集部位、日期等。
二、临床微生物标本运送基本原则1.标本容器与标记运送微生物标本时,应选用防漏、耐压、易保存的容器。
容器表面应清晰标记患者信息、采集部位、标本类型等,以便于实验室接收和处理。
2.运送条件与时间要求微生物标本应在采集后尽快送达实验室,一般要求在2-4小时内完成。
运送过程中,应保持标本容器密封,避免剧烈晃动,确保标本质量。
3.运送过程中的注意事项(1)夏季高温时,可采取冰袋降温措施,防止标本变质。
(2)注意标本容器不离手,避免摔碎或泄露。
(3)如需长途运输,应采取适当包装,确保标本在运输过程中不受损。
三、标本质量控制与标准化1.微生物实验室的质量管理体系实验室应建立完善的质量管理体系,包括人员培训、设备维护、检测方法、室内质量控制等,以确保检验结果的准确性和可靠性。
2.标本接收与处理实验室接收标本时,应核对标本信息,检查标本容器、运送条件等。
对标本进行登记、分类、编号,并按照标准化流程进行处理。
3.室内质量控制与外部质量评估实验室应定期进行室内质量控制,包括质控品的检测、方法比对、仪器校准等。

临床微生物标本的采集,储存和转运微生物检验的基本原则1.及时采集微生物标本作病原学检查2.在抗菌药物使用前采集标本3.采样时严格执行无菌操作4.采样后立即送检5.标本容器须灭菌处理,但不得使用消毒剂6.送检标本应注明来源和检验目的标本采集1.尽早采集2.无菌操作3.合适部位4.适量标本5.适当方法6.安全采集1-尽早采集标本“采集重在时效性”1.1最好是病程早期、急性期1.2尽量在抗生素使用之前采集1.3对已用抗生素又不能停药者,可在下次用药前采集2-合适部位“背景干扰”2.1无菌标本:注意局部及周围皮肤的消毒,严格进行无菌操作与外界相通的腔道:避开腔道口区标本,以免皮肤表面正常菌群的污染,造成混淆和误诊。
2.2正常菌群寄生部位:采集时应特别小心;应明确检查的目的菌在进行分离培养时,采用特殊选择性培养基2.3血标本采集:应避免输液的影响。
3-无菌操作采集标本时应尽量减少或避免感染部位附近皮肤或粘膜常居菌群污染和防止外源性细菌污染标本。
3.1.在采集血液、脑脊液、胸腔积液、关节液等无菌标本时,应注意对局部及周围皮肤的消毒,严格进行无菌操作;3.2.对于采集与外界相通的腔道标本时,如窦道标本,应从窦道底部取活组织检查,而非从窦道口取标本,以免受皮肤表面正常菌群的污染,造成混淆和误诊;3.3.采集的标本均应盛于无菌容器内送检。
盛装标本的容器须先经高压灭菌、煮沸、干热等物理方法灭菌,或使用一次性无菌容器,不能用消毒剂或酸类处理。
标本中也不得添加防腐剂,一面降低病原菌的分离率。
4-适量标本4.1标本采集应足量。
标本量过少,可能会导致假阴性结果。
4.1.1血液标本:通常成人采血量每瓶8-10ml,儿童每瓶1-5ml;脑脊液、骨髓、4.1.2脓肿、穿刺液、引流液、痰液等标本:三1ml尿液标本:>3ml4.1.3粪标本:1-3g 或 1-3ml4.2结核标本采集量要求特殊:4.2.1痰、肺泡灌洗液或支气管冲洗液:>5ml;4.2.2清晨中段尿:5-10ml;4.2.3粪标本:>1g;4.2.4穿刺液(胸水、腹水、关节液等):5- 10ml。

临床微生物标本采集和运送基本原则有:
第一,要及时采集微生物标本,做病原学检查。
第二,严格执行无菌操作,减少和避免污染。
第三,标本采集之后,要立即送到实验室,床旁接种可以提高病原菌的检出率。
第四,尽量的在使用抗菌药物之前采集标本,这样对于结果的影响比较小一些。
第五,以棉拭子采集的标本如咽拭子、肛拭子或伤口拭子要立刻送检。
第六,盛标本容器须经灭菌处理,不要使用消毒剂。
第七,送检标本应注明来源和检验目的,使实验室能正确选用相应的培养基和适宜的培养环境,必要时应注明选用何种抗菌药物。
第八,对于混有正常菌群的污染标本,要做定量或半定量培养,然后判断是感染菌和定植菌。
第九,对分离到的病菌,要做药敏实验,提倡分级报告和现实报告。


临床微生物标本的采集方法与运送图文在医学诊断中,微生物检测被广泛应用于诊断及治疗方案制定。
正确采集和运送微生物标本是确保检测结果准确的关键步骤之一。
本文将详细介绍临床微生物标本的采集方法及运送注意事项。
采集方法血液标本血液标本采集是常用的微生物检测方法之一。
常规采集方法包括静脉血采集、指尖穿刺采集和动脉血采集等。
1.静脉血采集静脉血采集通常用于需要采集大量样本的情况下,如血培养、真菌检测、病毒检测等。
采集前应先消毒采血部位,选定静脉进行穿刺,然后注入抗凝剂。
2.指尖穿刺采集指尖穿刺采集用于小儿或需要采集微量血液时。
采集前应消毒手指或手掌,然后用专用的采血器进行采集。
3.动脉血采集动脉血采集比较少用于微生物检测,但对于严重感染、危重患者或需要测定动脉血分析得出合理治疗方案的情况下,动脉血采集是必要的。
采集前应选择合适的部位和方法,如可以选择桡动脉或股动脉,用专用的采血器进行采集。
呼吸道标本呼吸道标本采集常用于肺炎、支气管炎等疾病的微生物检测。
常规采集方法包括咳痰、纤维支气管镜、气管切开等。
1.咳痰采集咳痰采集过程中患者需要深呼吸几次,准备好试管,让患者咳出一口痰,不能含有口沫、唾液或食物颗粒等,尽可能采集量充足,同时尽量避免污染。
2.纤维支气管镜纤维支气管镜是通过口腔或鼻腔插入支气管,然后利用摄像技术和采样器具进行采集的方法。
此方法是针对深部病菌感染的有效手段。
3.气管切开气管切开是一种采集深部呼吸道标本的方法,因为它可以避免口咽部的影响。
采集前应选择合适的气管穿刺部位、清洁穿刺部位、取下上管再采集等步骤。
尿液标本尿液标本的采集主要是为了检测尿路感染等微生物,采集前需要保持尿液清洁,防止细菌污染。
1.中段尿采集中段尿采集是指采集尿液的中部部分,采集前应积极清洗外阴,然后让患者将外阴分开并向前弯腰(女性可用专用的尿盆)。
取适量中段尿,例如5ml,尽量避免皮肤分泌物或洗浴用品污染。
2.空腹尿采集空腹尿采集是指清晨患者从自然排空开始(胆红素改变尿色)到第二个排尿前采集尿样,此时虽然尿液浓度高,但细菌数量少,采集丰富,适用于对尿细菌进行检测。
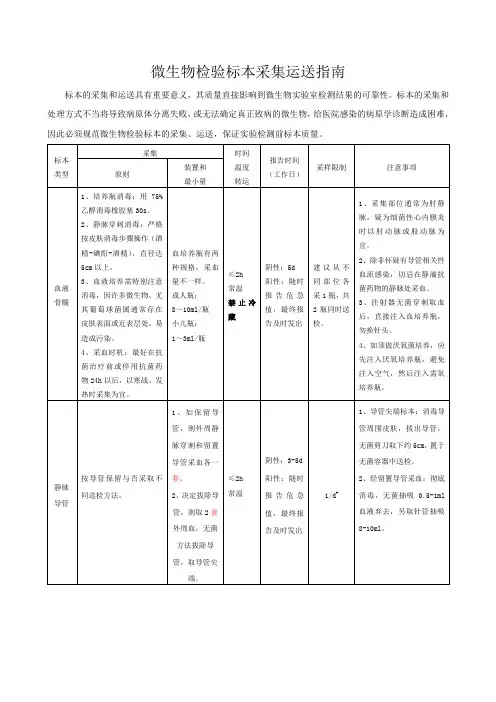

(完整版)临床常见微生物标本的采集与运送临床常见微生物标本的采集与运送唐玉英正确的标本采集,运送,保存和处理对于微生物检验工作质量至关重要,为了准确检出病原菌,避免漏检与误诊,临床医护人员和实验室工作人员应掌握微生物标本的选择,采集,运送,保存及处理的一般原则。
一标本采集的一般原则1.早期采集采集时间最好在病程早期,急性期,且必须在使用抗菌药物之前采集,确保病原菌的检出。
2.无菌操作采集标本时应尽量减少或避免感染部位附近或皮肤黏膜正常菌群的污染,使病原菌与正常菌群混淆,造成临床误诊。
采集的标本应存放在无菌容器内,容器不能使用消毒剂处理,标本中也不能添加防腐剂,以免降低病原菌的检出。
3.适量的标本标本量过少可能导致假阴性结果。
4.适当的采集方法对于厌氧菌,需氧菌或兼性厌氧菌的采集方法是不同的,用于厌氧菌培养的标本应尽量用注射器采集抽取物,室温保存,不能冷藏和冷冻。
5.盛放标本的容器采集标本应存放在无菌,防漏,应带有螺旋盖的容器内。
二标本的运送1.标本采集后立即送检,若有延迟也应在2小时内送到实验室,否则会影响病原菌的检出,一般性的细菌培养标本若需延迟送检时,应置于4度冰箱保存,且不能超过24小时。
2.临床标本最佳运送时间取决于标本的量,少量液体(小于1ml)或组织(小于1cm3)应在15~30分钟内送到实验室,较多量的标本置于运送培养基中可放12~24小时,厌氧培养标本原则上是床边接种,如延迟送检,需保存在厌氧运送培养基中,室温保存,不得超过24小时。
三不同标本的采集,运送(一)血液标本采集,运送1.血培养指针当患者出现:发热(大于38度)或低温(小于36度),寒战,白细胞增多,皮肤黏膜出血,休克,多器官衰竭,血压降低,c反应蛋白升高及呼吸加快,血液病患者出现粒细胞减少,血小板减少等,具备上述一种或几种体征时,临床怀疑菌血症应采集血液标本进行血培养,对入院危重感染患者应在未使用抗菌药物治疗前,及时做血培养。

【VIP专享】临床微生物标本的采集与送检临床微生物标本的采集与送检主要内容:标本采集、运送意义与原则血液标本采集尿标本采集粪便标本采集痰标本采集咽拭子标本采集标本拒收的标准与处理方法一、(一)标本采集、运送规范化的意义正确的标本采集、运送、保存和处理对于提高培养结果的阳性率以及保证细菌室的工作质量至关重要正确的标本采集和运送是准确的病原学诊断的前提不规范的标本采集、保存和运送是导致细菌培养阳性率低、临床符合率差的重要原因。
规范的标本采集和运送是细菌培养成功的关键!(二)、微生物检查的标本采集、运送原则1.及时采集微生物标本作病原学检查。
2.尽量在抗菌药物使用前或停药一周后采集标本,如不能停用抗菌药物,应于下次抗菌药物应用前采集。
应在感染的急性期或伤口局部治疗前采集标本。
3.选择正确的部位,并以适当的技术、方法与容器收集足量的标本。
4.采样时严格执行无菌操作,将污染情形降至最低。
5.收集真正感染病灶处的标本,且避免邻近区域微生物的污染。
6.采用无菌器材收集标本,并装于坚固且密合性佳的无菌容器中。
容器须灭菌处理,防止渗漏,但不得使用消毒剂。
标本中不可添加防腐剂。
7.采样后立即送检,最好在2h内。
如不能及时送检,应将标本置于适当的储存环境待送,但存放一般不能超过24h。
8.尽量不要以棉花拭子收集标本。
以棉拭子采集的标本如咽拭子、伤口拭子等宜插入恰当的运送培养基送检。
淋球菌培养等标本应使用专用的纤维拭子,不得使用一般棉拭子。
9.混有正常菌群的标本如痰、尿液等,不可置肉汤培养基内送检。
10.每份标本都应贴上标签并标明必要信息,在检验申请单上填写足够的有关临床资料。
包括病人情况(病区、病人姓名、住院号)和标本情况(标本类型、检验目的、采集部位、采集方法、采集时间等)11.同一天同一检测目的的标本(血液标本除外)一般只需检测一次(份)。
涂片检查最好和细菌培养同时做!(三)、如何提高细菌阳性检出率?1、标本采集时机;2、标本采集方法;3、标本的质与量;4、标本的运送与保存;5、筛选合格标本(退检制度);6、高质量、多种分离培养基;7、培养环境;8、合理的收费制度(四)、临床常见标本血液(生化、免疫及微生物检验)尿液粪便痰及上呼吸道标本穿刺液标本(脑脊液、胆汁、胸腹水等)脓液及创伤感染分泌物标本生殖道标本组织标本(五)、血标本检验的意义血液是临床最常见的检验项目它可以反映血液系统本身的病变还可判断病人病情进展程度为治疗疾病提供参考。
临床微生物标本的正确采集与运送图文微生物学在临床上发挥着重要作用,正确的采样和运送过程对于准确诊断和治疗具有决定性影响。
本文将介绍临床微生物标本采集和运送的基本原则。
一、标本采集前的准备工作1.1 了解患者的情况在进行采样之前,了解患者病史、症状、用药情况等可以帮助选择合适的采样部位和方法。
例如,对于胸腔感染,应在患侧插入穿刺针进行胸腔穿刺;对于泌尿系感染,应在初尿流进行尿液采集。
1.2 选择合适的采样部位和方法选择合适的采样部位和方法可以提高标本的阳性率。
下面介绍一些常见的采样部位和方法:血液标本血液标本是诊断血液感染和细菌性心内膜炎的关键。
采血前需要消毒采血部位,并选择合适的采血管和采血顺序。
常见的采血部位有手腕、肘窝、背侧手腕、踝部,而采血顺序为无菌采血管先于常规采血管。
尿液标本尿液标本是诊断泌尿系感染的重要手段。
采样前需要让患者清洁外阴,并选择合适的采样时机。
中段尿和早晨起床第一次排尿的尿液最为理想。
呼吸道标本呼吸道标本可用于诊断呼吸道感染、肺炎等疾病。
采样前需要清洁口腔和鼻腔,并采用合适的方法进行采样。
常见的方法有喉拭子和气管切开。
胃肠标本胃肠标本可用于诊断肠道感染、胃溃疡等疾病。
采样前需要清洁口腔和肛门,并选择合适的采样方法。
常见的方法有粪便标本、肠内容物吸取和胃液抽取。
1.3 配置必要的采样器材采集标本需要用到一些专门的器材,例如无菌采血针、采尿器、拭子、鱼雷管等。
采集前需要进行消毒和验证,并确保器材无损坏和过期。
二、标本采集时的注意事项2.1 彻底消毒采样部位对于需要皮肤穿刺的采样部位,必须进行彻底的消毒,以避免细菌污染。
消毒前应先清洁采样部位,并使用适宜的消毒剂进行消毒。
2.2 采样过程中遵循无菌原则采样过程中必须遵循无菌原则,以防止其他有害细菌或病毒的污染。
进行采样操作前,应先进行手卫生并配备隔离装备。
2.3 避免污染和误差在采集标本的过程中,必须避免污染和误差。
应严格按照标本类型、采样方法和储存条件进行操作,防止错误或污染发生。
临床常见微生物标本的采集与运送唐玉英正确的标本采集,运送,保存和处理对于微生物检验工作质量至关重要,为了准确检出病原菌,避免漏检与误诊,临床医护人员和实验室工作人员应掌握微生物标本的选择,采集,运送,保存及处理的一般原则。
一标本采集的一般原则1.早期采集采集时间最好在病程早期,急性期,且必须在使用抗菌药物之前采集,确保病原菌的检出。
2.无菌操作采集标本时应尽量减少或避免感染部位附近或皮肤黏膜正常菌群的污染,使病原菌与正常菌群混淆,造成临床误诊。
采集的标本应存放在无菌容器内,容器不能使用消毒剂处理,标本中也不能添加防腐剂,以免降低病原菌的检出。
3.适量的标本标本量过少可能导致假阴性结果。
4.适当的采集方法对于厌氧菌,需氧菌或兼性厌氧菌的采集方法是不同的,用于厌氧菌培养的标本应尽量用注射器采集抽取物,室温保存,不能冷藏和冷冻。
5.盛放标本的容器采集标本应存放在无菌,防漏,应带有螺旋盖的容器内。
二标本的运送1.标本采集后立即送检,若有延迟也应在2小时内送到实验室,否则会影响病原菌的检出,一般性的细菌培养标本若需延迟送检时,应置于4度冰箱保存,且不能超过24小时。
2.临床标本最佳运送时间取决于标本的量,少量液体(小于1ml)或组织(小于1cm3)应在15~30分钟内送到实验室,较多量的标本置于运送培养基中可放12~24小时,厌氧培养标本原则上是床边接种,如延迟送检,需保存在厌氧运送培养基中,室温保存,不得超过24小时。
三不同标本的采集,运送(一)血液标本采集,运送1.血培养指针当患者出现:发热(大于38度)或低温(小于36度),寒战,白细胞增多,皮肤黏膜出血,休克,多器官衰竭,血压降低,c反应蛋白升高及呼吸加快,血液病患者出现粒细胞减少,血小板减少等,具备上述一种或几种体征时,临床怀疑菌血症应采集血液标本进行血培养,对入院危重感染患者应在未使用抗菌药物治疗前,及时做血培养。
2.对怀疑菌血症、真菌血症的患者,在考虑使用抗菌药物之前,应立即采集血培养标本。
必须同时或间隔短时间内采集2套以上血培养标本。
成年患者:推荐同时采集2-3套(不同部位)血培养标本(即双瓶双臂同时采集血培养标本),采血量每瓶不少于5ml;婴幼儿患者:推荐同时采集2次(不同部位)血培养标本,采血量每瓶不少于2ml。
(少于病人总血容量的1%).在采取血培养后的2—5天内,无需重复采取血培养。
两个例外:细菌性心内膜炎和金黄色葡萄球菌菌血症。
3. 血标本采集的量是影响检出率的最重要的因素。
检出率与采血量成比例增长,每增加1ml的血液,病原菌的检出率就会相应增加。
儿童患者血液中病原菌浓度较高,血培养量无需等同于成人。
采用一对(需氧瓶+厌氧瓶)组合,比采用二个需氧瓶的组合可检出更多的葡萄球菌、肠杆菌科细菌和厌氧菌。
采血量不能满足推荐的量时,应首先满足需氧瓶的需要。
推荐从外周静脉采集血液标本,不推荐静脉留置导管,因其常伴有高污染率。
如果必须从留置导管内采血,也应同时从外周静脉采集另外一个血培养标本以帮助阳性结果的判读。
4.血标本采集的注意事项:在采血之前,血培养瓶的橡皮塞需使用75%酒精消毒并干燥。
然后再进行穿刺部位的皮肤消毒。
严格按照“酒精、含碘消毒剂、酒精”的消毒步骤操作,并等待足够的消毒时间。
严格无菌操作,不允许在皮肤消毒后用手接触静脉,除非带有无菌手套.不推荐采血和接种血培养瓶更换注射器针头;采集后的血培养瓶应在1小时之内送往实验室,血培养瓶在接种前和接种后均不得冷藏或冷冻。
(二)痰培养标本采集,运送1. 痰培养指针:上呼吸道感染包括咽炎,喉炎,会咽炎等都可采集鼻,鼻咽,口咽拭子标本培养。
下呼吸道感染:凡是咳嗽,咳痰,痰呈脓性,粘稠或血性等都可采集痰标本。
2.标本的采集:采集前嘱咐病人先用清水漱口,摘去牙托,因唾液中口咽部定植菌的浓度可达108-109/ml,去除表面的菌群。
教育病人深咳,收集从下呼吸道咳出的痰液。
在抗生素应用前采集痰标本;标本采集后1~2h内送往实验室进行处理,采集标本过程中要有专业的医务人员指导;无痰可用3%~5%NaCl 5ml雾吸约5min导痰;也可用物理疗法、体位引流、鼻导管抽吸等方法取痰。
3.正常的痰标本:低倍视野下鳞状上皮细胞小于25个,白细胞大于10个。
如果低倍视野下鳞状上皮细胞大于25个,白细胞小于10个应不做或仅在特殊要求时做培养,如做培养,报告中注明“镜检结果表明标本口咽分泌物污染明显”。
4痰培养方法的局限性:多数引起肺炎的病原菌不能培养出,如病毒,军团菌,衣原体等。
影响因素很多:如黏液包裹、定植菌污染。
建议痰培养同时做血培养和痰涂片镜检。
5.注意事项:常规的痰培养需在2小时内送检,若怀疑嗜血杆菌,肺炎链球菌感染时必需随留随送;标本中不能混入唾液与鼻咽分泌物等。
(三)尿培养标本采集,运送1. 尿培养指征:尿路感染,肾结核,泌尿系结石,膀胱排空功能受损或前列腺增生等患者,出现尿频,尿急,尿痛等膀胱刺激症状,肉眼脓尿或血尿,尿常规检查有白细胞或亚硝酸盐阳性,,不明原因的发热,尿道口有脓性分泌物等症状,需采集尿培养标本送检。
2.标本的采集:清洁中段尿液,嘱咐患者用肥皂水清洗,弃去开始流出的尿液,以冲刷尿道口的细菌,取能代表膀胱部位病原菌的中段尿;导尿管尿液,留置导管尿液标本常通过专门的采样端口采集,不能把导尿管与尿袋拔开后收集尿液,采样端口用酒精消毒;必要时,可先夹住导尿管但不能超过30分钟;将注射器针头插入采样端口,抽吸出尿液;注入无菌杯或试管中。
膀胱穿刺尿,无菌操作,用无菌注射器刺入膀胱抽取5—10ml尿液送检,主要用于厌氧菌的培养或留取标本困难的婴幼儿标本的采集,此法可避免尿液标本的污染。
3.标本的采集量:一般成人采集10-15ml,婴幼儿不得少于1ml.诊断症状明显的病人(如尿急、尿频、尿痛),一份标本就已足够,治疗48-72小时后再采集第二份标本。
对于症状不明显的病人,需采集2-3份标本。
怀疑肾结核时,应连续3天采集晨尿。
4.室温都有利于病原菌和污染菌生长繁殖,标本采集后立即送检和接种,室温下存放不能超过2小时,(夏季保存时间应适当缩短或冷藏),4-8度冷藏保存时间也不能超过24小时,冷藏的尿液不能用于淋球菌的培养。
5.注意事项:必须无菌操作,采用带盖防渗漏的无菌杯收集,多次收集或24小时尿不能用作培养。
集尿袋内的尿液不能用作培养。
导尿管末端的尿液也不能用于培养,很难避免没有尿道菌群污染。
在使用抗菌药物前留取标本,尿液中不能加任何防腐剂或消毒剂,抑制细菌的生长。
(四)粪便标本采集,运送1.送检指征:当患者出现腹泻,大便每天大于或等于3次,粪便的性状异常,可为稀便,水样便,粘液便,脓血便或血便,伴有恶心,呕吐,食欲不振,发热,腹痛及全身不适等,大便镜检白细胞大于等于5个每高倍视野,抗菌药物治疗后的腹泻等。
2.标本的采集方法,时间与量:尽可能在发病早期(急性期)或应用抗菌药物治疗之前,采集新鲜的粪便,怀疑沙门菌感染时,应在发病2周以后采集。
自然排便法,排便后,挑取有脓血或粘液部位的大便,液状粪便取絮状物盛于无菌的容器内;直肠拭子采集法,用于排便困难的患者或婴幼儿。
一般用拭子采集大于2g的标本送检,若标本为水样,采集大于2ml的标本于无菌容器中送检。
3.标本的运送与保存:标本采集后应尽快送检,室温条件下不能超过2小时,如不能及时送检可加入ph7.0磷酸盐甘油缓冲保存液中或专门的大便运送培养基中置4度冰箱保存,但不能超过24小时。
高度怀疑霍乱弧菌感染的标本必须符合特殊标本的安全要求。
4.注意事项:最好在用药前,采集新鲜的标本盛装在无菌容器内,立即送检,提高阳性检测结果。
厌氧菌的培养尽量避免与空气接触和正常的菌群污染。
(五)脓液及创伤感染分泌物标本的采集及运送1.送检指征:凡是当患者有外伤感染,术后切口感染,导管感染,脐带残端感染,有脓液和分泌物时,应采集标本培养。
2.标本的采集时间和方法:在使用抗生素前或停用药1—2天以后,或使用下一次抗生素前采集,对脓肿性分泌物应先用生理盐水或75%的酒精冲洗溃疡表面渗出物,尽可能抽取脓液于无菌杯内送检。
对于封闭性脓肿时,应无菌操作抽取脓液3—10ml于无菌试管内或血培养瓶内送检,怀疑厌氧菌感染时,应做床旁接种或注入厌氧瓶内(3—10ml)送检,最佳方法是采集组织送检。
3.标本的运送:标本采集后应于2小时内送微生物实验室进行处理,若不能及时送检,需氧培养的标本除对环境敏感的淋病奈瑟菌,脑膜炎奈瑟菌和流感嗜血杆菌外,可保存在4度冰箱中,但保存时间不能超过24小时;厌氧培养时,需用厌氧瓶或厌氧袋在室温下保存,但不能超过24小时。
4.注意事项:尽可能在用抗生素前采集,若患者也用药,应在检验单上注明抗菌药名,并在下次用药前采集;对于开放性的伤口,采集前应先除去表面污染菌,以防带入与感染无关的皮肤定值菌。
干燥结痂的标本一般不做培养,除非有渗出物。
采集标本时应无菌操作。
(六)穿刺液标本的采集与运送穿刺液主要包括脑脊液,胸腹水,心包液,胆汁,关节液及鞘膜液,在正常标本中,上述液体是无菌的,在排除污染的情况下,一旦检出细菌均视为病原菌。
在相关的部位有相应的临床症状时,应无菌操作采集相应的标本于无菌容器内送检,标本采集后应立即送往实验室处理。
脑脊液采集后应在15分钟内送到实验室,若不能,应室温保存,不得超过2小时,不能冷冻或冷藏。
注意事项:标本的采集严格执行无菌操作,最好在用抗菌药物前采集。
防止标本凝固,可事先在容器内加入抗凝剂,(脑脊液标本时不需加抗凝剂),也可直接加入血培养瓶内。