数字pcr与同类产品的比较
- 格式:pptx
- 大小:4.26 MB
- 文档页数:10

数字PCR的原理特点及应用1. 数字PCR的概述数字聚合酶链式反应(Digital PCR,简称dPCR)是一种用于基因表达、突变检测和拷贝数变异等研究的分子生物学技术。
与传统PCR相比,数字PCR可以提供更准确的定量信息,并获得更高的分辨率。
它通过将一份DNA样本分割成许多微小区域,每个区域中只有一个或少数个模板分子,从而实现对DNA的每个分子的分析。
2. 数字PCR的原理数字PCR可以分为两个主要步骤:分割和扩增。
2.1 分割DNA样本通过数字PCR设备的微流控芯片被分割成许多微小的区域,每个区域中只有一个或少数个DNA模板分子。
通过将DNA稀释的程度调整到一个合适的范围,可以确保分割后的每个区域中只有很少的模板分子。
2.2 扩增在分割后的DNA区域中,进行PCR扩增反应。
与传统PCR不同,数字PCR中反应体系中无需添加外部标准曲线或内部参考,因为每个区域中只有一个或少数个模板分子。
扩增过程中,每个区域中模板分子的数量会呈指数增长,超过一定数量时,即可确定该区域中含有模板分子。
3. 数字PCR的特点3.1 高度精确与传统PCR相比,数字PCR可以提供更准确的定量信息。
由于每个区域中只有一个或少数个模板分子,数字PCR消除了曲线分析和标准样品之间的变异,从而提高了测量的准确性。
3.2 高分辨率数字PCR可以提供更高的分辨率,能够检测到低频突变和拷贝数变异。
传统PCR通常只能提供相对定性的结果,而数字PCR可以直接计算出具体的目标序列数量,从而提供更详细的信息。
3.3 不受PCR效率影响传统PCR的结果受反应效率的影响,反应效率的变化可能导致结果的偏差。
而数字PCR中每个区域中只有一个或少数个模板分子,所以反应效率的变化对结果的影响较小。
3.4 可靠性数字PCR由于采用了分割的方式,可以降低PCR扩增过程中杂交和扩增偏好的影响。
因此,数字PCR的结果更可靠,减少了扩增偏好的潜在错误。
4. 数字PCR的应用4.1 基因表达研究数字PCR可以用于定量检测基因的表达水平。

PCR仪的种类1. 实时定量PCR仪实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,简称实时定量PCR)是一种用于快速、敏感且准确测定DNA、RNA拷贝数目的方法。
实时定量PCR仪是进行实时定量PCR实验的关键设备之一。
实时定量PCR仪的主要特点是能够对PCR反应过程中产生的荧光信号进行即时检测和分析,从而实现实时监测PCR反应的进程,并测定样品中目标序列的拷贝数。
实时定量PCR仪的应用非常广泛,包括基因表达检测、病原体检测、单核苷酸多态性分析等。
其高灵敏度、高特异性以及广泛的应用领域使其成为现代分子生物学和遗传学研究的重要工具。
2. 普通PCR仪普通PCR仪是进行普通聚合酶链反应(Polymerase Chain Reaction,简称PCR)实验的基本设备。
普通PCR仪可以进行常规PCR实验,即通过PCR反应在体外扩增目标DNA片段。
普通PCR仪的特点是温控系统可以实现快速、精确的温度调节,从而使PCR反应在不同温度下的环境条件得以满足。
普通PCR仪的操作简单、成本较低,适用于常规PCR 实验的需求。
普通PCR仪的应用广泛,包括基因克隆、DNA测序、基因检测等。
它已成为分子生物学、医学和生物技术等领域中的一种基础设备。
3. 数字PCR仪数字PCR仪是一种相对较新的PCR仪器,它采用数字分析的方法对PCR产物进行定量,具有极高的准确性和可靠性。
数字PCR仪的工作原理是将PCR反应体系分成数百、甚至上千个微小反应体,从而形成多个独立的PCR反应。
每个微小反应体内含有目标序列与参考序列,通过数百或数千个微小反应的计数结果进行定量分析。
这种方法可以极大地降低PCR反应中的误差,提高PCR反应的准确性。
数字PCR仪的应用主要集中在绝对定量PCR、稀释样品的精确定量、病原体检测等领域。
其高准确性和可靠性使其在遗传学研究和临床诊断中得到广泛应用。

PCR和数字PCR的区别1. PCR的概述PCR(聚合酶链式反应)是一种在生物学领域广泛应用的技术,可以在体外扩增DNA片段。
它由美国科学家凯里·穆利斯发明,在20世纪80年代初期首次被引入。
PCR技术主要利用了DNA的特性,通过逐渐加热和降温来使DNA的两条链解开和连接,以实现DNA的复制。
PCR技术已经在分子生物学、基因工程、犯罪侦查等领域取得了巨大的成功和推动。
2. 数字PCR的概述数字PCR(Digital PCR)是PCR技术的一种变体,它利用微小的反应体积将一份DNA样本分成许多小反应,并在各个小反应中分别检测目标序列的存在与否。
数字PCR通过将PCR反应体积分隔成许多小份,可以更精确地检测目标序列的存在与数量。
通过对每个小份PCR反应进行离散计数,可以计算出原始样本中目标序列的精确浓度。
3. PCR和数字PCR的主要区别3.1 反应原理PCR是一种在体外通过温度变化来扩增DNA片段的技术。
它使用DNA模板、引物、酶和适当的反应缓冲液来进行。
PCR通过逐渐加热和降温,在适当的温度范围内,使DNA的两条链解开和连接,从而实现DNA的复制。
数字PCR与PCR的基本原理相同,都使用DNA模板、引物、酶和反应缓冲液。
但数字PCR在PCR反应体积中分割成许多小反应,并对每个小反应进行离散计数,从而获得更精确的目标序列浓度。
3.2 精确性和灵敏度PCR技术本身在检测目标序列方面就具有很高的灵敏度。
但由于PCR反应体积的限制,PCR的结果受到反应物浓度的影响,并且在低浓度目标序列的检测中存在一定的误差。
数字PCR具有更高的精确性和灵敏度。
通过将PCR反应体积分成许多小份,数字PCR可以在每个小份中检测到目标序列的存在与否。
通过对每个小份进行计数,可以计算出目标序列的精确浓度,减少了PCR结果中的误差。
3.3 应用范围由于数字PCR具有更高的精确性和灵敏度,它在一些需要准确检测目标序列浓度的领域中具有优势。

数字PCR的应用与原理1. 引言数字PCR(Digital Polymerase Chain Reaction)是一种基于传统PCR技术的新型PCR方法。
与传统PCR方法相比,数字PCR具有更高的灵敏度、准确性和可靠性。
数字PCR主要基于分离DNA分子,使其每个储存容器(例如微小反应管)中仅包含一个DNA分子,从而可以在无需扩增的情况下精确测定每个DNA分子的存在与否。
本文将介绍数字PCR的应用和原理,并对其在基因表达分析、疾病诊断及分子遗传学等领域中的潜在应用进行探讨。
2. 应用数字PCR在许多领域中具有广泛的应用潜力,包括基因表达分析、病原体检测、臨床實驗室診斷等。
以下是数字PCR的一些主要应用:2.1 基因表达分析数字PCR可以用于测定基因的表达水平。
传统的PCR方法在估计基因表达水平时存在一定的不准确性,而数字PCR可以实现准确计数和定量分析。
通过将RNA反转录为cDNA,然后在数字PCR平台上进行扩增和检测,可以精确计算出每个基因的表达量。
2.2 病原体检测数字PCR在临床诊断中有广泛的应用。
传统的病原体检测方法通常需要进行多次扩增和检测,而数字PCR可以通过将样本分散到许多反应体中,从而减少虚警率和漏警率。
数字PCR在病原体的快速检测上具有巨大的潜力,可以在早期诊断中发挥重要作用。
2.3 DNA定量检测数字PCR也可以用于精确测定DNA的浓度和拷贝数。
在科学研究和实验室工作中,对DNA样本进行定量是非常重要的。
数字PCR可以提供精确的DNA浓度和拷贝数测量,有助于实验的准确性和可重复性。
3. 原理数字PCR的基本原理是将DNA分子在反应体中进行分离,使每个反应体中只包含一个DNA分子。
然后,通过扩增和检测每个反应体中的DNA分子,从而得出每个分子的存在与否。
数字PCR的具体步骤如下:1.采集DNA样本,并将其反转录为cDNA。
2.将反转录的cDNA分散到许多微小反应管或孔中。
通常使用微流控技术进行自动分散。

液滴数字pcr技术液滴数字PCR技术是一种新兴的分子生物学技术,它在基因检测和疾病诊断等领域有着广泛的应用。
与传统的PCR技术相比,液滴数字PCR技术具有更高的准确性和灵敏度,能够在更短的时间内完成实验,并且能够同时检测多个基因。
液滴数字PCR技术的原理是将待测样品分成微小的液滴,在PCR反应中每个液滴都是一个独立的反应体系。
通过实时监测反应体系中的荧光信号,可以准确地计算出待测基因的拷贝数目。
这种技术不仅能够检测稀有的突变基因,还可以对基因的拷贝数目进行精确测量,从而为基因检测和疾病诊断提供了更可靠的结果。
液滴数字PCR技术的优势主要体现在以下几个方面:1. 准确性高:由于每个液滴都是一个独立的反应体系,可以避免扩增中的交叉污染,从而提高了实验的准确性。
2. 灵敏度高:液滴数字PCR技术可以检测到非常低浓度的目标基因,对于稀有突变基因的检测具有很大的优势。
3. 高通量:液滴数字PCR技术可以同时处理大量的样品,大大提高了实验的效率。
4. 快速性:与传统PCR技术相比,液滴数字PCR技术能够在更短的时间内完成实验,节省了实验时间。
5. 可靠性高:由于每个液滴都是独立的反应体系,即使在样本中有少量的污染或者损失,也不会对结果产生影响。
液滴数字PCR技术在基因检测和疾病诊断等领域有着广泛的应用。
例如,在肿瘤早期诊断中,液滴数字PCR技术可以检测到低浓度的肿瘤标志物,从而提前发现肿瘤并进行治疗。
在遗传病的筛查中,液滴数字PCR技术可以检测到罕见的突变基因,帮助家庭了解自身的遗传风险。
此外,液滴数字PCR技术还可以用于病毒感染的检测、药物研发、环境监测等领域。
然而,液滴数字PCR技术也存在一些挑战和局限性。
首先,液滴数字PCR技术的设备和试剂成本较高,对实验室的设备和经费要求较高。
其次,液滴数字PCR技术在样本处理和数据分析上也存在一定的技术门槛,需要熟练的操作和分析技巧。
此外,液滴数字PCR技术对样本的要求较高,需要保证样本的纯度和完整性,以获取准确的结果。

数字PCR与普通PCR的区别引言PCR(聚合酶链反应)是一种常用的分子生物学技术,用于在体外扩增特定DNA片段。
近年来,随着技术的发展,数字PCR(Digital PCR)作为PCR的一种新型形式,逐渐受到研究者的关注。
本文将重点探讨数字PCR与传统PCR之间的区别。
1. 反应方式传统PCR传统PCR是通过连续进行一系列的循环反应来扩增DNA。
反应开始时,所需的模板DNA、引物、酶和核酸酶被混合在一起,然后将反应混合物置于PCR仪中,按照特定的程序进行加热和降温循环,以使DNA的两个链得以分离和复制。
这个过程被称为PCR循环,通常包括:变性,退火和延伸。
数字PCR与传统PCR相比,数字PCR使用了微分反应环境,使得每个DNA分子都能被分别扩增。
数字PCR反应涉及将待扩增的DNA分子进行稀释,使得每个反应管中只有一个DNA分子。
然后,将每个反应管中的DNA分子进行扩增,并通过测量阳性和阴性信号的比例来计算起始模板DNA的数量。
数字PCR可以对每个分子进行单独扩增和计数。
2. 准确性传统PCR传统PCR的主要限制之一是它的信号强度与起始模板DNA的量之间呈指数关系。
当起始模板的数量较少时,PCR信号可能非常弱,从而使结果难以辨识。
这种信号的变异性限制了PCR的准确性。
数字PCR数字PCR在准确性方面具有明显优势。
由于数字PCR可以对每个DNA分子进行单独扩增和计数,因此可以避免信号的变异性。
数字PCR使用统计学方法来确定阳性和阴性信号的比例,从而计算起始模板的数量。
因此,数字PCR的准确性较高,能够提供可靠的结果。
3. 灵敏度传统PCR传统PCR的灵敏度通常受到起始模板DNA的限制。
当起始模板的浓度低于一定水平时,PCR反应可能无法从背景噪声中准确的检测到目标DNA序列。
数字PCR与传统PCR相比,数字PCR具有更高的灵敏度。
数字PCR可以将起始模板DNA稀释到每个反应管中仅有一个分子,因此可以非常准确地检测和计数每个目标分子。

数字PCR和qPCR的区别1. 引言PCR(聚合酶链反应)是一种重要的分子生物学技术,广泛应用于基因分型、病原体检测、DNA测序等领域。
随着技术的发展,PCR也分为了数字PCR(digital PCR)和qPCR(quantitative PCR)两种类型。
本文将介绍数字PCR和qPCR的区别。
2. 数字PCR数字PCR是一种精确计数目标序列拷贝数的方法。
它通过将待检测样本分成许多独立的反应区块,每个区块中只存在0个或1个目标序列。
数字PCR的主要步骤包括样本划分、PCR扩增、读取结果等。
数字PCR的主要优点是能够精确计数目标序列拷贝数,而不受PCR扩增效率的影响。
这种方法对于低拷贝目标的检测非常敏感,并且能够检测目标序列的变异情况。
另外,数字PCR的结果可以通过可视化的方式展现,对于分析数据非常方便。
然而,数字PCR的缺点是相对较为复杂,需要使用特殊的设备和试剂盒。
此外,数字PCR的通量相对较低,不能进行高通量的样本处理。
3. qPCRqPCR是一种定量检测目标序列拷贝数的方法。
它基于标准曲线法,通过PCR扩增的同时测量扩增产物的数量。
qPCR的主要步骤包括模板DNA制备、引物探针设计、PCR 扩增、扩增曲线分析等。
qPCR的优点是简单快速,可以同时检测多个基因或样本。
它可以精确地定量目标序列的拷贝数,并且具有高通量的优势。
另外,qPCR还可以分析目标序列的表达水平和变异情况。
然而,qPCR的缺点是对PCR扩增效率敏感,需要进行标准曲线法的建立和验证。
此外,由于PCR扩增过程中产生的非特异性产物,可能会导致假阳性结果。
4. 比较数字PCR和qPCR在原理、应用以及优缺点上存在一些区别。
•原理:数字PCR通过样本分区计数目标序列,而qPCR通过PCR扩增测量目标序列的拷贝数。
•应用:数字PCR常用于低拷贝目标的检测和变异分析,而qPCR适用于目标序列的定量和表达水平分析。
•优点:数字PCR能够精确计数目标序列拷贝数,对低拷贝目标敏感;qPCR快速简便,可同时检测多个样本或基因。

H1N1检测:定量PCR和数字PCR基于荧光定量PCR对突变病毒株的检测灵敏度一般在10%,该水平和循环肿瘤游离DNA的检测相当。
10%的检测灵敏度能满足确诊的要求,但对病情进展及治疗效果的监控还是不够的。
加拿大拉瓦尔大学(Laval University)和Bio-Rad公司的科学家共同完成了一项对H1N1达菲耐药性突变株检测的测试,比较了荧光定量PCR和数字PCR两种方法在相同的反应预混液,相同的引物、探针,相同的测试等情况下的检测灵敏度,重复性等。
这项“背对背”比较研究的步骤及结论依次介绍如下。
1.纯化得到H275野生型RNA,recombinant influenza A(H1N1)pdm09virus (GenBankFN434457 to FN434464)。
2.外位点定向诱变构建H275Y NA突变株并纯化得到对应的RNA。
3.在1,000~100,000的范围内对H275和H275Y进行2倍梯度稀释,将ddPCR预混液作为qPCR的反应液测试其扩增效率。
结果证实qPCR扩增效率在90~110%之间,因此后续qPCR和ddPCR的比较完全在相同的预混液条件下进行,排除了预混液的差异可能对实验结果造成的影响。
4.在10,000~1,000,000的范围内对H275和H275Y进行10倍梯度稀释,在52~64℃之间进行温度梯度优化,最佳退火温度确定为55℃。
最终得到野生型和突变型同时检测的双重PCR体系,其中FAM通道对应野生型,HEX通道对应突变型。
具体流程及图释见下图。
5.qPCR的检测在Roche公司的LightCycler 480上完成,ddPCR的条件测试及检测在Bio-Rad公司的QX200 droplet digital PCR系统上完成。
1.将H275Y加入含量固定的H275中,其中H275Y的含量为2倍梯度。
总共7个梯度,实测结果见下图B部分。
检测灵敏度为1.6%。
2.其次还分别设置了阴性对照,H275野生型对照和H275Y突变型对照分别测试双重ddPCR检测体系,测试不同条件下的LOQ(Limit of Quantification)。

PCR技术的类型原理及应用什么是PCR技术?聚合酶链反应(Polymerase Chain Reaction,PCR)是一种在分子生物学实验室中常用的技术,可以在体外扩增DNA片段。
PCR技术的出现为基因检测、基因工程和分子生物学等领域提供了极大的便利。
PCR技术的基本原理是将一段DNA模板序列在体外通过一系列的温度循环中,利用热稳定的DNA聚合酶(如Taq聚合酶),进行大规模扩增。
PCR技术是一种体外扩增DNA的方法,它通过热循环,迅速复制和扩增DNA。
PCR技术的类型PCR技术主要有以下几种类型:1.常规PCR:常规PCR是最常用的PCR技术类型,也被称为标准PCR或常规聚合酶链反应,它在一定程度上限制了DNA扩增的长度。
常规PCR通常适用于生成较小的DNA片段,Typically, 优化后的反应条件是将样本DNA与引物,缓冲液和聚合酶加入于反应管中,反应管放入PCR仪中进行温度循环,使DNA扩增。
2.逆转录PCR:逆转录PCR是一种将RNA转录成DNA进行扩增的技术。
该技术首先将RNA逆转录成cDNA,然后对cDNA进行PCR扩增。
逆转录PCR在研究基因表达、研究RNA病毒等方面具有重要的应用价值。
3.实时定量PCR:实时定量PCR是PCR技术的进一步发展,它可以即时监测PCR反应过程中的DNA扩增量。
实时定量PCR通常根据荧光信号的增加来监测反应的进程,可以实时定量和分析样本中的DNA含量。
该技术广泛应用于基因表达分析、疾病诊断等领域。
4.数字PCR:数字PCR是一种精确测量DNA的技术,可以绝对定量DNA的拷贝数。
和实时定量PCR相比,数字PCR可以更准确地测量目标DNA的拷贝数,但适用范围相对较窄。
5.多重引物PCR:多重引物PCR(Multiplex PCR)是一种同时扩增多个目标序列的技术。
在一个PCR反应体系中,通过引入多个不同的引物和多个目标DNA,可以同时扩增多个目标序列。

PCR仪不同分类的对比PCR(聚合酶链反应)是一种用于扩增DNA(脱氧核糖核酸)的技术。
PCR仪是 PCR 实验中不可或缺的设备。
PCR 仪种类繁多,根据不同的特点和实验需求,可以将 PCR 仪分为以下几类。
1. 常规 PCR 仪常规PCR 仪是最早的PCR 仪,其主要特点是功率稍小,不适用于大规模扩增。
其定温功能常常采用两步式升温,程控温度区间为4-99°C,最高可达100°C。
常规 PCR 仪最常见的是使用96孔板,但也有少量供应48孔、384孔板的型号。
常规 PCR 仪适用于小规模试验和学术研究,其优点是设备简单,价格便宜,维修方便。
不过,由于功率小,不能满足高通量的扩增。
2. 实时 PCR 仪实时 PCR 仪是常规 PCR 仪的升级版,是目前应用最广泛的 PCR 仪型号。
与常规PCR 仪相比,实时PCR 仪功率大、扩增速度快,精确度高,适用于高通量扩增。
实时 PCR 仪不仅可以监测反应进行,还可以在反应进行中以定量方式测定扩增物的量和浓度。
其工作原理是在反应进行中,通过测量荧光信号来测定扩增产物的量。
在定量PCR(qPCR)实验中,荧光群体的荧光强度与样品中目标分子的浓度成正比,荧光信号可实时在反应过程中收集,并使用软件来分析和研究反应的结果。
实时 PCR 仪可分为相对定量和绝对定量两种:相对定量是以对照样本中的目标分子浓度作为基准,与待检样本中的目标分子浓度比较,用来研究基因在不同组织、不同阶段或不同环境下的表达量差异;绝对定量是基于标准曲线法,利用标准品进行定量,得出目标分子的精确浓度。
3. 数字 PCR 仪数字 PCR 仪是一种新型 PCR 仪,它采用了数字化技术,可以更加准确地定量扩增产物。
数字 PCR 仪工作原理是将反应混合液分散到微型液滴中,每个微滴只有一个扩增产物分子。
之后在 PCR 反应中,每个微滴中的分子会自行扩增成百万甚至亿级别的扩增产物,通过计数液滴个数及所含扩增产物的分子数,就可以得出目标分子在样品中的绝对量。
荧光定量和数字pcr-概述说明以及解释1.引言1.1 概述概述荧光定量PCR(Polymerase Chain Reaction)和数字PCR(Digital Polymerase Chain Reaction)是现代分子生物学研究中广泛应用的两种重要技术。
它们在检测和定量分析目标DNA或RNA的过程中具有很高的灵敏度和准确性。
荧光定量PCR技术基于传统PCR的原理,通过引入一个与特定目标序列相匹配的荧光探针,实现了对PCR扩增产物进行实时监测和定量分析。
该技术不仅可以快速准确地检测目标基因的存在与否,还可以测量目标基因在样本中的相对表达水平。
荧光定量PCR 被广泛应用于疾病诊断、基因表达分析、病原微生物检测等领域。
数字PCR是一种相对较新的PCR技术,它通过将PCR反应液样品分割为大量微型反应容器,每个容器中只有一个目标DNA分子或没有DNA 分子,然后在每个反应容器中进行PCR反应,最终通过统计正反应容器的数目来计算目标DNA的起始拷贝数。
相比于传统的荧光定量PCR,数字PCR具有更高的灵敏度和准确性,并且可以排除样本中的任何潜在干扰物质。
本文将重点介绍荧光定量PCR和数字PCR的原理和应用。
首先将介绍荧光定量PCR的基本原理,包括扩增反应、荧光信号生成以及实时监测和定量分析的原理。
随后会详细探讨荧光定量PCR在疾病诊断、基因表达分析和病原微生物检测等领域的应用,并举例说明其在科学研究和临床实践中的重要性。
接着,我们将转向数字PCR技术。
我们将解释数字PCR与传统PCR 的不同之处,并详细介绍数字PCR的原理和操作步骤。
同时,我们还将详细讨论数字PCR在DNA拷贝数变异检测、稀有基因突变筛查和细胞无创诊断等方面的应用,并展示其在生命科学研究中的潜在价值。
最后,我们将总结荧光定量PCR和数字PCR的优势,并展望未来发展方向。
这两种PCR技术在遗传学和临床医学研究中具有广阔的应用前景,随着技术的不断进步和创新,我们有理由相信荧光定量PCR和数字PCR 将会为我们揭示更多的生命奥秘,为疾病的早期诊断、治疗和预防提供更可靠的科学依据。
转基因食品成分检测技术研究进展转基因食品成分检测技术是一种用于确定食品中是否存在转基因成分的分析方法。
转基因食品是指通过现代生物技术手段将外源基因导入食品作物中,使其具有新的特性或优势的食品产品。
转基因食品在食品安全和公众健康方面引起了广泛关注,因此开发准确、快速、可靠的转基因食品成分检测技术非常重要。
目前,转基因食品成分检测技术的研究进展主要包括以下几个方面。
1.PCR法:聚合酶链反应(PCR)法是最常用的转基因食品检测方法之一、它可以特异性地扩增转基因植物中的特定DNA序列,并通过电泳分离和检测扩增产物来确定食品中是否存在转基因成分。
2.即时PCR法:即时PCR法是PCR技术的一种改进,可以在PCR反应过程中实时监测扩增产物的积累。
这种方法具有高灵敏度、高特异性和快速分析的优势,适用于大规模的转基因食品筛查。
3.数字PCR法:数字PCR法是一种新的转基因食品检测方法,可以实现对样品中转基因成分的绝对定量。
与传统PCR方法相比,数字PCR法具有更高的准确性和灵敏度,能够在低转基因成分水平下检测到微量的转基因成分。
4.荧光定量PCR法:荧光定量PCR法是一种利用荧光染料标记的探针对转基因成分进行定量分析的方法。
与传统PCR法相比,这种方法可以减少误判概率,提高检测灵敏度和可靠性。
5.下一代测序技术:下一代测序技术是目前最先进的基因测序技术之一,可以对DNA样品进行高通量的测序分析。
利用这种技术,可以对转基因食品样品中的整个基因组进行测序,并确定是否存在转基因成分。
总体来说,转基因食品成分检测技术在过去几十年取得了显著的进展。
这些技术不断提高着转基因食品检测的效率和准确性,为监管机构和消费者提供了更可靠的食品安全保障。
然而,由于不断涌现的新的转基因食品和转基因成分,还需要进一步研究和改进转基因食品检测技术,以满足市场需求并确保食品安全。
ddPCR的原理和应用1. ddPCR的基本概念ddPCR是数字PCR(Digital PCR)的缩写,是一种精确测量DNA或RNA分子丰度的方法。
与传统的PCR相比,ddPCR可以对目标分子进行数目的确定,而不是仅仅计算其相对含量。
2. ddPCR的工作原理ddPCR是通过将PCR反应分成大量的微小反应来进行的,每个微小反应中只有少量的目标模板分子。
这些微小反应分散在一个悬浮液中,并通过分配到大量的反应容器中来实现。
在PCR反应完成后,通过测量每个微小反应的阳性和阴性信号,可以准确计算出目标分子的绝对含量。
3. ddPCR的主要优势•高精确度:ddPCR可以提供更准确的目标分子的定量结果,尤其适用于高低丰度样本的分析。
•高灵敏度:由于将PCR反应分成小体积反应,ddPCR可以检测到非常低的目标分子丰度。
•抗干扰性强:ddPCR对杂交反应和抑制物具有较高的抗干扰能力,能够处理复杂的样本环境。
•无需标准曲线:ddPCR不需要依赖于标准曲线来确定目标分子的含量,因此可以节省分析时间和资源。
4. ddPCR的应用领域4.1 疾病诊断ddPCR在疾病诊断中的应用非常广泛。
通过检测患者样本中的特定DNA或RNA标记物的含量,可以快速、准确地诊断多种疾病,如癌症、感染性疾病等。
4.2 基因表达分析ddPCR可以用于研究基因表达的变化。
通过定量特定基因的mRNA水平,可以了解该基因在不同条件下的表达模式,进而揭示基因调控的机制。
4.3 微生物检测ddPCR能够检测微生物的存在和数量。
在食品安全和环境监测等领域,ddPCR 被广泛应用于微生物的检测和鉴定。
4.4 胚胎遗传学ddPCR可以进行胚胎遗传学检测,包括检测胚胎中的染色体异常、单基因病变等。
4.5 遗传变异研究ddPCR可用于研究个体之间的遗传变异。
通过检测特定基因的拷贝数变异、SNP等,可以了解个体之间的遗传差异与相关疾病的关系。
5. ddPCR的未来发展方向随着高通量测序技术的飞速发展,转录组学和基因组学的大数据分析成为了研究的主要方向之一。
三种PCR类型及应用多种PCR技术类型:1. 实时定量PCR(qPCR)实时定量PCR是一种检测PCR反应过程中的特定DNA序列的技术。
它可以实时监测PCR反应过程中的产物累积情况,通过检测DNA结合荧光染料的信号强度来定量分析起始模板的含量。
由于其高灵敏度和快速结果,实时定量PCR 被广泛应用于基因表达分析、微生物检测、病毒定量测定等领域。
2. 数字PCR数字PCR是一种基于微小级别的PCR技术,通过将PCR分成数百万份独立的反应来进行定量分析,从而实现对起始模板数的精确计数。
与传统PCR技术相比,数字PCR具有更高的灵敏度和准确性,尤其适用于低拷贝基因的检测和分析。
数字PCR广泛应用于检测稀有突变、检测微生物DNA和病毒DNA等领域。
3. 表面增强拉曼散射PCR表面增强拉曼散射PCR结合了PCR技术和拉曼光谱学,通过在PCR过程中引入金纳米颗粒来增强PCR产物的拉曼信号,从而实现对PCR产物的多重检测和分析。
表面增强拉曼散射PCR技术具有高速、高灵敏度和高特异性的特点,适用于分子生物学、生物医学和环境监测等领域。
不同类型PCR的应用:1. 实时定量PCR在基因表达分析中的应用实时定量PCR可以准确、快速地测定特定基因的表达水平,广泛应用于基因调控研究、药物筛选、疾病诊断等领域。
通过实时定量PCR技术,研究人员可以量化分析基因在细胞、组织或生物样品中的表达情况,从而深入了解基因的功能和调控机制。
2. 数字PCR在稀有基因检测中的应用数字PCR技术可以对样本中稀有基因的存在进行准确计数,适用于肿瘤标志物检测、胎儿DNA检测等需要高灵敏度和准确性的应用。
通过数字PCR技术,研究人员可以对样本中的特定基因进行精确检测,为疾病诊断和生物医学研究提供有力的支持。
3. 表面增强拉曼散射PCR在环境监测中的应用表面增强拉曼散射PCR技术可以实现对微生物DNA的可视化检测,广泛应用于环境监测和水质检测等领域。
分体式数字pcr和一体式数字pcr的对比分体式数字PCR和一体式数字PCR都是PCR技术的仪器设备,常用于核酸扩增和检测。
分体式数字PCR和一体式数字PCR各有特点,下面将从多个方面对两者进行对比。
1.设备结构:分体式数字PCR由控制模块和扩增模块组成,控制模块用于设定和监控PCR条件,扩增模块用于扩增反应。
而一体式数字PCR则将控制模块和扩增模块集成在一起,整个设备非常紧凑。
2.使用方便程度:一体式数字PCR的使用非常方便,只需将样品和试剂装载进入仪器,设置好相关参数即可开始实验。
而分体式数字PCR需要在两个模块之间进行样品转移,使用上稍微繁琐一些。
3.扩增通量:一体式数字PCR一次可以进行多个样品的扩增,通常可以同时进行数十个到数百个样品的扩增反应。
而分体式数字PCR通常一次只能处理少量样品,通量相对较低。
4.实验成本:一体式数字PCR通常会比分体式数字PCR更昂贵,因为其集成了更多的功能模块。
分体式数字PCR则相对便宜一些,但需要同时购买两个模块。
5.扩增效果:由于一体式数字PCR控制模块和扩增模块高度集成,可以实现更精确的温度控制和样品均质性。
因此,一体式数字PCR在扩增效果上可能更为稳定、准确一些。
分体式数字PCR在扩增效果上相对稍差一些。
6.可编程性:一体式数字PCR通常具有更丰富的可编程性,可以根据样品的不同需求进行个性化设置。
而分体式数字PCR通常只能根据仪器本身所提供的设置进行扩增反应。
总的来说,一体式数字PCR适用于对扩增反应的样品需求较大且精确性要求较高的情况,比如批量检测。
而分体式数字PCR则适用于扩增通量较小且经济成本相对较低的实验场景。
对于不同的实验需求,可以选择适合的PCR仪器。
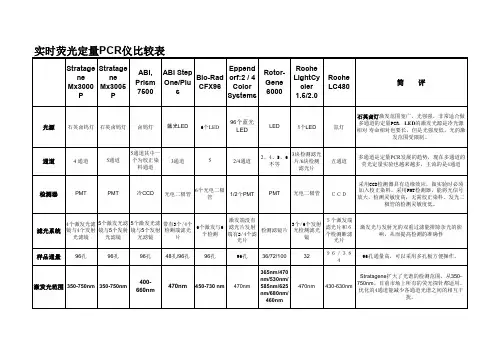
荧光定量PCR和数字PCR的区别关键词:荧光定量PCR仪、数字PCR仪、微量分光光度计定量PCR还是数字PCR随着数字PCR技术应用的展开,越来越多实验室被其绝对定量的方式、结果的高灵敏度、高重复性等特质所吸引。
2012年年底,由Frost & Sullivan公司在北美市场进行的调研显示,约三分之一的被访者表示会考虑购买数字PCR设备。
那么,是否意味着目前在研究、临床和工业领域内,广泛采用的荧光定量PCR技术将被淘汰?数字PCR很快就要将其彻底取代?越来越多实验室对陈斯卡提出类似问题。
结合多年推广定量PCR与近几年投身数字PCR领域的经验心得,陈斯卡谈谈自己的体会,供大家参考。
陈斯卡总体的观点是:虽然绝大多数定量PCR的应用都可以使用数字PCR完成,但在可预期的将来,两者将长期共存。
到底使用定量PCR还是数字PCR,取决于具体应用和对数据的要求。
两者不是either/or的关系,而是both/and的关系。
两种技术平台各自的特点与现状大致可从下面8个方面说明。
1. 在20多年的使用和发展中,定量PCR作为一种技术平台,已经产出海量的数据,在工业界和分子检测的某些应用上,定量PCR已经成为金标准。
基础研究方面,则形成了被称为MIQE的定量PCR标准实验指南。
2. 在定量PCR的各种应用中,基因表达分析(gene expression analysis)的应用比重约占七成,综合各种因素来看,眼下定量PCR还是进行基因表达研究的理想手段。
3. 上述的各种因素具体展开,主要包括:通量、自动化程度、各种检测探针与染料、检测通道、成本和可参考文献与protocol的数目等等。
4. 就目前市场上已有的数字PCR设备来看,定量PCR在检测的线性范围上具有优势,意味着同一个run内可对各种表达丰度的样品进行分析。
5. 目前定量PCR已经能实现高通量样品条件下的自动化操作。
6. 数字PCR在单分子层面上的绝对定量,可以彻底摆脱对标准曲线的依赖而直接给出靶序列的拷贝数,提高了实验结果在批内和批间的稳定性,甚至能用来对标准品进行定标。