《脊髓性肌萎缩的发病机制及治疗方法》-孙致远
- 格式:doc
- 大小:1.08 MB
- 文档页数:8

脊髓性肌肉萎缩怎么治疗脊髓性肌肉萎缩属于致死性神经肌肉疾病,其影响重大,严重威胁了人们的生命健康。
关于脊髓性肌肉萎缩症,很多人没有听过,不甚了解,故此,下文将以科普的形式进行阐述。
1、脊髓性肌肉萎缩症是什么疾病脊髓性肌肉萎缩症简称SMA,属于神经肌肉疾病,是由于脊髓前角运动神经元发生变异,为常染色体隐性遗传病。
近几年全国各地发现脊髓性肌肉萎缩症患者呈现出上升趋势,因为该疾病的临床表现差异比较大,所以遵循由重到轻的原则划分为4个类型,不同类型的表现不同,但总体特点不变,均为脊髓前角细胞出现变性。
2、脊髓性肌肉萎缩症的临床表现①SMA Ⅰ型:这一类患者宫内表现以胎动少为主,出生多为松软儿。
一半在6个月左右发病,表现为松软无力、肌张力低下、吸吮以及吞咽困难、呼吸急促,以腹式呼吸为主。
其下肢受累重,近端严重,不具备独坐能力,也不会主动翻身以及抬头。
患儿肌肉萎缩并不明显,但会出现轻度的关节畸形,智力不受影响。
但如果不及时治疗,患儿会出现自主运动能力,生命周期维持1—2岁。
②SMA Ⅱ型:这一类患儿从出生到6个月均无表现,其发育正常,也具备翻身、独坐的能力,但是6个月之后患儿发育会逐渐的停滞,在出生1岁半左右,患儿出现全身性肌无力以及肌张力低下。
经临床证实,经检查患儿四肢肌肉无力,有部分患者会出现手部震颤,无法自主行走,脊柱侧弯严重,对呼吸功能也产生影响,智力正常,通常生命周期为10—20岁。
③SMA Ⅲ型:这一类患者在出生一年内均无任何临床表现,但到青春期会发病,具备独立行走的能力,根据研究,该类型包括Ⅲa类与Ⅲb类,对于前者而言,发病时间在3岁前,后者为3岁后,患儿的肌无力会伴随着时间逐渐的加重,虽经临床治疗预后良好,但是在多年之后仍旧出现脊柱变形。
生命周期可延续到中年。
④SMA Ⅳ型:该类型也被称之为成人型SMA,在患者中年、老年均会发病,主要表现为四肢近端无力,与其它类型相比较,总体的病情发展缓慢,但寿命并不会受到影响。


脊髓延髓性肌萎缩症的肌电生理特点作者:欧阳至吉陈晴来源:《中国医学创新》2014年第23期【摘要】目的:探讨脊髓延髓性肌萎缩症(SBMA)的电生理特点。
方法:总结并回顾分析了7例SBMA患者的神经传导和针极肌电图的特点,并以肌萎缩侧索硬化(ALS)患者作为对照组,与SBMA组进行比较。
结果:(1)SBMA组复合肌肉动作电位(CMAP)异常的患者和神经的出现率均明显低于ALS组(P【关键词】脊髓延髓性肌萎缩;肌萎缩侧索硬化;肌电图脊髓延髓性肌萎缩症(spinal-bulbar muscular atrophy,SBMA)是一种少见的神经系统遗传性疾病,属于下运动神经元病综合征之一。
SBMA主要靠基因分析进行确诊,而我国仅有极少数大型医院能够有条件开展此项技术。
为此笔者回顾分析了诊断为SBMA的7例患者的神经肌电图资料,发现此类疾病有其特殊的电生理表现,可作为鉴别诊断的重要依据,现报道如下。
1 资料与方法1.1 一般资料收集2004年8月-2014年3月本院收治的SBMA患者7例,经基因检查诊断明确。
均为男性,年龄35~54岁,平均(46.86±7.29)岁;病程1.5~8年,平均(3.79±2.12)年。
7例患者中仅1例有明确的家族史;6例曾行血清肌酶检测,肌酸磷酸肌酶轻、中度升高(256~2654 U/L);起病部位:四肢同时起病3例,上肢起病2例,下肢起病2例;6例患者肢体近端肌无力,1例以双手肌萎缩无力为首发表现,均无客观感觉异常体征;3例患者曾行肌肉活检,2例证实为神经源性病理改变,1例为神经源性伴肌源性混合病理改变;在行肌电图检查前,有2例曾诊断为肌营养不良或肌病,3例诊断为ALS或多灶性运动神经病(MMN)。
以同期临床确诊为ALS的30例患者作为对照组,男20例,女10例,年龄35~80岁,平均(53.80±11.60)岁;病程4个月~4年,平均(1.16±0.84)年。
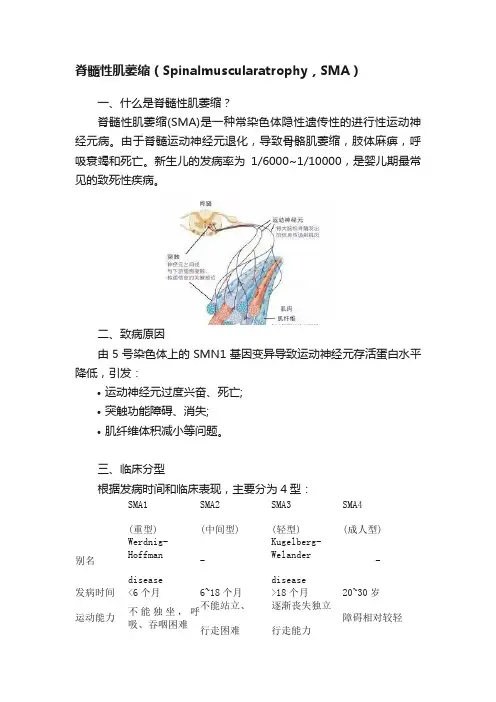
脊髓性肌萎缩(Spinalmuscularatrophy,SMA)一、什么是脊髓性肌萎缩?脊髓性肌萎缩(SMA)是一种常染色体隐性遗传性的进行性运动神经元病。
由于脊髓运动神经元退化,导致骨骼肌萎缩,肢体麻痹,呼吸衰竭和死亡。
新生儿的发病率为1/6000~1/10000,是婴儿期最常见的致死性疾病。
二、致病原因由5号染色体上的SMN1基因变异导致运动神经元存活蛋白水平降低,引发:•运动神经元过度兴奋、死亡;•突触功能障碍、消失;•肌纤维体积减小等问题。
三、临床分型根据发病时间和临床表现,主要分为4型:SMA1 (重型) SMA2(中间型)SMA3(轻型)SMA4(成人型)别名Werdnig-Hoffmandisease-Kugelberg-Welanderdisease-发病时间<6个月6~18个月>18个月20~30岁运动能力不能独坐,呼吸、吞咽困难不能站立、行走困难逐渐丧失独立行走能力障碍相对较轻寿命不到2岁青少年正常正常四、预防措施常规人群:每50个人中,大约有1人携带SMN1基因变异。
可在遗传咨询后,选择进行SMA携带者筛查。
高危人群:有家族史的高危人群,在婚、孕前应筛查是否携带SMN1的基因变异。
若是,怀孕后应进行产前诊断。
五、遗传方式1.若夫妻双方都携带基因变异,则孩子有25%的可能性健康,50%的可能性成为携带者,25%的可能患病。
2.若夫妻有一方携带基因变异,则孩子有50%的可能性健康,50%的可能性成为携带者,都不会患病。

《脊髓性肌萎缩症多学科管理专家共识》(2019)要点《脊髓性肌萎缩症多学科管理专家共识》(2019)要点一、临床表现该病临床表现差异较大,根据患者起病年龄和所获得的最大运动功能,将SMA由重到轻分为4型。
1.1型:也称werdnig-Hoffman病,即婴儿型,约占全部SMA病例的45%。
患儿出生后6个月内起病,出现迅速发展的进行性、对称性四肢无力,最大运动能力不能达到独坐。
肌无力以近端为著,由于显著肌张力低下,平躺时下肢呈“蛙腿”样姿势。
2.2型:也称Dubowitz病,即中间型,约占30%~40%。
患者多在生后6~18个月起病,进展较1型慢,最大运动能力可达到独坐,但独坐年龄可能落后于正常同龄儿,不能独站或独走。
3.3型:也称Kugelberg-Welander病,即青少年型,约占20%。
患者多在出生18个月后起病,早期运动发育正常,可独走,部分独走时间延迟。
随年龄增长出现以近端为主的肌无力,下肢重于上肢,最终部分丧失独走能力,逐渐依赖轮椅。
4.4型:晚发型,即成人型,早期运动发育正常,成人起病,出现肢体近端无力,进展缓慢,预期寿命不缩短。
二、发病机制位于染色体5q11.2-q13.3的SMNl基因是5qSMA的主要致病基因,SMNl基因致病性突变引起编码的活动神经元存活卵白表达水平下降或功能丧失。
三、检查项目与诊断流程1.搜检项目:临床疑诊为SMA的患者,即施展阐发为躯干和四肢近端肢体为主的进行性、对称性肌无力和肌萎缩、肌束颤、腱反射削弱或消失、智力正常,可以选择以下辅佐搜检以明确诊断。
(1)基因检测:(2)血清肌酸激酶(CK):(3)肌电图:(4)肌肉病理:2.诊断流程:临床施展阐发典型、高度怀疑SMA的患者,可直接行基因检测。
如果疑诊神经肌肉病,诊断指向不明者,可同时行血清CK、肌电图、神经传导速度搜检或肌活检病理搜检,此类搜检不克不及确诊SMA,但有助于鉴别诊断及引导下一级诊断偏向。


脊髓性肌肉萎缩的病因治疗与预防脊髓肌萎缩(SMA)是指一种由脊髓前角细胞变性引起的肌无力和肌萎缩的疾病。
一半在出生后一个月内生病,男女发病率相等。
SMA-Ⅱ型发病较SMA-Ⅱ型稍迟,通常于1岁内起病,极少于1~2岁间起病。
Ⅱ~Ⅱ类型属于常染色体隐性遗传病,是婴儿期最常见的致死性遗传病。
Ⅱ常染色体隐性、显性和X不同的遗传方式,如连锁隐性。
一、脊髓性肌肉萎缩Ⅰ型又称Werdnig-Hoffmann疾病。
在宫内疾病中,母亲可以注意到胎儿运动减弱。
出生后不久,肌肉张力较低,肌肉无力主要受四肢近端肌肉群的影响,躯干肌肉无力。
儿童吮吸和吞咽能力较弱,哭声较低,呼吸较浅,可出现胸部异常活动。
翻身和抬头都很困难。
肌腱反射消失了。
触摸诊断可以发现四肢肌肉萎缩,但经常被皮下脂肪覆盖。
眼球运动正常。
括约肌功能正常。
舌肌萎缩和束颤,关节畸形或挛缩。
这种类型的预后很差。
大多数死于出生后18个月。
二、脊髓肌萎缩Ⅰ型脊髓性肌萎缩比脊髓性肌萎缩更发病Ⅱ类型稍晚,通常在1岁以内发病,很少在1~2岁以下发病。
脊髓肌萎缩的发病率Ⅱ类型相似。
婴儿早期生长正常,但6个月后运动发育迟缓。
虽然他们可以坐着,但他们没有达到正常水平。
超过1/3的儿童不能行走。
20%~40%孩子们在10岁之前仍然有行走能力。
大多数病例表现为严重的肢体近端肌无力,下肢比上肢更重,呼吸肌和吞咽肌一般不受影响。
面部肌肉受累。
舌肌和其他肌肉颤抖。
肌腱反射减弱或消失。
这种类型有一个相对良性的过程,大多数可以活到儿童,有些可以活到成年。
三、脊髓肌肉萎缩Ⅰ型1、又称Kugelberg-Welander疾病。
它通常发生在幼儿期到青春期,而且大多数发生在5岁之前。
疾病的隐性攻击表现为进行性肢体近端肌无力和萎缩。
早期大腿和髋部肌无力明显,导致患儿行走鸭步,爬梯困难,逐渐累及肩胛带和上肢肌肉。
脑神经支配的肌肉群通常不受影响,但面部肌肉和软腭肌和软腭肌无力。
眼外肌正常。
大约四分之一的病例伴有腓肠肌假性肥大,这在男性患者中几乎很常见。

诺西那生钠在脊髓性肌萎缩症治疗中的应用研究进展刘晓晓,李渊明,尹榕甘肃省中心医院神经内科,兰州730000摘要:脊髓性肌萎缩症(SMA)是由运动神经元存活(SMN)基因突变引起的常染色体隐性遗传病,是婴幼儿及儿童常见的致死性遗传病之一,分为SMA0型、SMAⅠ型、SMAⅡ型、SMAⅢ型、SMAⅥ型。
诺西那生钠属于第二代反义寡核苷酸药物,由18个核苷酸组成,需鞘内注射给药,具有较高的选择性和较低的免疫原性。
诺西那生钠可通过与靶标基因的RNA结合转录生成大量SMN蛋白,是所有临床分型和年龄的SMA患者的首选基因修饰治疗方法。
诺西那生钠可提高基因诊断为SMA但未出现临床症状的患儿的存活率及改善临床症状,但相关研究样本量较小,需扩大样本量、延长观察时间。
诺西那生钠可提高SMAⅠ型患者生存期,改善运动功能缺损的临床症状。
诺西那生钠对SMAⅡ型、SMAⅢ型、SMAⅥ型患者的治疗效果较好,可显著改善患者的HFMSE评分。
诺西那生钠可以显著改善各类型SMA患者的运动功能,且具有较好的安全性与耐受性,同时也存在转氨酶升高、蛋白尿、血小板减少症等不良反应,通常停药后可自行好转。
关键词:常染色体隐性遗传病;脊髓性肌萎缩症;反义寡核苷酸药物;诺西那生钠doi:10.3969/j.issn.1002-266X.2023.33.025中图分类号:R746.4 文献标志码:A 文章编号:1002-266X(2023)33-0104-04脊髓性肌萎缩症(spinal muscular atrophy,SMA)是由位于第5号染色体上5q13.2区域的运动神经元存活(survival motor neuron 1,SMN1)基因突变引起SMN蛋白缺乏所致的常染色体隐性遗传病。
SMN蛋白为脊髓前角细胞发育的必须蛋白,缺乏后表现为进行性近端肢体无力及萎缩[1]。
SMA的发病率为1/ 10 000~1/6 000[2],基因携带率为1/50~1/40。

脊髓性肌萎缩症临床实践指南脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)是一种遗传性、进行性的神经肌肉疾病,其主要表现为肌肉无力、运动功能受限以及呼吸困难。
该疾病主要由SMN1基因突变引起,导致脊髓运动神经元退化和死亡,进而影响肌肉的正常功能。
SMA患者的临床表现多样,且病程相差较大,因此,临床医生在处理SMA患者时需根据病情特点制定个体化的治疗方案。
为此,本文将讨论脊髓性肌萎缩症的临床实践指南。
一、疾病诊断1. 临床症状:SMA患者常表现为肌力减退、肌无力、运动障碍等症状,据此可初步诊断SMA。
2. 遗传学分析:通过检测SMN1基因在基因组中的状态(突变或缺失)来确认诊断。
3. 脊髓活检:在确诊SMA疑似患者中,脊髓活检可帮助明确诊断。
二、疾病分级根据病情严重程度,将SMA分为四个类型:1. SMA I型(婴儿型):发病早、病情严重,患儿多在出生后几个月内出现症状。
2. SMA II型(儿童型):发病年龄在7个月至18个月之间,病情相对较轻。
3. SMA III型(青少年型):发病年龄在18个月至晚期青少年期之间,病情轻至中度。
4. SMA IV型(成人型):发病年龄在成年后,病情相对较轻,患者生活质量相对较好。
三、治疗方案1. 维持治疗:对于SMA I型患者,主要目的是维持其生命,以便其性命安然度过婴儿期。
此时,辅助呼吸和喂食成为关键。
2. 肌力增加治疗:对于SMA II、III型患者,物理疗法和康复训练可有效提高肌力和运动功能。
3. 基因治疗:目前,脊髓性肌萎缩症的基因治疗药物“肌速递”(Zolgensma)已获得FDA批准上市,其可以补充SMN1基因,从而修复脊髓运动神经元。
4. 支持性治疗:多学科团队包括康复医学师、语言病理学师、饮食师等的参与,可提供全面的支持和帮助,改善患者的生活质量。
四、预后和随访1. 预后:SMA的预后因患者病情严重程度而异。
早期诊断和积极治疗可以改善患者的预后和生活质量。

脊髓萎缩的最佳治疗方法
脊髓萎缩是一种神经系统疾病,目前尚无根治方法。
但是,治疗方法可以帮助减轻症状,提高生活质量。
以下是一些治疗方法:
1. 物理治疗:这是一种改善肌肉和骨骼功能的方法。
物理治疗师可以设计个性化的锻炼计划和康复方案,以帮助患者保持肌肉力量和灵活性。
2. 呼吸治疗:脊髓萎缩会影响呼吸肌肉,导致呼吸困难。
呼吸治疗可以帮助患者增强呼吸肌肉,并提高呼吸效率。
3. 药物治疗:目前没有特定的药物治疗脊髓萎缩,但是有些药物可以缓解症状,如抗痉挛药物和止痛药物。
4. 营养治疗:脊髓萎缩会导致肌肉萎缩和体重减轻。
适当的饮食可以提供必要的营养,帮助患者保持健康体重和肌肉质量。
需要注意的是,每个患者的症状和治疗需求都不同,因此治疗方案应该根据个体情况而定。
治疗脊髓萎缩需要耐心和长期的努力,患者和家人应该积极与医生合作,制定并坚持治疗计划。
脊髓性肌萎缩发病机制及药物治疗
袁萍;蒋莉
【期刊名称】《儿科药学杂志》
【年(卷),期】2013(19)11
【摘要】脊髓性肌萎缩(spinal muscular atrophy,SMA)是一种常染色体隐性遗传的神经肌肉疾病,以进行性肌无力和肌萎缩为主要临床表现,其在活产婴儿中发病率为1/6000~1/10000,人群携带率为1/40~1/60,居致死性常染色体隐性遗传病的第二位,仅次于囊性纤维化。
目前该病只能进行综合支持治疗,无特效治疗方法。
但随着其分子遗传学发病机制的明确,研究者已研发了相应的治疗方案,
【总页数】4页(P60-63)
【关键词】脊髓性肌萎缩;发病机制;药物治疗;常染色体隐性遗传病;神经肌肉疾病;进行性肌无力;综合支持治疗;囊性纤维化
【作者】袁萍;蒋莉
【作者单位】重庆医科大学附属儿童医院
【正文语种】中文
【中图分类】R741
【相关文献】
1.小儿脊髓性肌萎缩症的分子学发病机理及基因诊断 [J], 张丽杰;赵振军;叶贤坤
2.肌萎缩侧索硬化运动神经元选择性损伤的可能发病机制 [J], 曾含漪;徐仁伵
3.新生儿期发病的脊髓性肌萎缩及其基因诊断(附四例报告) [J], 刘晓军;郭静;王丹;王庆杰
4.肌萎缩性侧索硬化的发病机制和治疗研究进展 [J], 王敏
5.脊髓性肌萎缩症的药物治疗研究进展 [J], 冯艺杰;毛姗姗
因版权原因,仅展示原文概要,查看原文内容请购买。
肌萎缩性脊髓侧索硬化症与铜锌超氧化物歧化酶之间关系的研
究…
孙立峰
【期刊名称】《国外医学:遗传学分册》
【年(卷),期】2000(023)005
【摘要】肌萎缩性脊髓侧索硬化症(amyotrophiclateral
sclerosis,ALS)是一种致命的神经退化性疾病,在ALS所有的病例中有5%~10%是家族性ALS(FALS),它是一种常染色体显性遗传病,与21号染色体上的SOD-1基因(编码铜锌超氧化物歧化酶〈Cu/Zn-SOD〉)的突变有关,但突变的Cu/Zn-SOD酶功能障碍并不能直接损伤神经元而导致ALS的发生。
因为正常野生型Cu/Z
【总页数】3页(P250-252)
【作者】孙立峰
【作者单位】安徽医科大学生物化学及分子生物学教研室,安徽合肥
【正文语种】中文
【中图分类】R746.4
【相关文献】
1.Akt在肌萎缩性脊髓侧索硬化症转基因鼠脊髓中的表达变化及意义 [J], 陈燕春;
刘焕彩;管英俊;张彩霞;周风华;高海玲;王珊珊
2.肌萎缩性脊髓侧索硬化症细胞模型中mRAGE和esRAGE选择性剪接变化研究
[J], 倪晶;庄菊花;王国玉
3.家族性肌萎缩侧索硬化症患者及家系成员血中铜/锌超氧化物歧化酶活性及丙二醛水平变化与临床分型的关系 [J], 王进;罗杰峰;梁秀龄
4.肌萎缩侧索硬化症家系铜锌超氧化物歧化酶基因突变位点的检测 [J], 胡俊;史树贵;李露斯;吴玉章;倪兵
5.家族性肌萎缩性侧索硬化症的遗传学与超氧化物歧化酶(SOD—1) [J], 后藤顺;赵育桢
因版权原因,仅展示原文概要,查看原文内容请购买。
The Journal of Neuroscience, June 10, 2015 • 35(23):8691– 8700 •8691《神经科学杂志》,2015年6月10日•35(23):8691 - 8700×8691Disease Focus疾病的关注(部位疾病)Editor’s Note: Disease Focus articles provide brief overviews of a neural disease or syndrome, emphasizing potential links to basic neural m echanisms. T hey a re p resented i n t he h ope o f h elping r esearchers i dentify c linical i mplications o f t heir r esearch. F or m ore information, see /misc/ifa_minireviews.dtl.编者按:部位疾病的文章提供神经疾病或综合征的简要概述,强调潜在联系的基本神经机制。
他们希望能帮助相关研究人员认识到此项研究的临床价值。
有关更多信息,请参见h t t p://w w w.j n e u r o s c i.o r g/m i s c/i f a_m i n i r e v i e w s.d t l。
Disease Mechanisms and Therapeutic Approaches in Spinal Muscular Atrophy脊髓性肌肉萎缩症的治疗方法和发病机制校译:孙致远Sarah Tisdale1,2 and Livio Pellizzoni1,21Center for Motor Neuron Biology and Disease and 2Department of Pathology and Cell Biology, Columbia University, New York, New York 10032运动神经元生物学疾病病理学和细胞生物学中心,哥伦比亚大学,纽约,纽约10032运动神经元疾病就是神经系统发生失常。
其主要特点是脊髓的运动神经元发生变性、骨骼肌的萎缩和衰弱,这些运动功能的障碍常常是致命的。
脊髓性肌萎缩(SMA)是一种严重并且高发病率的常染色体隐形遗传的运动神经元疾病,也是导致婴儿死亡最常见的遗传性疾病。
SMA是由运动神经元存活基因1(SMN1)的基因突变和运动神经元存活基因2(SMN2)多保留了一个亚等位旁系同源基因导致的。
早期的研究建立了一个功能缺失的疾病机制,该机制涉及SMN的很多不足并且建议SMN作为一个可能的治疗方法。
近年来在SMA动物模型上SMN基因对核糖核酸加工中的关键作用的试验,大大增强了我们对于该病的细胞以及分子基础方面的了解。
SMA正成为一种RNA(核糖核酸)疾病不限于运动神经元细胞,甚至涉及到可能运动电传导的功能失常包含的多种亚神经元以及另外的细胞种类。
SMA研究进展也导致一些可能有效治疗的发展,比如证明对临床试验中SMA的动物模型是有效的治疗。
这些动物替代试验对于这仍然无法治愈的神经退行性疾病的治疗提供前所未有的希望。
Received J an. 30, 2015; r evised A pril 29, 2015; a ccepted M ay 5, 2015.The authors declare no competing financial interests.Correspondence should be addressed to Livio Pellizzoni, Center for Motor Neuron Biology and Disease, Department of Pathology and Cell Biology, Columbia University, Physicians and Surgeons Building, Room5-421, 630 West 168th Street, New York, NY 10032. E-mail:********************.edu.DOI:10.1523/JNEUROSCI.0417-15.2015Copyright ©2015 t he a uthors 0270-6474/15/358691-10$15.00/0收到2015年1月30日,修改后的4月29日,2015;接受5月5日,2015。
作者声明没有交叉的经济利益。
信件应该写给Livio Pellizzoni中心运动神经元生物学和疾病,病理和细胞生物学,哥伦比亚大学内科医生和外科医生,5 - 421房间,630西168街,纽约10032。
电子邮件:********************.edu。
DOI:10.1523 / jneurosci.0417 - 15.2015版权©2015作者0270 - 6474/15/358691 - 10美元的15.00/0Introduction 引言人类所必须的一些行为例如吞咽,呼吸,运动都依赖于精准的运行控制。
在复杂的神经网中,运动神经元协调活动对于运动系统功能是至关重要的。
破坏了神经网会导致对人的致命疾病如脊髓性肌萎缩(SMA)和脊髓侧索硬化性肌萎缩性症(ALS),它们分别是婴儿期以及成人期两种最常见的运动神经元疾病。
不断有证据将这些疾病和核糖核酸加工基因联系在一起,但这并不代表着解决它是治疗SMA或ALS的有效方式。
社会及个人基金会和病患拥护的组织支持了学术和产业研究者们的努力,这些努力在SMA领域取得了巨大的科学进步。
在这里,我们讨论对于SMA的分子和细胞的基本原理以及备选疗法的发展,旨在不久的将来减轻破坏性运动失常的造成的后果。
Clinical features of SMA SMA的临床表现2 • J. Neurosci., June 10, 2015 • 35(23):8691– 8700 Tisdale and Pellizzoni Spinal Muscular Atrophy SMA 是一种主要影响儿童的遗传性神经肌肉疾病。
它是婴儿死亡的主要遗传原因, 并且是继囊性纤维化病之后第二大最常见的常染色体隐形基因缺陷疾病(Lunn and Wang, 2008)。
每6000到10000个新生儿中就有一个受此疾病的影响,并且50个人中就会有1个携带者。
SMA 会导致脊髓前角细胞的α运动神经元发生退化和损失,导致肌无力,更严重的结局就是呼吸衰竭和死亡 (Crawford and Pardo, 1996).。
近心端肌肉更容易受疾病的影响。
比如较之下肢的肌肉,上肢就更容易受影响。
SMA 特异性易损性会导致运动神经元特有的症状,表明包含肋间,中轴肌以及横膈膜相对狭窄,这就导致了特有的钟状胸和反常呼吸。
根据发病年龄和疾病的严重程度对SMA 曾做过广泛的临床试验,并且根据发病年龄和已获得的最高的运动技能时间表被分类为几个不同的类型(Munsat and Davies, 1992)。
患有严重的I 型,也是最常见形式的SMA 患者,表现为:出生后不久(< 6个月大的时候),无法坐起来,并且无法活过两岁。
患有中等程度(II 型)的患者,该疾病影响在孩子18个月之前,他们可以笔直地坐着,但无法站起来。
较轻度的疾病(III 型)2岁后可以自己独立站立并且可以有一般人的寿命那么长。
SMA 其他的形式在最严重的两个极端中都已被识别出来: SMA 0型是疾病的产前形式,无论是在子宫内或者出生后几个月都是同样致命的(MacLeod et al., 1999),IV 型是SMA 的成人年形式,有轻微的肌无力不过能活到一般人的寿命 (Lunn and Wang, 2008)。
所有的SMA 患者,临床和电生理学研究与神经性失常是一致的。
在这种失常中,疾病症状出现以后,运动单位的缺失和快速功能减退也会很快出现,接着会有一段平台期,在平台期中,肌肉的力量会保持稳定。
(Crawford and Pardo, 1996; Ian- naccone et al., 2000; Swoboda et al., 2005)。
较平和但不严重的SMA 的形式可能是一些肌肉力量的保存和并行轴突生长以及肌纤维再生有联系,这是由大量运动单位和肌群纤维所体现出来的(Crawford and Pardo, 1996).。
SMA 的治疗只限于症状和支持性治疗。
Molecular genetics of SMA SMA 的分子遗传学虽然还没有有效的治疗方法可用于SMA 患者。
自从研究发现SMA 是由纯合子缺失或是SMN1(一种编码了SMN 蛋白质的基因)突变导致的,疾病的分子遗传学已经在二十年来被研究的很透彻了(Lefebvre et al., 1995)。
由于染色体(5q )大量的反向复制,人类基因组包含两个SMN-译码基因,SMN1 SMN2。
尽管这两个基因是几乎相同的,SMN2的外显子7 中单个的C 组转移到T 组打乱了一个外显子拼接,并且创造出一个外显子拼接(Cartegni and Krainer, 2002; Kashima and Manley, 2003)。
结果,单个基底重新定向了可变剪接,然后外显子7被排除大多数的SMN2外(Lorson et al.,1999; Monani et al., 1999)。
外显子7-排除 mRNA(SMN 。
17)编码一个缩短了的SMN 蛋白质,该蛋白质迅速分级(Lorson and Androphy, 2000; Cho and Dreyfuss, 2010)。
然而,一小部分来自SMN2的改版包括第7外显子和编码了功能完整的SMN 。
在SMA 的情况下,其中SMN1突变或被消除提供了足够多的SMN 以防止破坏性,但还不足以完全弥补SMN1的损失,导致运动神经元疾病重要的是,由于5 q 染色体复制内在的不稳定性,大量 SMN2的副本中出现在人类基因组并且SMN2复制数目与疾病严重程度呈负相关(McAndrew et al., 1997; Wirth et al., 2006)。
在一个SMN2疾病修饰能力的极端例子中,缺乏纯合子SMN1的个体已被识别出,这些由于复制了5个SMN2而缺乏SMA 症状(Prior et al., 2004)。
进一步来说, 包含了单核苷酸的SMN2的变异体提高了外显子7内含物的有效率,这些变异体能够在有轻微显性的SMA 患者中被识别出,尽管只携带SMN2的两种副本(Prior et al., 2009; Vezain et al., 2010)。