第一章 蛋白质的结构与功能
- 格式:pptx
- 大小:12.95 MB
- 文档页数:4


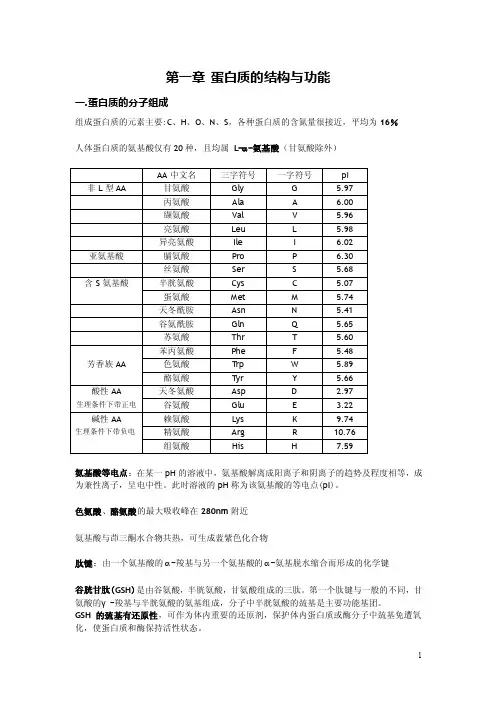
第一章蛋白质的结构与功能一.蛋白质的分子组成组成蛋白质的元素主要:C、H、O、N、S,各种蛋白质的含氮量很接近,平均为16%人体蛋白质的氨基酸仅有20种,且均属L-α-氨基酸(甘氨酸除外)氨基酸等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH称为该氨基酸的等电点(pI)。
色氨酸、酪氨酸的最大吸收峰在280nm附近氨基酸与茚三酮水合物共热,可生成蓝紫色化合物肽键:由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键谷胱甘肽(GSH)是由谷氨酸,半胱氨酸,甘氨酸组成的三肽。
第一个肽键与一般的不同,甘氨酸的γ-羧基与半胱氨酸的氨基组成,分子中半胱氨酸的巯基是主要功能基团。
GSH的巯基有还原性,可作为体内重要的还原剂,保护体内蛋白质或酶分子中巯基免遭氧化,使蛋白质和酶保持活性状态。
二.蛋白质的分子结构α-螺旋的结构特点:1.多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋2.主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合3.相邻两圈螺旋之间借肽键中C=O和NH形成许多链内氢健,这是稳定α-螺旋的主要键4.肽链中氨基酸侧链R分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成基团影响α-螺旋的稳定性包括以下三个方面:1.酸性或碱性氨基酸集中区域(两种电荷相互排斥)2.脯氨酸不利于α-螺旋的形成3.较大R基团侧链集中区域(空间位阻效应)β-折叠要点:1.是肽链相当伸展的结构,肽链平面之间折叠成锯齿状2.依靠两条肽链或一条肽链内的两段肽链间的C=O与H形成氢键,使构象稳定3.氨基酸残基的R侧链伸出在锯齿的上方或下方4.两段肽链可以是平行的,也可以是反平行的超二级结构有三种基本形式:1.α-螺旋组合(αα)2.β-折叠组合(ββ)3.α-螺旋β-折叠组合(βαβ)三.蛋白质结构与功能的关系镰刀形红细胞贫血:血红蛋白有2个α亚基和2个β亚基组成,其中β亚基的第六个氨基酸谷氨酸突变成缬氨酸。


第一章蛋白质的结构与功能一级结构:指多肽链中氨基酸的排列顺序,即它的化学结构。
二级结构:指借助主链(不包括侧链)的氢键形成的具有周期性的构象。
三级结构:指1条肽链(包括主链和侧链)完整折叠而形成的构象。
四级结构:指含有多条肽链的寡聚蛋白质分子中各亚基间相互作用,形成的构象。
超二级结构和结构域是在蛋白质二级和三级结构之间的两个层次。
超二级结构:指相邻的二级结构单元,在侧链基团次级键的作用下彼此靠近而形成的规则的聚集结构。
结构域:指在1条肽链内折叠成的局部结构紧密的区域。
组成四级结构的多肽链称为蛋白质的亚基,多个亚基组成的蛋白质为寡聚蛋白质1 维持蛋白质分子构象的作用力,主要包括氢键、疏水性相互作用、范德华引力、离子键和二硫键。
2 二级结构主要包括下面几种基本类型 (一) α—螺旋 (二)β折叠(三)转角 (四) β突起 (五)卷曲 (六)无序结构3 β折叠有两种类型,1种是平行式,1种是反平行式。
反平行折叠在能量上更稳定。
4 转角主要分两类:β转角和γ转角。
转角结构通常负责各种二级结构单元之间的连接作用。
5 常见的3种超二级结构单元为:αα ββ,βαβ。
6 结构域不仅仅是折叠单位和有一定功能的结构单位,还是一个遗传单位7结构域可以分为4种类型:反平行α,平行α/β,反平行β,不规则的小结构1、多肽链的折叠过程天然蛋白质是多肽链合成后经折叠而形成的热力学上稳定的构象。
多肽链的折叠是一自发过程..人们现已提出了一些多肽链的折叠模型,大致可以分为二类。
一种模型认为多肽链的折叠是逐步进行的,先形成一种稳定的二级结构作为核心,然后二级结构的氨基酸侧链进一步发生交互作用,扩大成天然三维结构;另一种模型提出,多肽链可能由于其疏水侧链的疏水交互作用而突然自发折叠,形成一种含二级结构的紧密状态,最后调整成天然结构。
这两种模型看来不是排斥的,有些多肽链的折叠可能以其中之一为主,有些多肽链的折叠兼而有之。
在这两种情况下,超二级结构的形成都可能起着导引作用,弱键则做最后的热力学上的调整。
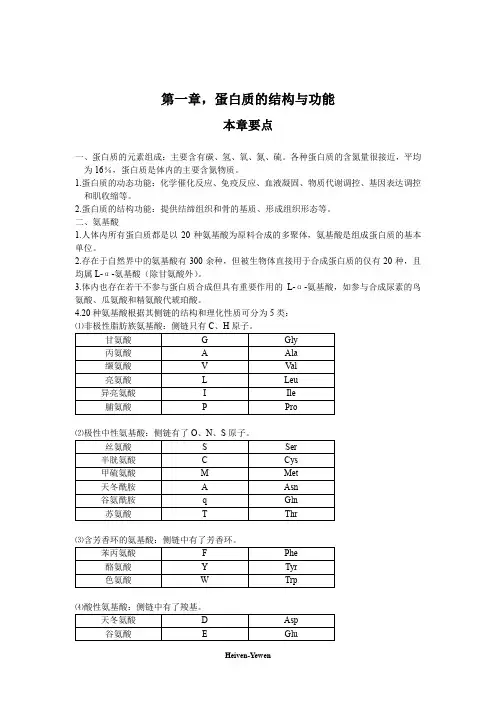
第一章,蛋白质的结构与功能本章要点一、蛋白质的元素组成:主要含有碳、氢、氧、氮、硫。
各种蛋白质的含氮量很接近,平均为16%,蛋白质是体内的主要含氮物质。
1.蛋白质的动态功能:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控和肌收缩等。
2.蛋白质的结构功能:提供结缔组织和骨的基质、形成组织形态等。
二、氨基酸1.人体内所有蛋白质都是以20种氨基酸为原料合成的多聚体,氨基酸是组成蛋白质的基本单位。
2.存在于自然界中的氨基酸有300余种,但被生物体直接用于合成蛋白质的仅有20种,且均属L-α-氨基酸(除甘氨酸外)。
3.体内也存在若干不参与蛋白质合成但具有重要作用的L-α-氨基酸,如参与合成尿素的鸟氨酸、瓜氨酸和精氨酸代琥珀酸。
4.20种氨基酸根据其侧链的结构和理化性质可分为5类:⑴非极性脂肪族氨基酸:侧链只有C、H原子。
⑶含芳香环的氨基酸:侧链中有了芳香环。
⑷酸性氨基酸:侧链中有了羧基。
芳香族氨基酸中苯基的疏水性较强,酚基和吲哚基在一定条件下可解离;酸性氨基酸的侧链都含有羧基;而碱性氨基酸的侧链分别含有氨基、胍基或咪唑基。
5.20种氨基酸具有共同或特异的理化性质:⑴氨基酸具有两性解离的性质。
①所有氨基酸都含有碱性的α-氨基和酸性的α-羧基,可在酸性溶液中与质子(H+)结合呈带正电荷的阳离子(),也可在碱性溶液中与(OH-)结合,失去质子变成带负电荷的阴离子()。
②氨基酸是一种两性电解质,具有两性解离的特性。
③在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
④取兼性离子两边的pK值的平均值,即为此氨基酸的pI值:pI=1/2(pK1+pK2)⑵含共轭双键的氨基酸具有紫外线吸收性质①含有共轭双键的色氨酸、酪氨酸的最大吸收峰在280nm波长附近。
②由于大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。

第一篇蛋白质的结构与功能(第一~四章小结)第一章氨基酸氨基酸是一类同时含有氨基和羧基的有机小分子。
组成多肽和蛋白质的氨基酸除Gly外,都属于L型的α- 氨基酸(Pro为亚氨基酸)。
氨基酸不仅可以作为寡肽、多肽和蛋白质的组成单位或生物活性物质的前体,也可以作为神经递质或糖异生的前体,还能氧化分解产生ATP。
目前已发现蛋白质氨基酸有22种,其中20种最为常见,而硒半胱氨酸和吡咯赖氨酸比较罕见。
非蛋白质氨基酸通常以游离的形式存在,作为代谢的中间物和某些物质的前体,具有特殊的生理功能。
22种标准氨基酸可使用三字母或单字母缩写来表示。
某些标准氨基酸在细胞内会经历一些特殊的修饰成为非标准蛋白质氨基酸。
氨基酸有多种不同的分类方法:根据R基团的化学结构和在pH7时的带电状况,可分为脂肪族氨基酸、不带电荷的极性氨基酸、芳香族氨基酸、带正电荷的极性氨基酸和带负电荷的极性氨基酸;根据R基团对水分子的亲和性,可分为亲水氨基酸和疏水氨基酸;根据对动物的营养价值,可分为必需氨基酸和非必需氨基酸。
氨基酸的性质由其结构决定。
其共性有:缩合反应、手性(Gly除外)、两性解离、具有等电点,以及氨基酸氨基和羧基参与的化学反应,包括与亚硝酸的反应、与甲醛的反应、Sanger反应、与异硫氰酸苯酯的反应和与茚三酮的反应等。
与亚硝酸的反应可用于Van Slyke定氮,与甲醛的反应可用于甲醛滴定,Sanger反应和与异硫氰酸苯酯的反应可用来测定N-端氨基酸。
只有脯氨酸和羟脯氨酸与茚三酮反应产生黄色物质,其余生成蓝紫色物质,利用此反应可对氨基酸进行定性或定量分析。
多数氨基酸的侧链可能发生特殊的反应,可以此鉴定氨基酸。
不同氨基酸在物理、化学性质上的差异可用来分离氨基酸,其中最常见的方法是电泳和层析。
第二章蛋白质的结构肽是氨基酸之间以肽键相连的聚合物,它包括寡肽、多肽和蛋白质。
氨基酸是构成肽的基本单位。
线形肽链都含有N端和C端,书写一条肽链的序列总是从N端到C端。




第一章蛋白质的结构与功能名词解释1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
2.蛋白质的等电点:蛋白质分子净电荷为零时溶液的pH值称为该蛋白质的等电点。
3.模体:在许多蛋白质分子中,二个或三个具有二级结构的肽段,在空间上相互接近,形成一个特殊的空间构象,具有特殊功能,称为模体。
4.蛋白质变性:在某些物理和化学因素作用下,蛋白质特定的空间构象被破坏,变成无序的空间结构,导致其理化性质改变和生物活性丧失。
5.电泳:指带电荷的溶质或粒子在电场中向着与其本身所带电荷相反的电极移动的现象。
问答题1. 举例说明蛋白质一级结构与功能的关系1)一级结构是空间结构的基础例:经变性后又复性的核糖核酸酶分子中二硫键的配对方式与天然分子相同。
说明蛋白质一级结构是其高级结构形成的基础和决定性的因素。
2)一级结构与功能(1)一级结构相似的多肽或蛋白质,其空间结构、功能亦相似。
如哺乳动物的胰岛素分子等。
(2)有些蛋白质分子中起关键作用的氨基酸残基缺失或被替代都会影响空间构象及生理功能。
如镰刀型血红蛋白贫血病。
2.蛋白质的α—螺旋结构有何特点?①以肽键平面为单位,右手螺旋;②每螺旋圈3.6个氨基酸残基,螺距0.54nm ;③氢键保持螺旋结构的稳定,氢键的方向与螺旋长轴基本平行;④氨基酸侧链伸向螺旋外侧,并影响α螺旋的形成和稳定。
4.蛋白质变性的机制、对理化性质的影响。
在某些物理和化学因素作用下,其特定的空间构象被破坏,变成无序的空间结构,导致其理化性质改变和生物活性丧失。
如加热、乙醇等有机溶剂、强酸、强碱、重金属离子及生物碱试剂等,本质为破坏非共价键和二硫键,不改变蛋白质的一级结构。
举例:临床医学上,变性因素常被应用来消毒及灭菌。
此外, 防止蛋白质变性也是有效保存蛋白质制剂(如疫苗等)的必要条件。
第二章核酸的结构与功能名词解释1 、DNA变性:在某些理化因素作用下,DNA双链解开成两条单链的过程叫DNA 的变性。
第一章蛋白质的结构与功能蛋白质组成元素的特点;基本结构单位-----氨基酸(识记)P4肽键:(识记)P7是由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的化合键多肽链:(识记)P7肽链分子中的氨基酸相互衍接,形成的长链,称为多肽链一级结构:(识记)P8是指蛋白质多肽链中从N-端至C-端的氨基酸排列顺序.主要化学键为肽键二级结构:(识记)P8是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
主要的化学键是氢键---主要有α-螺旋、β-折叠、β-转角、无规卷曲等多种形式。
三级结构:(识记)P10整条肽链中全部氨基酸残基的相对空间位置。
即肽链中所有原子在三维空间的排布位置。
四级结构:(识记)P11蛋白质的四级结构是指由多条亚基通过非共价键(主要是氢键和离子键)连接起来的结构形式。
蛋白质是生命物质的重要基础、蛋白质的重要生理工功能(领会)P131、作为生物催化剂(酶)2、代谢调节作用3、免疫保护作用4、物质的转运和存储5、运动与支持作用6、参于细胞间的信息传递蛋白质的二级结构:a-螺旋、β-折叠(应用)P9a-螺旋特点:⑴为一右手螺旋;⑵螺旋每圈包含3.6个氨基酸残基,螺距为0.54 nm;⑶螺旋以氢键维系(第1个aa的NH与第4个aa的 CO 形成氢键),氢键是稳定α-螺旋的主要化学键β-折叠特点1、多肽链充分伸展,肽链主链呈锯齿状折叠构象。
2、Cα总是处于折叠的角上(以Cα为旋转点)3、AA的R基团交替处于锯齿状结构的上下方并与之垂直4、氢键是稳定β-折叠的主要化学键空间结构与功能关系(识记)P14空间结构是蛋白质正确发挥生物学功能的基础一级结构与功能关系(应用)P14(一)一级结构是空间构象和功能的基础蛋白质特定的空间结构是以氨基酸顺序为基础的。
(二)一级结构相似的多肽或蛋白质,其空间构象以及功能也相似(三)一级结构可提供重要的生物进化信息(四)重要蛋白质的氨基酸序列改变可引起疾病蛋白质分子中起关键作用的氨基酸残基缺失或被替代,都会严重影响空间构象乃至生理功能,如分子病。
第一章蛋白质的结构与功能一名词解释别构效应别构效应又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,导致蛋白质生物活性改变的现象。
蛋白质变性由于稳定蛋白质构象的化学键被破坏,造成其四级结构、三级结构甚至二级结构被破坏,导致其天然构象部分或完全破坏,理化性质改变,活性丧失。
等电点在某一PH的溶液中,氨基酸解离成阳离子和阴离子的程度和趋势相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
氨基酸残基:肽键中的氨基酸分子因脱水缩合而基团不全被称为氨基酸残基。
亚基在体内有许多蛋白质含有2条或2条以上多肽链,才能全面地执行功能.没一条多肽链都有其完完整的三级结构,称为亚基(subunit)。
二蛋白质平均含氮量是多少?有何意义?蛋白质的元素组成为C,H,O,N,S等含氮量为16% 其意义是蛋白质含量=含氮量/16%=含氮量*6.25三如何对氨基酸进行分类?氨基酸根据理化性质分为非极性脂肪族氨基酸极性中性氨基酸碱性侧链氨基酸(精氨酸,赖氨酸,组氨酸)酸性侧链氨基酸(天冬氨酸,谷氨酸)芳香族氨基酸(苯丙氨酸,酪氨酸,色氨酸)四何谓蛋白质一至四级结构?维持其稳定的化学键分别是什么?蛋白质分子的一级结构:蛋白质分子中,从N-端到C-端的氨基酸排列顺序氢键和二硫键蛋白质分子的二级结构:指蛋白质分子中某一肽链的局部主链空间结构。
氢键上下两册一个氨基酸残基的C=O与第四个残基的N-H之间形成氢键,从而使结构稳定蛋白质的三级结构:指整条肽链中全部氨基酸残基的相对空间位置。
疏水键,离子键,氢键,van der waals力蛋白质的四级结构:亚基与亚基之间呈特定的三维空间分布,并以非共价键相链接,这种蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
在体内有许多蛋白质含有2条或2条以上多肽链,才能全面地执行功能.没一条多肽链都有其完完整的三级结构,称为亚基(subunit)。
氢键盐键五举例论证蛋白质结构和功能之间有何关系?蛋白质的一级结构是高级结构与功能的基础1一级结构是空间构象的基础蛋白质以及结构决定蛋白质的空间结构或构象,蛋白质的空间结构或构想决定蛋白质的功能由于血红蛋白分子的构象可以发生一定程度的变化,从而影响了血红蛋白与氧的结合能力。