一
二
三
键长越短,往往键能越大,共价键越稳定。
4.F—F键键长短,键能小的解释: 以下各组微粒结构不相似的是( )
F原子的半径很小,因此其键长短,而由于键长短,两F原子形成共价键时,原子核之间的距离很近,排斥力很大,因此键能小,F2的稳定性差,很
容水易分与 子其可他表物示F质为原反H—子应O。—的H,分半子中径键角很为1小80°,因此其键长短,而由于键长短,两F原子形成共 【分常例子见题 中 等1键电价】能子下越体键列大(推说时,键广法长到中,越原离正短子确子,)则:的分是核子( 越之稳) 定间的距离很近,排斥力很大,因此键能小,F2的稳定 性差,很容易与其他物质反应。 H—O键键能为463 kJ·mol-1,即18 g水分解生成H2和O2时,放出能量为(2×463)kJ
(只2)有键非长金不属是原(成2子键)之两键间原才长子能的不形原成子是共半价径成键之和键,而两是小原于其子半径的之和原。子半径之和,而是小于其半径之和。 (3)一般键能越大,键长越短,分子越稳定。 反应物和生成物中化学键的强弱决定着化学反应过程中的能量变化。
键能与键长是衡量共价键稳定性的参数,键角是描述分子立体结构的参数。
分子 熔点/℃
沸点/℃
在水中的溶 解度(室温)
CO -205.05 -191.49 2.3 mL
N2 -210.00 -195.81 1.6 mL
分子解离能 分子的价
(kJ·mol-1) 电子总数
1 075
10
946
10
一
二
三
一、键参数与分子性质
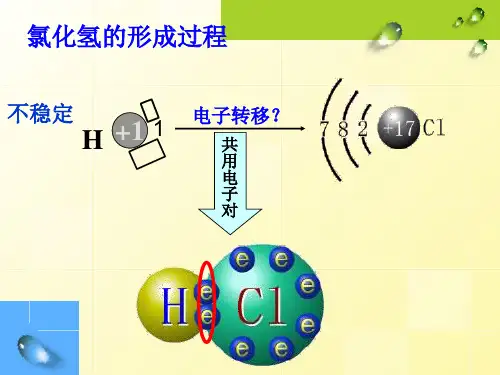
1.一般来讲,形成共价键的两原子半径之和越小,共用电子对数越 多,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、 HBr、HI,分子中的共用电子对数相同,因F、Cl、Br、I的原子半径 依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定 性HF>HCl>HBr>HI。
![(新)人教版《共价键》优质PPT课件[2]](https://uimg.taocdn.com/c9a86e68a36925c52cc58bd63186bceb19e8ed7c.webp)