2012学年第一学期徐汇区高三化学试卷_4
- 格式:doc
- 大小:491.00 KB
- 文档页数:7

2012年普通高等学校招生统一考试理科综合能力测试试题可能用到的相对原子质量:H l C l2 N 14 O 16 Mg 24 S 32 C1 35 5 Fe 56 Cu 64 Zn 65 Br 80一、选择题:本大题共13小题.每小题6分。
在每小题给出的四个选顼中,只有一项是符合题目要求的。
7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+答案:A解析:此题为基础题,B答案在考前多个试题里面都出现过,因为除了氯气外,其它的如臭氧都可以将其氧化得到碘单质。
C答案应该是碘单质,D答案不能排除硫酸根的干扰。
8.下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转变为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料答案:B答案解析:此题为基础题。
A答案应该为75%,C中油脂不为高分子化合物,这个选项也在考前多个试题里出现D答案光导纤维为二氧化硅,合成纤维为有机材料,这个选项多个试题也出现,从前面两个题看来,还是没什么创新,或者考前已经被很多老师抓住题了。
9.用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 N A答案:D解析:此题为基础题,尤其C选项平时学生练习过多次,估计每位参加高考的学生至少做个3-4次。
D选项因为是常温常压下,气体的体积与状态有关系。

上海市徐汇区2012届高三4月学习能力诊断试卷化学(满分150分,时间120分钟) 2012.04本卷可能用到的相对平均原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 I-127 Na-23 Mn-55 Cu-64第Ⅰ卷 (共66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)。
1.三层复合石头纸是一种新型纸张,其结构如右图所示:上下两层为聚乙烯,中间层为碳酸钙。
下列关于它的叙述错误的是A .易生物降解B .可替代木浆纸以减少树木砍伐C .与普通纸相比难以燃烧D .具有防水防油的特性2.日本福岛地震发生核泄漏后,许多地区检测到微量放射性物质,如137Cs 、134Cs 、131I 。
下列叙述正确的是A .13455s C 和13755s C 形成的单质物理性质相同B .13455sC 比13153I 多3个中子C .13455s C 和13755s C 形成的单质化学性质相同 D .13455s C 和13755s C 都是铯的同素异形体3.药皂具有杀菌、消毒作用,通常是因为在普通肥皂中加入了适量的A .酒精B .次氯酸C .甲苯酚D .过氧化钠4.二氧化碳在大气中含量增大是产生温室效应的主要原因。
下列反应中不属于自然界缓解温室效应的是A .CO 2 +H 2O →H 2CO 3B .6nCO 2 +5nH 2O −−−→光叶绿素 (C 6H 10O 5)n (淀粉)+6nO 2 C .CaCO 3 + CO 2 +H 2O →Ca(HCO 3)2 D .NH 3 +CO 2 +H 2O+NaCl →NaHCO 3↓+NH 4Cl 5.黑火药爆炸后产物为K 2S 、N 2、CO 2 ,下列物质中为黑火药主要成分且做还原剂的是A .氧气B .木炭C .硫磺D .硝酸钾 二、选择题(本题共36分,每小题3分,只有一个正确选项)。
6.用下列各组试剂分离FeCl 3和AlCl 3两种物质的混合物,其中可以达到目的的是A .氨水和盐酸B .氢氧化钠和二氧化碳C .氢氧化钠和盐酸D .氨水和二氧化碳7.除去下列物质中少量杂质采用的方法与制取无水乙醇的方法相同的是A .己烷(杂质为己烯)B .乙醇(杂质为乙酸)C .硝基苯(杂质为苯)D .苯(杂质为甲苯)8.设N A 为阿伏加德罗常数的值。

Module 9 English for you and me Unit 2 We all own English. 1. own v. 拥有 2. everyday adj. 每天的;日常的 3. tourism n. 旅游业 4. quartern. 四分之一 5. recent adj. 近来的 6. typhoon n. 台风 7. importance n. 重要性 8. in place of 代替 9. Indian n. 印度人Lead in Which language do you think is the most widely used language in the world? Do you know? English Presentation Work in pairs. Answer the questions. How many people in the world speak English? 2. When did English become an international language? About 400 million. In the 20th century. Reading 3. Why did English become so popular? 4. When will Chinese become an international language? 5. Who owns English? In the 18th century, the UK’s industrial products were sold all over the world. In the 20th century, the USA spread English all over the world through newspapers, television, films and advertising. By the middle of the 21st century. Everyone who speaks it. 1. In a country like India, English is _______. a)not taught in school b)spoken by everyone c)the most important foreign language d)not the language everyone speaks at home 2. English became more common because __________. a)? of the growth of the UK b)? it’s an easy language to learn c)?it was usedin television, films and the Internet d)? it was sold like an industrial product Choose the best answer. Reading 3. English has many words which ___________. a) are difficult to rememberb)?first came from other languages c)look as if they come from another language d) are important to remember 4. In the middle of the twenty-first century, Chinese______. a)?may replace English as an international language b)?will be taught in all schools as a foreign language c)?will be used as widely as English d)?won’t be used as widely as English Talk about your answers to the questions. 1. What do you want to use English for? I want to use English for reading English newspapers and communicating with foreigners. 合作探究 2. Do you know any Chinese words from English? Give some examples. Yes, I do. For example, sofa—沙发,coffee—咖啡,miniskirt —迷你裙. 3. Do you agree that Chinese will one day replace English? Maybe. If China continues to grow in importance, Chinese will become as common as English by the middle of the 21st century. Phrases in this unit. 1. It’s essential for 对……至关重要 2. a quarter of四分之一的 3. give help with 给予帮助 4. The reason is that 原因是5. borrow sth. from… 从……借某物 6. either … or … 或者……或者…… 7. in importance 在重要性方面 8. in place of 代替 9. put … into …把……变成…… 10. belong to 属于 What’s more, English spelling…这里What’s more表示“并且,更有甚者”, 常常用于对刚说过的话作进一步补充。

2012年全国普通高等学校招生统一考试上海化学试卷相对原子质量:H-1 C-12N-14 O-16Na-23 Si一28Cl-35.5 K-39Cu-64 Se-79一、选择题(本题共10分,每小题2分,每题只有一个正确选项)1.今年3月修订的《环境空气质量标准》中新纳入的强制监测指标是A.PM2.5B.NOx C.SO2 D.可吸入颗粒物2.下列关于化石燃料的加工说法正确的是A.石油裂化主要得到乙烯B.石油分馏是化学变化,可得到汽油、煤油C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径3.氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是A.AlON和石英的化学键类型相同B.AlON和石英晶体类型相同C.AlON和Al2O3的化学键类型不同D.AlON和Al2O3晶体类型相同4.PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。
下列判断错误的是A.PH3分子呈三角锥形B.PH3分子是极性分子C.PH3沸点低于NH3沸点,因为P-H键键能低D.PH3分子稳定性低于NH3分子,因为N-H键键能高5.和氢硫酸反应不能产生沉淀的是A.Pb(NO3)2溶液B.Na2S洛液C.CuSO4溶液D.H2SO4溶液二、选择题(本题共36分,每小题3分,每题只有一个正确选项)6.元素周期表中铋元素的数据见右图,下列说法正确的是A.Bi元素的质量数是209B.Bi元素的相对原子质量是209.0C.Bi原子6p亚层有一个未成对电子D.Bi原子最外层有5个能量相同的电子7.水中加入下列溶液对水的电离平衡不产生影响的是A.NaHSO4溶液B.KF溶液 C.KAl(SO4)2溶液 D.NaI溶液8.过量的下列溶液与水杨酸()反应能得到化学式为C7H5O3Na的是A.NaHCO3溶液 B.Na2CO3溶液C.NaOH溶液 D.NaCl溶液9.工业生产水煤气的反应为:C(s)+H2O(g)→CO(g)+H2(g)-131.4 kJ,下列判断正确的是A.反应物能量总和大于生成物能量总和B.CO(g)+H2(g)→C(s)+H2O(g)+131.4kJC.水煤气反应中生成1 mol H2(g)吸收131.4KJ热量D.水煤气反应中生成1体积CO(g)吸收131.4 KJ热量10.用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是A.试样中加入酚酞作指示剂,用标准酸液进行滴定B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定C.锥形瓶用蒸馏水洗涤后,壹接加入待测溶液进行滴定D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定ll.工业上将氨气和空气的混合气体通过铂一铑合金网发生氨氧化反应,若有标准状况下VL氨气完全反应。

2012学年第一学期高三化学学科期末试卷(120分钟完卷,满分150分)本试卷分为第I卷和第II卷两部分可能用到的相对原子质量: H–1 C–12 N–14 O-16 Na–23 Mg–24 Cl–35.5 S–32 Fe–56 Cu–64 Ba–137 Al–27第I卷(共66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)1. 水是一种战略性经济资源,下列物质对水质不会产生严重污染的是A.CH3OH B.SO2 C.HgCl2 D.CO22. 据报道,用10B合成的10B20有非常好的抗癌效果。
下列叙述正确的是A.10B和10B20互为同素异形体B.B元素的质量数是10C.10B的中子数和核外电子数相等 D.10B20晶体熔点高、硬度大3. 下列固体物质中阴阳离子的个数比不是1:1的是A.NaHCO3 B.Na2O2 C.NaOH D.CaC24. 在多电子原子中,轨道能量是由以下哪些因素决定①电子层②电子亚层③电子云的伸展方向④电子自旋状态A.①② B.①④ C.②③ D.③④5.钢铁防腐方法有许多种,右图是其中的一种方法,描述正确的是A.右图所示是牺牲阳极阴极保护法B.a为电源正极C.电子流向:a→铁闸门,辅助电极→bD.辅助电极上的反应:O2+2H2O+4e→4OH -二、选择题(本题共36分,每小题3分,只有一个正确选项)6. 化学式为C4H10O的物质中,能与Na反应的同分异构体共有A.2种 B.3种 C.4种 D.5种7. 用右图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是A.向亚硫酸钠溶液中通入氯气B.向硝酸银溶液中通入少量氯化氢C.向氢碘酸饱和溶液中通入少量氧气D.向氢氧化钠溶液中通入少量氯气8.铁铝矾[Al2Fe(SO4)4·x H2O] 有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是A.该溶液显中性B.该溶液中:2 c(Al3+)+c(Fe2+)+c(H+)= 4 c(SO42-)+ c(OH-)C.在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3D.向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀9.下列图像表达正确的是10. N A表示阿伏伽德罗常数,某氯气样品由37Cl2分子组成,下列说法正确的是A.37g该氯气样品含N A个氯气分子B.11.2L该氯气样品质量是37gC.37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1D.0.1N A个氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)=0.2mol/L11. 下列除杂操作正确的是物质杂质试剂提纯方法A.苯苯酚溴水分液B.二氧化碳二氧化硫饱和碳酸钠溶液洗气C.甲烷乙烯酸性高锰酸钾溶液洗气D.甲醛甲酸稀氢氧化钠溶液蒸馏12. 反应 H2(g)+C12(g) → 2HCl(g)的能量变化可用下图表示。
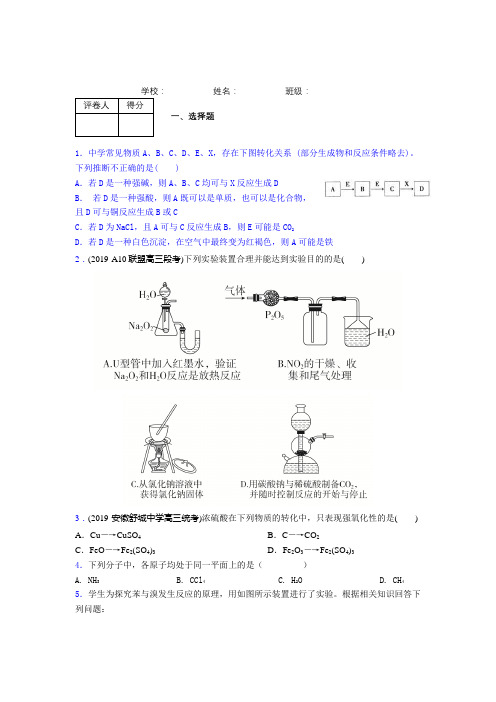
__________ 姓名:__________ 班级:__________评卷人得分一、选择题1.中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。
下列推断不正确的是( )A.若D是一种强碱,则A、B、C均可与X反应生成DB.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或CC.若D为NaCl,且A可与C反应生成B,则E可能是CO2D.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁2.(2019·A10联盟高三段考)下列实验装置合理并能达到实验目的的是()3.(2019·安徽舒城中学高三统考)浓硫酸在下列物质的转化中,只表现强氧化性的是() A.Cu―→CuSO4B.C―→CO2C.FeO―→Fe2(SO4)3D.Fe2O3―→Fe2(SO4)34.下列分子中,各原子均处于同一平面上的是()A. NH3B. CCl4C. H2OD. CH4 5.学生为探究苯与溴发生反应的原理,用如图所示装置进行了实验。
根据相关知识回答下列问题:(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。
过一会儿,在装置Ⅲ中可能观察到的现象是______________________________________。
(2)整套实验装置中能防止倒吸的装置有___________________________(填装置序号)。
(3)写出装置Ⅱ中发生反应的化学方程式:_____________________________________。
(4)本实验能不能用溴水代替液溴?___________________________________________。
(5)采用冷凝装置,其作用是_________________________________________________。
(6)Ⅲ装置中小试管内苯的作用是_____________________________________________。
2.爱迪生自幼就爱“打破砂锅问到底”,从“鸡为什么把蛋放在屁股底下、蛋也怕着凉”等问题一直追问到“把蛋放在屁股底下暖和暖和就能孵出鸡娃娃吗?”至此还不满足,他还亲自做了个窝,一本正经地蹲在上面孵小鸡。
没有强烈的好奇心的驱使,爱迪生是不会有此举动的。
生活中,好奇心要意味着成功,就必须( )。
A.把好奇转化为兴趣,进而发展为志趣 B.大胆设想、锲而不舍 C.只要有好奇心就可以,不需要去努力 D.要善于从好奇的现象中探幽寻胜,从而打开成功的大门 3.关于第三次科技革命,下列说法正确的有( )。
A.第三次科技革命兴起于20世纪40—50年代 B.主要标志是电子计算机、原子能和空间科学技术的发明和应用 C.人类由此进入电子原子时代D.第三次科技革命也称工业革命 4.只有初中学历的许振超,是青岛港集团有限公司一名普通的桥吊队长。
30年来,他不断学习新知识,钻研新技术,紧跟当代产业技术飞速发展的步伐,成为一流的桥吊专家。
他创造了世界一流的装卸效率,连续刷新集装箱单箱装卸作业效率的世界记录,为我国集装箱运输的发展做出了突出的贡献。
他说过这样一句话:“人可以没文凭,但不可以没知识。
”这说明( ) A.知识是创新的前提 B.创新可以有捷径 C.只有当知识积累到一定量的时候,灵感才可能在某一外界因素的刺激下迸发 D.我们知识越丰富,将来创新的机会就越多 5.要让创新思维闪光,正确认识的有( )。
A.创新的火花不会凭空而来 B.善于观察、见微知著,是产生创新思维的重要前提 C.在我们生活中到处都隐藏着秘密 D.发现不是某些人的专利 二、单项选择题 1.A 2.B 3.D 4.B 5.A 三、不定项选择题 1.ABCD 2.ABD 3.ABC 4.ACD 5.ABCD 作业: 1、记住原理并整理好原理集 2、基础训练P54的自主检测 阅读感悟 有一名初中女学生,有一次考试中不小心将铅笔芯弄断,耽误了测验时间,影响了成绩。
【试卷总评】2012年上海高考化学卷,重点化学试题立足基础,注重能力考查。
试卷坚持对化学基础知识和基本技能的考查,所涉及的化学基本概念、基础理论、元素化合物、有机化合物、化学实验、化学计算等内容,注重基础知识与学科能力的有机结合,涉及环境监测、绿色化学、能源和能量和新材料等相关背景,注重化学与社会热点、工农业生产、科技新成就和日常生活等问题相结合,力图使试题有较好的区分度,以及从文字、图表等情景资料中获取信息的化学思维能力的考查。
试卷难度适中,注重梯度分布,贴近考生平时的学习和训练,有利于正常水平的发挥。
【试题解析】一、选择题(本题共10分,每小题2分,每题只有一个正确选项)1.今年3月修订的《环境空气质量标准》中新纳入的强制监测指标是A.PM2.5 B.NO x C.SO2D.可吸入颗粒物2.下列关于化石燃料的加工说法正确的是A.石油裂化主要得到乙烯B.石油分馏是化学变化,可得到汽油、煤油C.煤干馏主要得到焦炭、攥焦油、粗氨水和焦炉气D.煤制煤气是物理变化,是高效、清洁地利用煤的直要途径【答案】C【解析】石油裂化的目的是得到液体轻质燃料,A错;石油的分馏是物理变化;煤的气化是物理变化。
【考点定位】本题考查煤、石油的综合利用。
3.氮氧化铝(AION)属原于晶体,是一种超强透明材料.下列描述错误的是A.AlON和石英的化学键类型相同B.AlON和石英晶体类型相同C.AlON和Al2O3的化学键类型不同D.AlON和Al2O3晶体类型相同4.PH3是一种无色剧毒气体,其分于结构和NH3相似,但P-H键键能比N—H键键能低。
下列判断错误的是A.PH3分子呈三角锥形B.PH3分子是极性分子C.PH3沸点低于NH3沸点,因为P-H键键能低D.PH3分子稳定性低于NH3分子,因为N-H键键能高【答案】C【解析】从上到下,同一主族元素形成的气态氢化物的稳定性越来越弱,对应的化学键越来越强,沸点越来越低,C错。
上海市十二校2012-2013学年第一学期高三化学考试试卷命题:曙光中学金秀红审题顾武权2012年12月相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 V-51 Cr-52 Mn-55 Fe-56 Ba-137第Ⅰ卷(66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)1、调查发现,经过装修的居室中由装修材料缓慢释放出来的化学污染物浓度过高,会影响健康。
这些污染物中最常见的是A.甲醛B.一氧化碳C.二氧化硫D.臭氧2、下列各组物质按混合物、纯净物、弱电解质分类正确的是A.铝热剂、液氯、苯酚B.苦卤、氢氧化铝胶体、氨水C.漂白精、盐酸、碳酸氢钠D.纯碱、醋酸、硫酸钡3、下列获取物质的方法,不正确的是A.用电石和饱和食盐水制取乙炔B.通过石油分馏得到甲烷、乙烯和苯C.用碳酸钠和氢氧化钙反应制氢氧化钠D.将氯气通入氢氧化钠溶液得到漂白液4、下列各给物质中,所含化学键类型完全相同,晶体类型也相同的是A.CO2和H2O B.NaOH和Na2OC.NaC1和HC1 D.SO2和SiO25、双氧水是二元弱酸,则下列有关化学用语使用正确的是A.HO2的电子式:B.双氧水的电离方程式为H2O2H+ + HO2—C.16O22—离子中,质量数之和是电子数之和的两倍D.将双氧水溶液加热升温后,溶液pH一定减小二、选择题(本题共36分,每小题3分,只有一个正确选项)6、化学在生产和日常生活中有着重要的应用。
下列说法不正确的是A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率C.MgO的熔点很高,可用于制作耐高温材料MgCl饱和溶液,可制得金属镁D.电解27、下列各组物质中,每种物质都能被氧化又能被还原的是A. F2、Cl2、CuSO4B. Cl2、Al、H2C. H2S、HCl、H2O2D. F2、K、HCl8、下列推断正确的是A.SiO2是酸性氧化物,能与NaOH溶液反应B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色9、在下列各溶液中,离子一定能大量共存的是A.pH=1的溶液中:HCO3—、NH4+、NO3—、Ca2+B.在强碱性溶液中:Na+、K+、AlO2—、Cl—C.无色溶液中:Fe3+、MnO4—、Cl—、H+D.由水电离出的c(H+)=10—12 mol/L的溶液中:ClO—、Na+、SO32—、K+10、下列叙述正确的是A.1.00mol NaCl中含有6.02×1023个NaCl分子B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023C.欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠11、能正确表示下列反应的离子方程式为A. 硫化亚铁溶于稀硝酸中:FeS+2H+→Fe2++H2S↑B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-→CO32-+H2OC. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O→C6H5OH+HSO3-D. 大理石溶于醋酸中:CaCO3+2CH3COOH→Ca2++2CH3COO-+CO2↑+H2O12.将0.4g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。
2012学年第一学期徐汇区高三化学试卷(满分150分,时间120分钟)2013.1说明:本卷分试题卷与答题卷两部分,请将正确答案写在答题卷上,写在试题卷上一律不给分。
本卷可能用到的相对平均原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Cu-64第I卷(共66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)。
1.下列有关甲醛的化学用语表达错误的是A.结构简式:HCHO B.最简式:CH2OC.比例模型: D.电子式:2.下列有关物质性质和应用的因果关系正确的是A.二氧化锰具有强氧化性,能将双氧水氧化为氧气B.浓硫酸具有较强酸性,能使Cu转化为Cu2+C.炭具有还原性,一定条件下能将二氧化硅还原为硅D.二氧化硫具有漂白性,所以与氯水混合使用效果更好3.下列物质的制备,符合工业生产实际的是A.电解饱和氯化钠溶液制备金属钠B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸D.将SO2和O2的混合气加压后,通过接触室制备SO34、用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是A.NaF B.NaCl C.NaBr D.NaI5.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。
常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。
下列说法错误的是A.S2Cl2的结构式为Cl-S-S-ClB.若S2Br2与S2Cl2结构相似,则熔沸点:S2Br2>S2Cl2C.S2Cl2为含有极性键和非极性键的非极性分子D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 + 2H2O →SO2↑ + 3S↓ + 4HCl二.选择题(本题共36分,每小题3分,只有一个正确选项)。
6.某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是A.HCO3-B.SO42-C.SO32-D.OH- 7.下列叙述错误的是OOOCH 3HOH 3CO OOOHHO H 3COHI异秦皮啶 秦皮素A .硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解B .乙醇的沸点比甲醚(CH 3—O —CH 3)高,主要原因是乙醇分子间作用力更大C .反应AgCl + Br - → AgBr + Cl -能在水溶液中进行,是因为AgBr 比AgCl 更难溶于水D .常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 8.已知NaCN 溶液呈碱性;(CN)2与卤素单质的性质相似;CN -的还原性介于Br -、I -之间。
2012学年第一学期徐汇区高三化学试卷(满分150分,时间120分钟)2013.1说明:本卷分试题卷与答题卷两部分,请将正确答案写在答题卷上,写在试题卷上一律不给分。
本卷可能用到的相对平均原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Cu-64第I卷(共66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)。
1.下列有关甲醛的化学用语表达错误的是A.结构简式:HCHO B.最简式:CH2OC.比例模型: D.电子式:2.下列有关物质性质和应用的因果关系正确的是A.二氧化锰具有强氧化性,能将双氧水氧化为氧气B.浓硫酸具有较强酸性,能使Cu转化为Cu2+C.炭具有还原性,一定条件下能将二氧化硅还原为硅D.二氧化硫具有漂白性,所以与氯水混合使用效果更好3.下列物质的制备,符合工业生产实际的是A.电解饱和氯化钠溶液制备金属钠B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸D.将SO2和O2的混合气加压后,通过接触室制备SO34、用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是A.NaF B.NaCl C.NaBr D.NaI5.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。
常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。
下列说法错误的是A.S2Cl2的结构式为Cl-S-S-ClB.若S2Br2与S2Cl2结构相似,则熔沸点:S2Br2>S2Cl2C.S2Cl2为含有极性键和非极性键的非极性分子D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 + 2H2O →SO2↑ + 3S↓ + 4HCl二.选择题(本题共36分,每小题3分,只有一个正确选项)。
6.某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是A.HCO3-B.SO42-C.SO32-D.OH-7.下列叙述错误的是A.硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间作用力更大C.反应AgCl + Br-→ AgBr + Cl-能在水溶液中进行,是因为AgBr比AgCl更难溶于水D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应8.已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。
下列变化不能发生的是A.HCN H++CN-B.(CN)2 +CH2=CH2 → NC—CH2—CH2—CNC.(CN)2+2Br-→ 2CN-+Br2 D.(CN)2 +2OH-→ CN-+CNO-+H2O9.将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是①2H2S + O2→ 2S + 2H2O ②2H2S + SO2→ 3S + 2H2O ③2H2S + 3O2→ 2SO2 + 2H2OA.①②③B.③①②C.①③②D.③②①10.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、OOOCH 3HOH 3CO OOOHHO H 3COHI异秦皮啶 秦皮素NO 和HNO 3 。
则下列说法错误的是A .反应过程中,被氧化与被还原的元素的物质的量之比为1:2B .NF 3是一种无色、无臭的气体,因此NF 3在空气中泄漏时不易被察觉C .若反应中转移的电子数目为6.02×1023,则可生成22.4L NO 气体(标准状况)D .一旦NF 3泄漏,可以用石灰水溶液喷淋的方法减少污染 11.某一化学反应在不同条件下的能量变化曲线如右图所示。
下列说法正确的是A .化学催化比酶催化的效果好B .使用不同催化剂可以改变反应的热效应C .使用不同催化剂可以改变反应的能耗D .反应物的总能量低于生成物的总能量 12.异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。
它们在一定条件下可发生转化,如图所示。
有关说法正确的是 A .异秦皮啶与秦皮素互为同系物 B .异秦皮啶分子式为C 11H 12O 5C .秦皮素一定条件下能发生加成反应、消除反应和取代反应D .1mol 秦皮素最多可与2molBr 2、4molNaOH 反应13.从碘的四氯化碳溶液中除去碘以回收四氯化碳,下列操作最简便的是 A .向其中放入过量镁条,反应完毕后取出 B .蒸馏 C .加入能氧化I 2的KMnO 4,再分液 D .通入氯气14.实验装置如右图所示。
下列说法正确的是 A .该装置不能发生原电池反应 B .活性炭是阴极C .总反应为:4Al+3O 2 +6H 2O → 4Al(OH)3D .电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔15.关于下列各实验装置图的叙述中,错误的是A .①可用于分离苯和溴苯的混合物B .①可用于分离乙酸和乙醇的混合物C .②可用于分解NH 4Cl 制备NH 3D .②可用于Ca(OH)2与NH 4Cl 共热制备NH 3 16.硼酸(H 3BO 3)溶液中存在如下反应:H 3BO 3(aq)+H 2O(l) [B(OH)4] –(aq )+H +(aq)。
下列说法一定正确的是 A .碳酸钠溶液滴入硼酸中能观察到有气泡产生 B .醋酸滴入碳酸钠溶液中能观察到有气泡产生 C .等物质的量浓度的碳酸溶液和硼酸溶液比较,pH :前者>后者D .等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH :前者>后者 17.1L 稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L 。
若向该混合溶液中加入足量的铜粉。
则最多能溶解铜粉的质量为 A .2.4 gB .3.2 gC .6.4 gD .9.6 g三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项。
只有一个正确选项的,多选不给分;有两个用浸有铝箔⊿E① ②正确选项的,选对一个给2分,选错一个,该小题不给分。
)18.将氯化铵固体溶解在D2O(重水)中,反应的离子方程式正确的是A.NH4+ + D2O NH3·D2O + H+B.NH4+ + D2O NH3·HDO + D+C.NH4+ + 2D2O NH3·HDO + D3O+D.NH4+ + 2D2O NH3·D2O + HD2O+19.已知2Al+2NaOH+2H2O−→−2NaAlO2+3H2↑。
该反应中有关物理量的描述正确的是(N A表示阿伏加德罗常数)A.每生成0.3 mol H2,被还原的水分子数目为0.6 N AB.当有2.7 g Al参加反应时,转移的电子数目为0.3 N AC.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 N AD.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 N A20.已知NO2遇水发生反应:2NO2 +H2O →HNO2 +HNO3。
实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。
下列说法错误的是A.HNO2非常不稳定,其分解产物为NO和H2OB.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解C.HNO2的酸性弱于碳酸的酸性D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应21.常温下,0.1 mol/L氨水溶液中(H)(OH)cc+-=1×10-8,下列叙述错误的是A.该溶液中氢离子的浓度:c(H+ ) =1×10-9 mol/LB.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+ ) + c(H+ ) =c(Cl- ) + c(OH-)C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+ ) + c(NH3) + c(NH3·H2O) =2c(SO42-)D.浓度均为0.1 mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+ )>c(NH3·H2O) >c(Cl-) >c(OH-) >c(H+ )22.含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。
加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见右表)n(沉淀)n(沉淀)第II卷(共84分)四、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强。
下面是某些短周期元素的x值:23.通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
24.推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
25.分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
26.经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
27.预测元素周期表中,x 值最小的元素位于______周期________族(放射性元素除外)。
五、已知:氧化性:KMnO 4>HNO 3;Bi 位于周期表中V A 族,+3价较稳定,Bi 2O 3为碱性氧化物,Bi 3+的溶液为无色。
取一定量硝酸酸化的Mn(NO 3)2溶液依次进行下列实验,现象记录如下:① 向其中加入适量的NaBiO 3,溶液变为紫红色。
② 继续滴加适量H 2O 2,紫红色褪去,并有气泡产生。
③ 再加入适量的PbO 2固体,固体溶解,溶液又变为紫红色。
回答下列问题:28.写出实验①反应的离子方程式:______________________________________。
29.KMnO 4、H 2O 2、PbO 2氧化性由强到弱的顺序为____________________________。
30.向反应③得到的溶液中通入SO 2气体,看到的现象是____________________________。
31.若实验②放出了336mL 气体(标准状况),则反应①被氧化的Mn(NO 3)2 为________mol 。