第六章化学平衡
- 格式:doc
- 大小:192.50 KB
- 文档页数:5

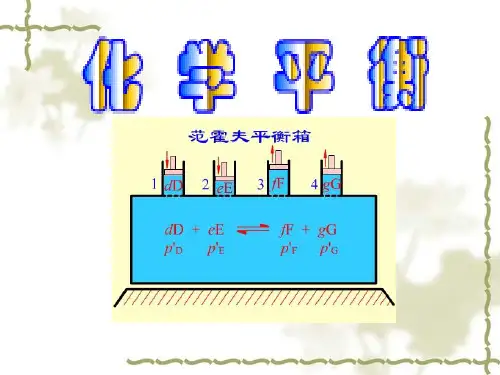





第6章 化学平衡1. 化学平衡: 是指可逆反应在一定条件下,正反应速率等于逆反应速率时,反应体系所处的状态,称为“化学平衡”。
化学平衡是一种动态平衡。
2. 平衡常数: 在一定温度下,可逆反应达到平衡时,产物浓度的方程式计量系数次方乘积与反应物计量系数次方的乘积之比为一常数,称为“平衡常数”.这一规律称为“化学平衡定律”.符号为K 。
3. 经验平衡常数(、)与标准平衡常数c K p K θK()()[]平衡j i c c p p K j i νθνθθ//∏•∏=()∑=νRT K K c p 4.平衡常数的意义: 表示在一定条件下,可逆反应所能进行的极限。
K ↑,正反应彻底↑。
通常:K >107,正反应单向; K <10-7,逆反应单向; K = 10-7 ∼107,可逆反应。
5.多重平衡原理如 2个方程式相加,则: K = K 1 × K 2如2个方程式相减,则: K = K 1 /K 26. Van ’t Hoff 化学反应等温式:△G = △G ø + RT ln J p r (封闭体系、等温、不做非体积功)它表明了任意状态的△G 与△G ø和T 的关系,提供了任意状态下判断反应自发性的依据。
7. 影响化学平衡的因素 (1) 浓度△GJp r 与K r 关系 反应自发性 0Jp r = K r 平衡状态 < 0Jp r < K r 正反应自发 >0Jp r > K r 逆反应自发(2) 温度ln (K ø2 /K ø1 )= (△H ø/R ) [(T 2 -T 1)/(T 2T 1)]△H ø > 0 吸热, T 2 > T 1 : K 2r > K 1r△H ø < 0 放热, T 2 < T 1 : K 2r > K 1r(3) 压强无气体反应物和产物,改变总压力,对平衡几乎无影响。
n (g) = 0 的反应,在一定温度下改变总压力,平衡不移动。



第六章 化学平衡【复习题】【1】请判断下列说法是否正确,为什么? (1)某一反应的平衡常数是一个不变的常数;(2)r m G θ∆是平衡状态时,Gibbs 自由能的变化值,因为ln r m pG RT K θθ∆=-; (3)反应222CO g H O CO g +H g +()(g )()(),因为反应前后气体分子数相等,所以无论压力如何变化,对平衡均无影响;(4)在一定的温度和压力下,某反应的 0r mG θ∆,所以要寻找合适的催化剂,使反应得以进行;(5)某反应的0r mG θ∆,所以该反应一定能正向进行;(6)平衡常数值改变了,平衡一定会移动;反之,平衡移动了,平衡常数值也一定改变。
【解析】(1)不正确;因为平衡常数是温度的函数,温度改变,平衡常数也改变;(2)不正确;r m G θ∆是标准状态时Gibbs 自由能的变化值。
(3)不正确;因为=0B ν,若气体为理想气体,则x c p K K K ==,p K 与压力无关;若气体为非理想气体,则KK K fr pθθ=,由于压力对K r有影响,所以压力对pK 也有影响。
(4)不正确;因为催化剂只能改变反应速率,不能改变反应方向。
因为0r m G θ∆,故无论用什么催化剂都不会改变反应方向。
(5)不正确;因为ln r m r m a G G RT Q θ∆=∆+,0r m G θ∆,r G ∆却不一定小于零,所以不能由反应的r m G θ∆来判断反应的方向。
(6)不正确;平衡常数值改变了,平衡不一定会移动,而平衡移动了,平衡常数不一定发生改变,故题中说法不正确。
【2】化学反应的r m G ∆的下标“m”的含义是什么?若用下列两个化学计量方程式来表示合成氨的反应,问两者的r m G θ∆,p K θ之间的关系如何? (1)()()()22332H g N g NH g + ,1,1,r m p G K θθ∆(2)()()()2233122H g N g NH g + ,2,2,r m p G K θθ∆答:r m G ∆的下标“m”的含义是反应进度为1mol 。
一、选择题
1.( )
A 0.0595
B 0.00354
C 0.290
D 0.539 【B】
2. ( )
A △r G m表示有限体系中反应终态和始态的自由能变化
B
C △r G m表示维持各组分的化学势不变时,发生一个单位化学反应的自由能
变化
D 根据△r G m的大小可以判断反应进行的方向
【A】
3. ( )
A
B
C
D 【B】
4. 恒温下某氧化物分解反应:AO2(s)=A(s)+O2(g)的平衡常数为Kp(1),若反应
2AO2(s)=2A(s)+2O2(g)的平衡常数K p(2),则( )
A K p(1) > K p(2)
B K p(1) < K p(2)
C K p(1) = K p(2)
D 有的K p(1) > K p(2),有的K p(1) < K p(2) 【D】
5. 下列平衡常数中都无量纲的是( )
A K f、K p、K
B K c、K a、K x
C K x、K p、K
D K a、K x、K 【D】
6. 加入惰性气体对哪一个反应能增大其平衡转化率? ( )
A
B
C
D 【A】
7.
( )
A B
C D 【A】
8. 在T、p 时,理想气体反应C2H6(g) =H2(g) + C2H4(g)的Kc/Kx 为: ( )
A RT
B 1/RT
C RT/p
D p/RT 【D】
9. 已知分解反应NH2COONH4(s) = 2NH3(g) + CO2(g) 在30℃时的平衡常数
K=6.55×10-4,则此时NH2COONH4(s)的分解压力为:( )
A 16.63×103Pa
B 594.0×103 Pa
C 5.542×103 Pa
D 2.928×103 Pa 【A】
10. 气相反应A+B =2L+M ,在25℃下和恒定容器内进行,最初A 和B 各为
101.325 kPa,而没有L和M,平衡时A 和B 均为(1/3)×101.325 kPa,则该反应的Kc/(mol·dm-3) 为: ( )
A 4.31×10-3
B 8
C 10.67
D 16 【A】
11. 在S、H、cV、G、F 几个热力学函数中,其数值与最低能级能量数值的选取
无关的是:( )
A S、H、cV、G、F
B cV
C cV、S
D F、G、H 【C】
12. 在一定的温度下,一定量的PCl5(g) 在一密闭容器中达到分解平衡。
若往容
器中充入氮气,使体系的压力增加一倍(体积不变),则PCl5的解离度将为: ( )
A 增加
B 减少
C 不变
D 不定【C】
13. 一定温度下,一定量的PCl5(g)在某种条件下的解离度为 ,改变下列条件,
何者可使α增大?( )
A 增加压力使体积缩小一倍
B 体积不变,通入N2 气使压力增大一倍
C 压力不变,通入N2气使体积增大一倍
D 体积不变,通入Cl2气使压力增大一倍【C】
14. PCl5的分解反应是PCl5(g) =PCl3(g) + Cl2(g) 在473K 达到平衡时,PCl5(g)
有48.5% 分解,在573K 达到平衡时,有97% 分解,则此反应为:()
A 放热反应
B 吸热反应
C 即不放热也不吸热
D 这两个温度下的平衡常数相等【B】
15. 在通常温度下,NH4HCO3(s) 可发生下列分解反应:NH4HCO3(s) =NH3(g)
+ CO2(g) + H2O(g)设在两个容积相等的密闭容器A 和B 中,开始分别只盛有纯NH4HCO3(s) 1kg 及20kg 均保持在298K 达到平衡后,下列哪种说法是正确的?( )
A 两容器中压力相等
B A 内压力大于B 内压力
C B 内压力大于A 内压力
D 须经实际测定方能判别哪个容器中压力大
【A】
二、填空题
1. 固体氧化物的分解压(分解反应是吸热的)当温度升高时,分解压【增大】
2. 将固体NH4I 迅速加热到308.8K,测得其蒸气压为
3.666×104Pa,在此温度气态NH4I 实际上完全分解为NH3和HI,因此测得的蒸气压等于NH3和HI 分压之和。
如果在每一段时间内保持这个温度不变,则由于HI 按下式分解:
而使NH4I(s)上方的压力增大。
已知HI的分解反应在308.8K 时的
=0.127,达到平衡后,固体NH4I 上方的总压是【4.10*104Pa】3. 已知445℃时, Ag2O(s) 的分解压力为20974 kPa,则此时分解反应
Ag2O(s)=2Ag(s)+0.5O2(g) 的 △r G m为【-15.92 kJ·mol-1】
4. 对反应CO(g)+H2O(g)=H2(g)+CO2(g) ,K p K C【= 】
5.300K 时,某分子的基态能量是
6.21×10-21 J,其玻耳兹曼因子为
【0.223 】
6. 反应CO(g) + H2O(g) = CO2(g) + H2(g) 在600℃、100kPa 下达到化学平衡,当
压力增大到5000kPa时,各气体的逸度系数为:γ(CO2) = 1.90,γ(H2) =
1.10,γ(CO) = 1.23,γ(H2O) = 0.77则平衡点【向左移动】
7. 已知等温反应(i)CH4(g)=C(s)+2H2(g) ,(ii) CO(g)+2H(g)=CH3OH(g) 若提高系
统总压,则它们的平衡移动方向分别为、【向左,向右】
8. 理想气体反应A(g)+3B(g) = 2C(g)的△r G mθ=-3.0 kJ.mol-1,则反应C (g) = A(g)+
B(g)在400K时的Kθ为【0.64】
9. 298K已知下列化学反应方程的平衡常数2A=2B+C K1;2D=2E+C K2;则
D+B=E+A K为【(K2/K1)1/2
10. 在732K 时反应NH4Cl(s)=NH3(g)+HCl(g)的△r Gm⊙=-20.8kJ·mol-1,
△r H m=154kJ·mol-1,则反应的△r S mθ为【239J·K-1·mol-1】
二、是非题
1.任何反应物都不能百分之百地变为产物,因此,反应进度永远小于1。
【错】
2.化学势不适用于整个化学反应体系,因此,化学亲合势也不适用于化学反应
体系。
【错】
3.因为,所以就是标准态下的平衡常数。
【错】
4.对理想气体的化学反应,当温度一定时,有定值,因此其平衡组成不变。
【错】
5.复相反应中,平衡常数的表达式中并没有出现凝聚相的分压成浓度项,因此,
计算此类反应的只需考虑参与反应的气相物质。
【错】
6.的数值不但与温度(和方程式写法)有关,还与标准态的选择有关。
【对】
7.对同一化学反应,若反应计量式写法不同,则反应进度应不同。
但与选用反
应式中何种物质的量的的变化来进行计算无关。
【对】
8.对Hg(l)+S(s)=Hg(s) 反应,因有平衡限制,因此,Hg(l)无法全部参与反应。
【错】
9.处于标准态的CO2(g) 和O2(g),其标准燃烧焓值为零。
【对】
10.化学平衡发生新的移动,平衡常数必发生变化【对】
四、计算题
1 .现有蔗糖(C12H22O11)溶于水形成某一浓度的稀溶液,其凝固点为-0.200℃,计算此溶液在25℃时的蒸气压。
已知水的,纯水在25℃时的蒸气压为。
解:首先计算蔗糖的质量摩尔浓度
由上题可知,质量摩尔浓度和摩尔分数有以下关系
假设溶剂服从拉乌尔定律,则此溶液在25℃时的蒸气压
2.在25℃时,10 g某溶剂溶于1 dm3溶剂中,测出该溶剂的渗透压为Π=0.4000kPa,确定该溶质的相对分子质量。
解:溶剂的渗透压表示为
3.在20℃下将68.4 g蔗糖(C12H22O11)溶于1 kg的水中。
求
(1)此溶液的蒸气压。
(2)此溶液的渗透压。
已知20℃下此溶液的密度为。
纯水的饱和蒸气压。
解:溶液的蒸气压、渗透压分别为。