1.晶体结构
- 格式:pptx
- 大小:2.34 MB
- 文档页数:22

14种晶体结构晶体是由原子、分子或福隔离子按照一定的空间规则排列而成的有序固体。
晶体结构是指晶体中原子、离子或分子排列的规则和顺序。
在固体物质中,晶体结构的种类有很多种,其中比较常见的有以下14种:1. 立方晶体结构:最简单的晶体结构之一,具有三个等长的边和六个等角,包括简单立方、体心立方和面心立方三种类型。
2. 六方晶体结构:其晶胞的基本结构是六方密堆,其中最典型的就是六方晶体和螺旋晶体。
3. 正交晶体结构:晶胞具有三个不相互垂直的晶轴,分别被称为a、b 和c 轴,是最常见的晶体结构之一。
4. 单斜晶体结构:晶胞具有两个不相互垂直的晶轴,是晶体结构中的一种。
5. 三方晶体结构:具有三个相等的轴,夹角为60度,最常见的晶体结构之一是石英。
6. 菱晶体结构:晶胞内部有四面体结构,是一种简单的晶体结构。
7. 钙钛矿晶体结构:一种具有钙钛矿结构的晶体,包括钙钛矿结构和螺旋钙钛矿结构。
8. 蜗牛晶体结构:晶胞的形状像一只蜗牛的壳,是晶体结构中的一种。
9. 立方密排晶体结构:晶胞的结构是立方密排,是晶体结构中的一种。
10. 体心立方晶体结构:晶体结构的晶胞中有一个原子位于晶体的中心,是晶体结构中的一种。
11. 面心立方晶体结构:晶体结构的晶胞的各个面的中心有一个原子,是晶体结构中的一种。
12. 钻石晶体结构:晶体结构的晶胞构成了一种钻石结构,是晶体结构中的一种。
13. 银晶体结构:晶体结构的晶胞构成了一种银结构,是晶体结构中的一种。
14. 锶钛矿晶体结构:晶体结构的晶胞构成了一种锶钛矿结构,是晶体结构中的一种。
晶体结构的种类繁多,每种晶体结构都有其独特的结构特点和性质,对晶体的物理和化学性质有着重要的影响。
研究晶体结构不仅可以帮助我们更好地了解晶体的构成和性质,还有助于我们在材料科学、物理化学等领域的应用和研究。
因此,对晶体结构的研究具有重要的科学意义和应用价值。

第一章晶体结构1 布喇菲点阵和初基矢量晶体结构的特点在于原子排列的周期性质。
布喇菲点阵是平移操作112233R n a n a n a =++所联系的诸点的列阵。
布喇菲点阵是晶体结构周期性的数学抽象。
点阵矢量112233R n a n a n a =++,其中,1n ,2n 和3n 均为整数,1a ,2a 和3a 是不在同一平面内的三个矢量,叫做布喇菲点阵的初基矢量,简称基矢。
初基矢量所构成的平行六面体是布喇菲点阵的最小重复单元。
布喇菲点阵是一个无限的分立点的列阵,无论从这个列阵中的哪个点去观察,周围点的分布和排列方位都是完全相同的。
对一个给定的布喇菲点阵,初级矢量可以有多种取法。
2 初基晶胞(原胞)初基晶胞是布喇菲点阵的最小重复单元。
初基晶胞必定正好包含布喇菲点阵的一个阵点。
对于一个给定的布喇菲点阵,初基晶胞的选取方式可以不只一种,但不论初基晶胞的形状如何,初基晶胞的体积是唯一的,()123c V a a a =⋅⨯。
3 惯用晶胞(单饱)惯用晶胞是为了反映点阵的对称性而选用的晶胞。
惯用晶胞可以是初基的或非初基的。
惯用晶胞的体积是初基晶胞体积的整数倍,c V nV =。
其中,n 是惯用晶胞所包含的阵点数。
确定惯用晶胞几何尺寸的数字叫做点阵常数。
4 维格纳—赛兹晶胞(W-S 晶胞)维格纳—赛兹晶胞是另一种能够反映晶体宏观对称性的晶胞,它是某一阵点与相邻阵点连线的中垂面(或中垂线)所围成的最小体积。
维格纳—赛兹晶胞是初基晶胞。
5 晶体结构当我们强调一个实际的晶体与布喇菲点阵的抽象几何图案的区别时,我们用“晶体结构”这个名词[1]。
理想的晶体结构是由相同的物理单元放置在布喇菲点阵的阵点上构成的。
这些物理单元称为基元,它可以是原子、分子或分子团(有时也可以指一组抽象的几何点)。
将基元平移布喇菲点阵的所有点阵矢量,就得到晶体结构,或等价地表示为基元十点阵=晶体结构[2]当选用非初基的惯用晶胞时,一个布喇菲点阵可以用带有基元的点阵去描写。
117晶体结构一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。
但同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。
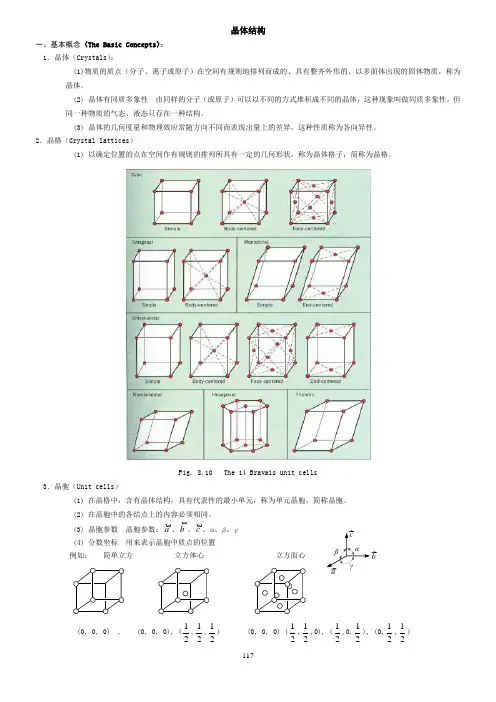
2.晶格(Crystal lattices )(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells3.晶胞(Unit cells )(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。
(2) 在晶胞中的各结点上的内容必须相同。
(3) 晶胞参数 晶胞参数:a、b、c、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置例如: 简单立方 立方体心 立方面心(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,21) αβγbc a118在分数坐标中,绝对不能出现1,因为1即0。
这说明晶胞是可以前后、左右、上下平移的。
等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
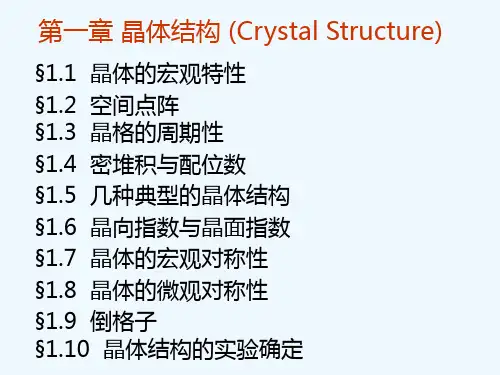
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中(100),(110),(111)面分别为(100) (110)(111)lFig. 8.12 Selected planes and their Miller indices for cubic system用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。

晶体的晶格结构及其特点晶体是一种具有高度有序、有规律的固态物质。
它的组成粒子按照一定的方式排列并且具有周期性的结构。
晶体的晶格结构是指晶体中原子、离子或分子的排列方式和它们之间的空间关系。
本文将介绍晶体的晶格结构及其特点。
一、晶体的晶格结构1. 单位胞晶体的晶格是由一个或多个相同的单元胞组成的,单元胞是最小可重复单元结构。
晶体中的所有原子、离子或分子都可以通过平移并保持周期性的方式填满整个晶体。
每个单位胞的形状和尺寸由晶体的晶系、晶格参数和点群对称性确定。
2. 晶体结构分类晶体根据它们的晶格结构可以分为几个主要类型:立方晶体、正交晶体、单斜晶体、菱面晶体、三斜晶体、四方晶体和六方晶体。
每种类型的晶体都具有不同的晶格对称性和晶格参数。
3. 晶格点晶体的晶格由晶格点组成,晶格点是晶体中原子、离子或分子的位置。
根据晶体的晶系和点群对称性,晶体的晶格点可以具有不同的排列模式,如正方形排列、三角形排列等。
二、晶体的特点1. 高度有序晶体具有高度有序的结构,其中的原子、离子或分子按照规则的方式排列。
晶体的有序排列使得晶体具有明确的晶面和晶向。
2. 周期性晶体的晶格结构是周期性的。
晶体中的晶格点在空间中周期性地重复出现,这种周期性使得晶体具有特定的晶面、晶向和晶面间距等特点。
周期性结构决定了晶体的物理、化学性质以及晶体的衍射性质。
3. 同质性晶体内部各个部分的性质是相同的,即具有同质性。
晶体的晶格结构决定了它的同质性,使得晶体的性质在空间上是均匀分布的。
4. 各向同性晶体的各向同性是指在晶体的不同晶向上性质相同。
然而,有些晶体具有部分各向异性,即在特定的晶向上显示出不同的性质。
5. 晶体缺陷晶体中可能存在一些缺陷,如点缺陷(空位、杂质等)、线缺陷(位错、螺旋走步等)和面缺陷(晶粒边界、层间错等)。
这些缺陷会影响晶体的物理和化学性质。
总结:晶体的晶格结构是由具有周期性排列的晶格点构成的。
晶体具有高度有序、周期性、同质性和各向同性的特点。

分子和晶体的结构及性质分子和晶体是物质的两种不同形态,它们在结构和性质上存在着显著的差异。
本文将分别讨论分子和晶体的结构以及它们的性质。
一、分子的结构及性质1. 分子的结构分子是由原子按照一定比例和方式组合而成的物质,在空间上呈现出三维的结构。
分子的结构由原子间的化学键连接所决定,可以是共价键、离子键或金属键。
此外,分子还可能存在分子间力,如范德华力和氢键。
2. 分子的性质分子性质主要受到分子内部化学键和分子间力的影响。
不同的分子由于其化学键和分子间力的差异,呈现出不同的性质。
例如,具有共价键的分子通常具有较低的沸点和熔点,而具有离子键的分子则在熔点上具有较高的特征。
二、晶体的结构及性质1. 晶体的结构晶体是由大量离子、原子或分子有规律地堆积而成的固体结构。
晶体的结构可以分为离子晶体、原子晶体和分子晶体三种类型。
离子晶体由正、负离子通过离子键相互结合而成;原子晶体由相同元素的原子通过共价键相互连接而成;分子晶体则是由分子通过范德华力和氢键相互结合而成。
2. 晶体的性质晶体的性质受到晶体结构的影响。
晶体的有序排列使得它们具有明确定义的外部形状和特征;晶体在物理性质上表现出一些特殊的性质,如各向同性、光学性质、电导性、热导性等。
三、分子和晶体的比较1. 结构比较分子的结构是由分子内部化学键构成的,分子间的连接相对较弱;晶体的结构则是由大量的原子或离子堆积形成的,分子间的连接比分子内部的连接更强。
2. 性质比较分子通常在相对较低的温度或压力下就可以发生相变,比如液化、固化等;而晶体具有更高的熔点和熔化热,需要更高的温度才能发生相变。
3. 应用比较分子和晶体根据其不同的结构和性质,具有不同的应用领域。
分子常用于化学反应媒介、溶剂、药物和有机材料等领域;晶体则广泛应用于电子器件、光学器件、半导体材料等领域。
结论分子和晶体是物质的两种不同形态,它们在结构和性质上存在着明显的差异。
分子通过分子内部的化学键相连而成,具有较低的熔点和熔化热;晶体由原子或离子有序堆积而成,具有更高的熔点和熔化热。

第一章晶体结构1-1. 试述晶态、非晶态、准晶、多晶和单晶的特征性质。
解:晶态固体材料中的原子有规律的周期性排列,或称为长程有序。
非晶态固体材料中的原子不是长程有序地排列,但在几个原子的范围内保持着有序性,或称为短程有序。
准晶态是介于晶态和非晶态之间的固体材料,其特点是原子有序排列,但不具有平移周期性。
另外,晶体又分为单晶体和多晶体:整块晶体内原子排列的规律完全一致的晶体称为单晶体;而多晶体则是由许多取向不同的单晶体颗粒无规则堆积而成的。
1-2. 晶格点阵与实际晶体有何区别和联系?解:晶体点阵是一种数学抽象,其中的格点代表基元中某个原子的位置或基元质心的位置,也可以是基元中任意一个等价的点。
当晶格点阵中的格点被具体的基元代替后才形成实际的晶体结构。
晶格点阵与实际晶体结构的关系可总结为:晶格点阵+基元=晶体结构1-3. 晶体结构可分为Bravais格子和复式格子吗?解:晶体结构可以分为Bravais格子和复式格子,当基元只含一个原子时,每个原子的周围情况完全相同,格点就代表该原子,这种晶体结构就称为简单格子或Bravais格子;当基元包含2个或2个以上的原子时,各基元中相应的原子组成与格点相同的网格,这些格子相互错开一定距离套构在一起,这类晶体结构叫做复式格子。
心四方解:(a)“面心+体心”立方不是布喇菲格子。
从“面心+体心”立方体的任一顶角上的格点看,与它最邻近的有12个格点;从面心任一点看来,与它最邻近的也是12个格点;但是从体心那点来看,与它最邻近的有6个格点,所以顶角、面心的格点与体心的格点所处的几何环境不同,即不满足所有格点完全等价的条件,因此不是布喇菲格子,而是复式格子,此复式格子属于简立方布喇菲格子。
(b)“边心”立方不是布喇菲格子。
从“边心”立方体竖直边心任一点来看,与它最邻近的点子有8个;从“边心”立方体水平边心任一点来看,与它最邻近的点子也有8个。
虽然两者最邻近的点数相同,距离相等,但他们各自具有不同的排列。



固体物理复习(⼀)晶体结构描述和布拉格定律预备知识1.晶胞Crystal structure = Lattice(点阵) * Basis(基元)以NaCl为例, NaCl晶体的点阵为⾯⼼⽴⽅结构, 其基元包含⼀个Na和⼀个Cl.三维点阵的类型:Triclinic: a1!=a2!=a3, θ1!=θ2!=θ3 ,修饰 PMonoclinic: a1!=a2!=a3, θ1=θ2=90°!=θ3,P,COrthorhombic: a1!=a2!=a3, θ1=θ2=θ3=90°,P,I,F,CTetragonal: a1=a2!=a3, θ1=θ2=θ3=90°,P,ICubic: a1=a2=a3, θ1=θ2=θ3=90°,P,I,FTrigonal: a1=a2=a3, θ1=θ2=θ3<120°, !=90°,PHexagonal: a1=a2!=a3, θ1=θ2=90°, θ3=120°,PP=原胞(1个点阵点), I=体⼼(2点阵点), F=⾯⼼(4点阵点), C=Side-centred, 即在顶⾯和底⾯添加点阵点4种修饰*7种晶格系统组合起来得到14种Bravais点阵2. 对称操作平移对称操作: T=u1a1+u2a2+u3a3, u1u2u3为整数, a1a2a3为基⽮基⽮ a1a2a3 = 晶格常数 a1a2a3点对称操作: 对应群论的点群操作3. 原胞原胞(primitive cell):点阵中的最⼩晶胞, ⼀个点阵点对应⼀个原胞.wigner-seitz胞:划分原胞的⼀种⽅式, 取点间连线的中垂线围成的最⼩⾯积.(wigner-seitz胞⽰意图)正格⼦与倒格⼦1.正格⼦正格⼦中的布拉格定律:2dsinθ=nλ2.倒格⼦由于正格⼦的布拉格理论⽆法描述散射的强度, 因此要对正格⼦进⾏傅⾥叶变化⾸先将⼀维电⼦浓度n(r)进⾏傅⾥叶展开n(r)=n0+Σ(C p cosθ+S p sinθ)=Σn p exp(iθ), 令-n p=n p*使n(r)为实数θ=2πpx/a由此引出倒格⼦的概念, 2πp/a为晶体倒格⼦, 或在傅⾥叶空间中的⼀个点.推⼴到三维有n(r)=Σn G exp(iG*r)G=v1b1+v2b2+v3b3,b1=2π·a2xa3/(a1·a2xa3), b2=2π·a3xa1/(a1·a2xa3),b3=2π·a1xa2/(a1·a2xa3)倒格⼦空间中的Wigner-Seitz胞称为布⾥渊区, 布⾥渊区在晶体电⼦能带理论中有重要地位接下来推导倒格⼦的布拉格定律:⾸先引⼊散射振幅F的定义F=∫dVn(r)exp(-iΔk·r)Δk为散射波与⼊射波的波⽮差k'-k将n(r)傅⾥叶展开F=∫dVΣn G exp(iG*r)exp(-iΔk·r)=Σ∫dVn G exp(i(G-Δk)·r)由此可以看出, 当Δk=G时F=Vn G, 发⽣弹性散射.发⽣弹性散射时, 光⼦能量E=ћω守恒, ω=ck, 因此⼊射波波⽮⼤⼩与散射波波⽮相等, 即k2=k'2因为k+G=k', 所以综上有(k+G)2=k'2即2k·G=G2, 此即倒格⼦空间的布拉格定律的形式.。

常见的晶体结构高中化学晶体是由原子、分子或离子等按照一定的规则排列组成的固体物质。
晶体结构是指晶体中原子、分子或离子的排列方式和空间位置的有序性。
以下是一些常见的晶体结构:1.立方晶系:立方晶系是最简单的晶体结构类型,具有最高的对称性。
立方晶系包括以下几种晶体结构:-简单立方结构:最简单的晶体结构,如钠金属。
-面心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于正方形面的中心,如铝、铜等。
-体心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于立方体的中心,如铁、锂等。
-体心立方密堆结构:在体心立方结构的基础上,每个体心立方顶点上还有各自的三个原子,如铬、铤等。
2.六方晶系:六方晶系的晶体结构相对复杂,具有六重轴对称性。
六方晶系包括以下几种晶体结构:-六方最密堆积结构:最密堆积的晶体结构,如铝合金、硬质合金等。
3.正交晶系:正交晶系的晶体结构具有三个相互垂直的轴和互相垂直的面,没有对称轴。
正交晶系包括以下几种晶体结构:-基心正交结构:每个顶点上有原子以外,还有一个原子位于底面的中点,如锌等。
-面心正交结构:每个顶点上原子以外,还有一个原子位于两个邻接底面的中点和两个对称角上的原子,如镍。
4.单斜晶系:单斜晶系的晶体结构具有一个二重轴和一组不对称的轴,没有对称轴。
单斜晶系包括以下几种晶体结构:-单斜底心结构:每个顶点上有原子以外,还有一个原子位于两个底面的中点,如铅、镀镍等。
5.斜方晶系:斜方晶系的晶体结构没有对称轴,具有两个相等且垂直的轴。
-斜方单斜结构:具有一个反射面,如黄铁矿、菱铁矿等。
6.三斜晶系:三斜晶系的晶体结构没有对称轴,也没有垂直的轴。
三斜晶系包括以下几种晶体结构:-无底心三斜结构:没有底心原子,如铜酸亚锌等。
这些晶体结构是根据晶体的对称性进行分类的,每一种晶体结构都有其独特的排列方式和空间位置。
通过研究晶体结构,可以揭示物质的物理和化学性质以及材料的制备和应用方面的特点。
金属的晶体结构知识点总结一、晶体结构的基本概念1. 晶体及其性质晶体是由原子、离子或分子按一定的顺序排列而成的,具有周期性结构的固体。
晶体内部的原子、离子或分子按照规则排列,形成了晶体的结晶面、晶格点、结晶方位等。
晶体具有明显的外部形状和内部结构,具有特定的物理、化学性质。
晶体根据其结构的不同可以分为同质晶体和异质晶体。
2. 晶体结构晶体结构是指晶体内部的原子、离子或分子的排列方式和规律。
根据晶体内部原子、离子或分子的排列方式的不同,晶体结构可以分为点阵型、面心立方型、体心立方型等。
3. 晶体的组成晶体的组成通常是由晶格单元和晶格点构成的。
晶格单元是晶体的最小重复单元,晶格点是晶体内部原子、离子或分子所占据的位置。
4. 晶体的晶格晶格是晶体内部原子、离子或分子排列形成的几何形状。
晶格可以分为点阵型、面心立方型、体心立方型等。
5. 晶体的晶系晶体根据晶体中晶格的对称性可将其分为七个晶系,包括三角晶系、四方晶系、正交晶系、单斜晶系、菱形晶系、正菱形晶系和立方晶系。
6. 晶体的晶向和晶面晶体中的晶向和晶面是用来描述晶体内部结构的概念。
晶向是晶体内部原子排列的方向,晶面是晶体内部原子排列的平面。
7. 晶格常数晶格常数是用来描述晶体晶格尺寸大小的物理量。
晶格常数通常表示为a、b、c等,表示晶体中晶格点之间的距离。
二、金属的晶体结构1. 金属的结晶特点金属是一类具有典型金属性质的固体物质,具有较好的导电性、热导性、延展性和塑性等。
金属的晶体结构对其性质有着显著的影响。
2. 金属的晶体结构类型根据金属晶体内部原子排列的方式和规律,金属的晶体结构可分为面心立方结构、体心立方结构和密堆积结构等。
3. 面心立方结构(FCC)面心立方结构是一种典型的金属晶体结构类型,其中晶格点位于立方体的六个面的中心和顶点。
面心立方结构的晶体具有较好的密度和变形性能,常见于铜、铝、银、金等金属中。
4. 体心立方结构(BCC)体心立方结构是一种典型的金属晶体结构类型,其中晶格点位于立方体的顶点和中心。