乙酰乙酸乙酯合成
- 格式:ppt
- 大小:13.78 MB
- 文档页数:5

⼄酰⼄酸⼄酯的合成⼄酰⼄酸⼄酯的合成学院:化⼯与材料学院班级:B1201姓名:康丽霞学号:15111201061 分⼦结构2 基本信息3物性数据1. 性状:⽆⾊液体,有芳⾹味。
2. 沸点(oC,101.3kPa):1813. 熔点(oC,酮式):-394. 熔点(oC,烯醇式):-445. 相对密度(g/mL,25/4oC):1.021266. 相对蒸汽密度(g/mL,空⽓=1):4.57. 折射率(20oC):1.41948. 黏度(mPa·s,25oC):1.50819. 闪点(oC,闭⼝):84.410. 燃点(oC):29511. 燃烧热(KJ/mol,25oC):3162.712. ⽐热容(KJ/(kg·K),24.5oC,定压):1.9213. 临界温度(oC):40014. 电导率(S/m,25oC):1×10-715. 蒸⽓压(kPa,40~41oC):0.2716. 热导率(W/(m·K),30oC):0.155817. 溶解性:微溶于⽔,溶于有机溶剂。
25℃时在⽔中溶解12%;⽔在⼄酰⼄酸⼄酯中溶解4.9%。
18. 相对密度(20℃,4℃):1.028219. 液相标准热熔(J·mol-1·K-1) :251.420. ⽓相标准燃烧热(焓)(kJ·mol-1):-3228.521. ⽓相标准声称热(焓)( kJ·mol-1) :-561.774 存储⽅法1.应远离⽕源置阴凉通风处贮存。
2.本品⽤铝桶包装,桶盖密封性要好,贮于阴凉通风处,防⽕。
按易燃有毒化学品规定贮运5 合成⽅法1. 双⼄烯酮与⼄醇酯化法双⼄烯酮和⽆⽔⼄醇在浓硫酸催化下进⾏酯化,得⼄酰⼄酸⼄酯粗品。
再经减压精馏得成品。
2.⼄酸⼄酯⾃缩合法由两分⼦⼄酸⼄酯在⾦属钠存在下⾃缩合⽽得。
2. 由⼄酸⼄酯在⼄醇钠存在下缩合后蒸馏⽽得。
由双⼄烯酮与⽆⽔⼄醇在浓硫酸催化下酯化后减压蒸馏⽽得。


乙酰乙酸乙酯的合成方程式乙酰乙酸乙酯是一种常见的有机溶剂,也是一种重要的合成原料,它的合成方程式如下:CH3COOCH2CH3 + HCl → CH3COOH + CH3CH2ClCH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O上述合成方程式是乙酰乙酸乙酯的两步反应过程。
一、原料准备1. 乙酸乙酯(CH3COOCH2CH3)是由乙酸和乙醇经过酯化反应得到的化合物。
它是一种透明无色液体,带有类似于甜酸味的气味。
乙酸和乙醇的化学式分别为CH3COOH和CH3CH2OH。
2. 氯化乙烷(CH3CH2Cl)氯化乙烷是一种有机化合物,分子式为CH3CH2Cl。
它是一种无色气体,在常温常压下常温沸热。
氯化乙烷是制备乙酰乙酸乙酯的重要原料之一。
二、反应步骤制备乙酰乙酸乙酯需要两步反应,第一步是氯化乙烷与乙酸乙酯发生酯化反应,生成乙酸和氯化乙基。
CH3COOCH2CH3 + HCl → CH3COOH + CH3CH2Cl第二步是乙酸和乙醇发生酯化反应,生成乙酰乙酸乙酯和水。
CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O三、反应条件该反应需要在适宜的反应条件下进行,具体条件如下:1. 酯化反应条件:反应时间:2-4小时反应温度:60-80℃反应物比例:1:1.2(乙酸乙酯:氯化乙烷)酯化反应催化剂:HCl2. 酯交换反应条件:反应时间:3-4小时反应温度:70-80℃反应物比例:1:1(乙酸:乙醇)酯交换反应催化剂:硫酸、盐酸等四、反应机理1. 酯化反应机理酯化反应是一种酸催化反应,HCl催化剂可以将氯离子引入乙酸乙酯中,使其易于与氯化乙烷进行反应,产生水和氯化乙基。
同时,水也可以与氯化乙基反应,生成HCl和乙醇。
这个平衡反应可以通过蒸馏来实现。
2. 酯交换反应机理酯交换反应也是一种酸催化反应,硫酸或盐酸可以抑制乙酸与水的反应,从而使乙酸和乙醇之间发生酯化反应,生成乙酰乙酸乙酯和水。


乙酰乙酸乙酯合成丁二酸的路线1. 引言说到化学,很多人可能会想到枯燥的公式和实验室里一堆瓶瓶罐罐,但今天我们要聊的可不是那些乏味的东西!今天我们来讲讲乙酰乙酸乙酯是怎么合成丁二酸的。
这可是个很有意思的话题,咱们就像做菜一样,把这些化学反应想象成一步一步的烹饪过程。
准备好了吗?让我们一起动手做化学“大餐”吧!2. 乙酰乙酸乙酯的基本概念2.1 什么是乙酰乙酸乙酯?乙酰乙酸乙酯,听起来是不是很高大上?其实它就是一种有机化合物,化学式为C₄H₈O₄。
你可以把它想象成一个小家伙,既可以在化学反应中当主角,又可以当配角。
它是合成许多其他化合物的好帮手,真是个多才多艺的小家伙呢!2.2 丁二酸的魅力说到丁二酸,它可是一个重要的化工原料,化学式为C₄H₆O₄。
这个小家伙在塑料、药物和染料等领域都有着举足轻重的地位,真是个百搭的材料!所以,我们今天的目标就是用乙酰乙酸乙酯这个小家伙来合成丁二酸,听起来是不是很刺激?3. 合成路线3.1 步骤一:乙酰乙酸乙酯的羟基化好了,咱们开始动手吧!首先,我们需要让乙酰乙酸乙酯经历一次羟基化反应。
这就像给它加上一点“调味料”,让它变得更加美味。
在这个过程中,乙酰乙酸乙酯会和水反应,形成一个羟基,嘿!它变得更加丰富了,像是多加了点料的火锅,真是美味极了!3.2 步骤二:脱羧反应接下来,我们要让这个混合物经历脱羧反应。
这一步就像是在火锅里捞出食材,去掉一些不必要的东西,让它变得更加纯粹。
通过加热和催化剂的帮助,乙酰乙酸乙酯中的羧基就会被“去掉”,最终形成丁二酸。
这个过程可能需要一点耐心,就像慢慢炖汤一样,要让味道充分释放。
3.3 步骤三:收集和提纯反应完成后,别急着吃,首先得把这个“菜”收集起来。
通过分离和提纯的过程,我们可以获得高纯度的丁二酸。
想象一下,你经过一番努力,终于把一锅美味的汤煮好了,现在要把它装进干净的碗里,真是成就感满满啊!4. 结尾好了,各位小伙伴们,今天的乙酰乙酸乙酯合成丁二酸的旅程就到这里了!我们经历了羟基化、脱羧反应和提纯三个步骤,就像是一场别开生面的烹饪秀。


生命科学与理学院乙酰乙酸乙酯、丙二酸乙酯在有机合成的应用专业:生物科学班级:2012级1班学号:姓名:张昆乙酰乙酸乙酯一、乙酰乙酸乙酯的性质物理性质无色液体,熔点<-45℃,沸点181℃,相对密度(20/4℃),折射率,蒸气压(20℃)。
与乙醇、乙醚、苯等一般有机溶剂混溶,易溶于水。
具有愉快的水果香气。
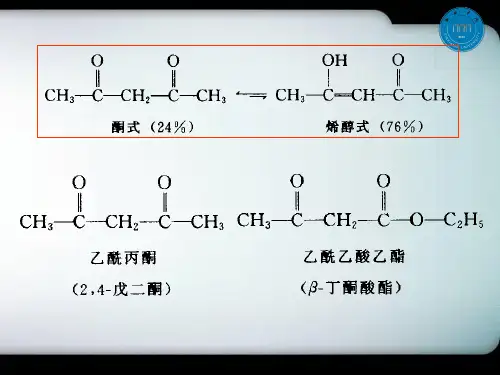
化学性质互变异构一般的乙酰乙酸乙酯是酮式和烯醇式互变异构体和平衡混合物,酮式占93%,烯醇式占7%。
酮式乙酰乙酸乙酯沸点为41℃(),不能与溴起加成反应,也不使三氯化铁显色,但能与酮试剂作用。
烯醇式乙酰乙酸乙酯沸点为33℃(),不与酮试剂作用,但能使三氯化铁显色,烯醇分子内发生氢键缔合,形成螯合环。
因此,烯醇式都以单分子形态存在,沸点较低。
乙酰乙酸乙酯的分解反应乙酰乙酸乙酯在不同条件下不同反应条件下发生不同类型的分解反应,生产酮或酸。
乙酰乙酸乙酯在稀碱作用下,发生酯的水解反应,受热后脱羧成酮,这种分解称为酮式分解。
+ CO 2在浓碱条件下,OH -浓度高,除了和酯作用外,还可以使乙酰乙酸乙酯中α-与β-碳原子之间的键断裂,生成两分子羧酸,这种分解称为酸式分解。
取代反应乙酰乙酸乙酯亚甲基上的氢受到相邻两个吸电子基的影响,变得非常活泼,1)5%NaOH2)H1)浓NaOH2)H +在金属钠或乙醇钠的作用下可以被烷基或酰基取代。
选择适当的烷基化试剂或酰基化试剂与乙酰乙酸乙酯反应,然后酮式分解或酸式分解就可以得到不同结构的酮或酸。
二、乙酰乙酸乙酯的合成乙酰乙酸乙酯(俗名三乙)具有典型的β-酮酸酯结构,可用于多种合成反应,是一种重要的有机及药用合成的中间体。
在医药上用于合成氨基吡啉、维生素B 等,还广泛用于配制草莓、苹果、杏、樱桃、桃等水果型和酒型(朗姆、威士忌等)香精。
在农药生产上用于合成有机磷杀虫剂蝇毒磷的中间体α-氯代乙酰乙酸乙酯、嘧啶氧磷的中间体,杀菌剂恶霉灵等,也是杀菌剂新品种嘧菌环胺、氟嘧菌胺、呋吡菌胺及植物生长调节剂杀雄啉的中间体。

乙酰乙酸乙酯的合成方法
嘿,咱今儿个就来聊聊乙酰乙酸乙酯的合成方法。
你可别小瞧这玩意儿,它在好多领域都有着重要的作用呢!
先来说说一种常见的方法吧,那就是用乙酸乙酯在醇钠的作用下发生克莱森缩合反应。
就好像搭积木一样,把乙酸乙酯这个“小积木”通过醇钠这个“小帮手”,巧妙地搭建成乙酰乙酸乙酯这个“大建筑”。
这过程是不是挺神奇的?
在这个反应里呀,醇钠可是个关键角色呢。
它就像是个神奇的催化剂,能让反应顺顺利利地进行下去。
想象一下,如果没有醇钠,这反应就好像没了领路人,可能就会迷失方向啦。
还有啊,反应的条件也很重要哦。
温度啦、压力啦,都得控制得恰到好处。
这就好比做饭,火候掌握不好,做出来的菜可就不美味啦。
另外呢,还有其他的一些合成方法,各有各的特点和优势。
这就像是不同的道路都能通往同一个目的地,只是走法不一样罢了。
比如说,有的方法可能需要一些特殊的试剂,这些试剂就像是给反应加上了特别的调料,让反应变得更加独特。
有的方法可能操作起来稍微复杂一点,但得到的产物纯度会更高,就像精心雕琢的艺术品一样。
那为啥要研究乙酰乙酸乙酯的合成方法呢?这还用问吗?它在药物合成、香料制造等好多方面都大有用处呢!就好像一把万能钥匙,能打开好多领域的大门。
你想想看,要是没有这些有效的合成方法,我们怎么能得到这么重要的化合物呢?怎么能让它在各个领域发挥作用呢?
所以啊,乙酰乙酸乙酯的合成方法可真是个有趣又重要的话题呢!我们可不能小看它,得好好研究研究,让它为我们的生活和科技发展贡献更大的力量呀!怎么样,现在你对乙酰乙酸乙酯的合成方法是不是有了更深刻的了解呢?。
![[乙酰乙酸乙酯的合成]工业上合成乙酸乙酯的4种方法比较](https://uimg.taocdn.com/9a7b8d31a4e9856a561252d380eb6294dd88220a.webp)
[乙酰乙酸乙酯的合成]工业上合成乙酸乙酯的4种方法比较篇一: 工业上合成乙酸乙酯的4种方法比较酯化法。
醋酸酯化法生产醋酸乙酯的常见方法。
酯化法是在催化剂存在的条件下,由醋酸和乙醇发生酯化反应而得醋酸乙酯,然后再经过精制得到最终产品醋酸乙酯。
近年来开发出了1种酯化法工艺方法称之为”切换法”,即在同一套装置内通过切换生产原料,可以根据市场需要生产醋酸乙酯或醋酸丁酯。
这种对常规酯化技术的改革具有降低生产成本的潜力。
通过消除产品间的切换时间而增加多用途酯化设备的运转时间,从而降低投资成本和操作成本。
以前建设的酯化法醋酸乙酯装置或醋酸丁酯装置都可以投入少量资金改造为切换法。
此工艺目前国内比较成熟。
研究人员在现有醋酸酯化法基础上开发了1种醋酸乙酯绿色节能新工艺-非高分子固体酸催化酶化-加盐萃取精馏联合技术,简称”盐析法”。
据报道,与传统酯化法相比可减少20%-25%的能耗,能有效降低乙醇用量,此技术已经在部分企业实现改造。
酯化法工艺优点是技术成熟、投资少。
缺点是成本高、设备腐蚀严重、废酸不易处理、排放时环境污染大、副反应多及副产物处理困难等。
酯化法适用于拥有大量低成本乙醇的地区。
乙醛缩合法。
乙醛缩合法是在催化剂乙醇铝的存在下,2个分子的乙醛自动氧化和缩合,重排形成一分子的醋酸乙酯。
采用该工艺时,如果反应过程中有2种醛存在,则可以生产出混合酯类,例如Eastman 公司在生产中采用大量乙醛和适量丁醛,可同时生产醋酸乙酯和醋酸丁酯。
该工艺在常压低温下进行,反应条件温和,但是铝基催化剂目前尚无法回收,乙醇铝水解后产生的残渣如果直接排放,将会污染环境。
随着环保要求的提高,必须寻求适宜的处理方法。
该法不足之处是只有在乙醛价格处于低位时才具有竞争力。
乙醛缩合法在国外已经比较成熟。
该法的优点是化学反应中没有废物产生。
乙醛缩合法工艺受原料乙醛的限制,一般应建在乙烯-乙醛联合装置内。
乙醇脱氢法。
乙醇脱氢法是近年来开发的1种新的工艺方法。

2-(3-硝基亚苄基)乙酰乙酸乙酯的合成
硝基亚苄基乙酰乙酸乙酯是一种重要的有机化合物,在化工、农药、医药等领域有着广泛的应用。
本文将给出 2-(3-硝基亚苄基)乙酰乙酸乙酯的合成方法。
首先,我们需要准备一些原料,包括 3-硝基亚苄基胺、乙酸乙酯和碳酸钠。
将 3-硝基亚苄基胺放入反应容器中,加入足量的乙酸乙酯。
然后加入适量的碳酸钠,作为催化剂使用。
接下来,将反应容器的温度升高至80 ℃左右,保持一段时间,使反应物完全溶解。
然后,加入足量的磷酸作为调节剂,使反应更加顺利进行。
在保持一定温度的情况下,继续反应若干小时,直到反应终点。
最后,将得到的混合物冷却至室温,过滤干净,即可得到所需的 2-(3-硝基亚苄基)乙酰乙酸乙酯。
在本文所述的合成过程中,需要注意几点:首先,反应温度的控制是十分重要的,如果温度过高或过低都会导致反应不顺利;其次,选择合适的催化剂是十分关键的,碳酸钠是常用的催化剂,但也可以使用其他的催化剂,如磷酸等;最后,在进行反应的过程中,应该注意反应的安全,避免反应过程中的意外发生。
总的来说,2-(3-硝基亚苄基)乙酰乙酸乙酯的合成并不复杂,只需要注意一些细节就可以得到所需的产物。
这种有机化合物在工业应用中十分广泛,具有重要的经济价值。
乙酰乙酸乙酯的合成及其波谱分析一、乙酰乙酸乙酯的合成㈠ 实验目的1.了解酯缩合反应制备β-酮酸酯的原理及方法。
2.掌握无水反应的操作要点。
3.掌握蒸馏、减压蒸馏等基本操作。
㈡ 实验原理(半微量实验)含有α-氢的酯在碱性催化剂存在下,能与另一分子的酯发生克莱森酯缩合反应,生成β-酮酸酯,乙酰乙酸乙酯就是通过这个反应来制备的。
本实验是用无水乙酸乙酯和金属钠为原料,以过量的乙酸乙酯为溶剂,通过酯缩合反应制得乙酰乙酸乙酯。
反应机理为,利用乙酸乙酯中含有的少量乙醇与钠作用生成乙醇钠。
↑+→+25252222H ON H C N OH H C a a随着反应的进行不断地生成乙醇,反应就不断地进行,直至钠消耗完。
在乙醇钠作用下,具有α-氢原子的乙酸乙酯自身缩合,生成烯醇型钠盐,再经醋酸酸化即得乙酰乙酸乙酯。
金属钠极易与水反应,并放出氢气和大量热,易导致燃烧和爆炸,故反应所用仪器必须是干燥的,试剂必须是无水的。
㈢ 实验装置乙酰乙酸乙酯合成的实验装置包括反应装置和减压蒸馏装置。
反应装置如图3-1所示,其回流冷凝管上须加干燥管。
减压蒸馏装置图3-2所示。
包括蒸馏、抽气、测压和保护四部分。
蒸馏部分由圆底烧瓶、克氏蒸馏头、冷凝管、接引管和接受器组成。
在克氏蒸馏头带有支管一侧的上口插温度计,另一口则插一根末端拉成毛细管的厚壁玻璃管。
毛细管下端离瓶底约1~2mm ,在减压蒸馏中,毛细管主要起到沸腾中心和搅动作用,防止爆沸,保持沸腾平稳。
在减压蒸馏装置中,接引管一定要带有支管。
该支管与抽气系统连接。
在蒸馏过程中若要收集不同馏分,则可用带支管的多头接引管。
根据馏程范围可转动多头接引管集取不同馏分。
接受器可用圆底烧瓶。
吸滤瓶等耐压容器,但不可用锥形瓶。
实验室里常用的抽气减压设备是水泵或油泵。
水泵常因其结构、水压和水温等因素,不易得到较高的真空度。
油泵可获得较高的真空度,好的油泵可达到13.3Pa 的真空度。
油泵的结构较为精密,如果有挥发性有机溶剂。
乙酰乙酸乙酯合成法机理乙酰乙酸乙酯的合成法机理可说是一场化学界的小冒险。
想象一下,咱们就像一群探险家,正准备踏上寻宝之旅。
这个小家伙叫乙酰乙酸乙酯,听名字就觉得它不简单。
它的结构其实挺有趣,里面有个小“乙酰”和个“乙酸”,它们像好朋友一样紧紧相拥。
咱们今天就来聊聊它的合成方法,这可是一门精妙的艺术,绝对不是随便混搭的哦。
咱们得从原料说起。
你想,要做出美味的菜肴,得先备齐材料嘛。
在这个过程中,咱们需要乙酰乙酸和醇,这里选的是乙醇。
二者相遇,就像火星撞地球一样,瞬间火花四溅。
哎呀,这时候要用到一些催化剂,比如氢氧化钠,别看它不起眼,但却是化学反应的推手。
就像比赛时的教练,默默地在背后给你加油助威。
反应开始了,咱们可以想象一下,化学分子们像在跳舞一样,优雅而迅速。
乙酰乙酸和醇的结合就像一对热恋中的小情侣,一碰就火花四溅。
它们之间的电子云开始重新组合,形成了一种新的化合物。
这个过程看似简单,却充满了不可思议的化学魔力。
你能想象吗?在显微镜下,那些小分子们可是在进行一场精心编排的舞蹈呢!当这个新的化合物生成后,咱们就得把它分离出来。
想象一下,派对上总会有一些人想要单独跳舞,不想跟大伙儿挤在一起。
分离过程就像筛选嘉宾,得让那些不需要的杂质离开,最后只留下咱们的明星——乙酰乙酸乙酯。
可以说,经过一番折腾,终于把这颗璀璨的明珠找出来了,真是让人兴奋!在这个过程中,反应条件也得掌握得当。
温度、浓度、时间,每一个环节都关系重大。
就好比做菜,火候掌握不好,可能就成了黑暗料理。
温度过高,反应可能会失控,温度过低,反应又可能进展缓慢,最后让人等得心急如焚。
所以,实验室里的化学家们可得小心翼翼,像对待小宝宝一样,细心呵护每一个反应步骤。
除了这些,搅拌速度也很关键。
想想在舞池里,大家跳得欢快,突然来了个慢舞,气氛立马变得尴尬。
所以,适当的搅拌能保证反应均匀,避免局部浓度过高,导致反应不完全。
化学反应可不是一个人的独舞,而是需要每个分子都参与进来,才能成就这场盛大的化学派对。
醇钠的制备及乙酰乙酸乙酯的合成
一:实验目的
1.了解乙酰乙酸乙酯的制备的原理和方法。
2.熟悉在酯缩合反应中金属钠的应用和操作。
3.初步掌握减压蒸馏的操作技术。
二:实验原理
1.反应式
2CH 3CO 2C 2H
5 Na +[CH 3COCHCO 2C 2H 5]_ CH 3C0CH 2CO 2C 2H 5+NaOAc
2.反应机理
三.实验步骤及现象
四.结果与讨论
1.产量与产率
产量:无色透明液体0.7g
产率0.6/1.3×100%=46%
2.分析
乙酰乙酸乙酯在常压蒸馏时很易分解, 影响产率。
五.注意事项
NaOC 2H 5 HOAc
1.仪器干燥,严格无水。
金属钠易与水反应生成放出氢气及大量的热易导致燃烧和爆炸;氢氧化钠的存在易使乙酸乙酯水解;水的存在使金属钠消耗难以形成碳负离子中间体。
2.摇钠时应握紧烧瓶及橡胶塞,防止喷溅;钠珠应该越细越好。
3.醋酸不能多加,否则会造成乙酰乙酸乙酯的溶解损失。
用醋酸中和时,若有少量固体未溶解,可加少量水使其溶解。
有机化学实验报告学院化学化工学院班级12化师姓名学号成绩实验日期指导老师实验题目乙酰乙酸乙酯的制备一实验目的1、学习乙酰乙酸乙酯的制备原理和方法;2、掌握无水操作及减压蒸馏等操作。
二实验原理利用Claisen缩合反应,将两分子具有α-氢的酯在醇钠的催化作用下可以制得β-酮酸酯,其反应如下:1、通常以酯和金属钠为原料,且酯过量(同时作为溶剂),钠为计量依据物。
2、利用酯中含有的微量醇与钠反应来生成醇钠,随着反应的进行,醇不断生成,钠不断溶解,醇钠不断产生,反应能不断进行,直至钠消耗完毕。
作为原料的酯中含醇量过高又会影响产率的得率,一般要求酯中的含醇量在3%以下。
3、反应体系中如有水存在,对反应不利。
钠的损失降低了产率,也抑制了反应的进行,故要求反应体系无水。
4、反应中使用钠珠或钠丝可使其与酯的接触面增大,故先用二甲苯作溶剂制成细小的钠珠,以利于反应的进行。
乙酰乙酸乙酯在常压蒸馏下很易分解,产生“去水乙酸”,故应采用减压蒸馏法。
三、主要试剂及产物的物理常数试剂名称性状分子量M密度熔点(mp/℃)沸点(bp/℃)折射率(n D20)溶解度乙酰乙酸乙酯有果子香味无色或微黄色透明液体130.14 1.025 -45~-43180.4分解1.4194溶于水,能与一般有机溶剂混溶乙酸乙酯有果子香气无色可燃性液体88.12 0.9005 -83.6 77.1 1.3723微溶于水,溶于乙醇、乙醚、氯仿和苯等甲苯无色易挥发液体有芳香气味92.14 0.866 -95 110.8 1.4967不溶于水,溶于乙醇、乙醚和丙酮主要试剂及用量名称规格用量备注g mL mol金属钠去掉表面氧化膜0.9 0.04二甲苯干燥 5乙酸乙酯精制10 0.1醋酸50% 调pH5~6食盐水饱和等体积醋酸用量苯8 萃取用四实验装置图图2:减压蒸馏装置图五、实验步骤及现象记录步骤现象备注钠珠的制备:干燥的圆底烧瓶中放入0.9g去掉表面氧化膜的金属钠、5ml干燥的二甲苯,冷凝回流加热至Na熔融塞紧塞子,趁热振荡,得细粒状钠珠,冷却至室温,倾去二甲苯由于二甲苯温度逐渐下降,蒸气压随之下降,因此,要不时开启瓶盖或在瓶口夹一纸条,否则塞子难以打开。