伪狂犬病检测方法
- 格式:doc
- 大小:317.00 KB
- 文档页数:10


山东畜牧兽医2017年第38卷伪狂犬病毒的分离鉴定姚红(山东省东平县畜牧兽医局 271500)摘要 本研究对疑似伪狂犬病猪的病料进行分离鉴定,通过细菌学鉴定、病毒提取培养、电镜观察、动物试验和中和试验。
结果表明,所取病料分离鉴定出伪狂犬病毒。
关键词伪狂犬病毒分离鉴定中图分类号:S852.65+5 文献标识码:A 文章编号:1007-1733(2017)12-0016-02猪的伪狂犬病是由狂犬病病毒(PRV)引起的一种危害严重的急性败血性传染病,主要以新生仔猪的急性死亡及4周龄以上的仔猪表现神经病状为特征。
1 材料及方法1.1 材料1.1.1 病料在周边猪场采集临床表现有发热、昏迷、神经症状等症状的疑似伪狂犬病的死猪中,在脑部取样。
细胞株猪肾传代细胞(PK-15),由吉林大学畜牧兽医学院病理实验室保存。
1.1.2 主要试剂健康猪的经脉血液,采自附近猪场;葡萄糖、氯化钠、枸橼酸钠、枸橼酸、氯化钾、碳酸氢钠、氢氧化钠、无水乙醇、青霉素、链霉素、酚红、DMEM(Dulbecco’s Modified Eagle Medium)粉剂;胰蛋白酶,购自长春宝泰克生物制品有限责任公司;胎牛血清(FCS),购自中国医学科学院血液学研究所。
1.1.3 主要器材各型微量可调移液器、生物显微镜、96孔培养板、WZ-2A微量振荡器、DK-8D型电热恒温箱、PCR扩增仪(Gene Amp PCR System 9600,Biometra)、TY600C型电泳仪、电泳槽,凝胶成像系统,70P-72型超速离心机,DW-40L262型立式医用冰箱,GZX-9070 MBE 数显鼓风干燥箱,BS124S型电子分析天平,DL-CJ-IN型超净工作台,MCO-17AI型CO2培养箱,JEM-1200EXII投射电子显微镜,数码照相机,一次性滤器(仪器精密度为0.22µm)。
1.1.4 各种溶液的配制DMEM营养液的配制、D-Hanks 液的配制、0.25%的胰酶的配制、PBS液的配制、革兰氏染色液的配制(结晶紫溶液、(路)卢戈碘液、脱色剂、番红花红染色液),以上液体由试验组配制完成。



2020.3作者简介:张晓亭(1982-),男,河南省许昌市人,兽医师,研究方向:动物疫病防控。
两种检测猪伪狂犬病gB 抗体方法比较张晓亭(河南省许昌市建安区动物疫病预防控制中心461000)摘要:为评价化学发光免疫分析法在临床检测猪伪狂犬病gB 抗体中的适用性,将其与IDEXX 公司ELISA 抗体检测方法进行比对试验。
对110份猪血清进行猪伪狂犬病gB 抗体化学发光免疫分析法与ELISA 法的检测。
结果显示,以ELISA 法为标准,化学发光免疫分析法检测猪伪狂犬病gB 抗体的灵敏度、特异性、符合率分别为98.31%、100%、99.10%,Kappa=0.96,说明化学发光免疫分析法与ELISA 法的符合率较高,且其操作步骤更简便,更省时,可以用于临床猪血清样品的猪伪狂犬病gB 抗体的检测。
关键词:猪伪狂犬病gB ;抗体;方法;比较猪伪狂犬病(Pseudorabies)是由猪伪狂犬病病毒(Pseu⁃dorabies virus,PrV)引起的可致妊娠母猪流产、种公猪不育、育肥猪生长停滞、仔猪死亡的一种急性传染病[1]。
一旦猪场发生该病,将给养殖户带来巨大的经济损失。
目前还没有有效的方法治疗该病,疫苗免疫接种是预防与控制该病的根本措施。
而血清抗体水平检测可以反映出猪群的免疫抗体水平,对猪场免疫程序的制订具有一定指导意义[2]。
目前,国标上推荐的方法依然是ELISA,ELISA 方法具有快速、简便、特异性好等优点,是当前常用的适合大规模应用的抗体检测方法。
化学发光免疫分析法结合了抗体免疫方法与化学发光技术,其灵敏度更高,已广泛应用于医学、环境监测、食品检测等方面。
为了解化学发光免疫分析法在检测猪伪狂犬病gB 抗体方面的应用价值,本实验将某国产猪伪狂犬病病毒gB 化学发光抗体检测试剂盒(化学发光免疫分析法)与美国IDEXX 公司生产的猪伪狂犬病病毒gB 抗体ELISA 检测试剂盒进行比较分析,以期为临床猪血清样品猪伪狂犬病gB 抗体的检测寻找更为简便、快速且准确的检测方法。

PCR快速检测伪狂犬病病毒野毒感染周斌;苏鑫铭;张素芳;贾赟;曹瑞兵;陈溥言【期刊名称】《中国病毒学》【年(卷),期】2004(019)006【摘要】根据已发表的伪狂犬病病毒(PrV)gE、gI基因的序列,设计并合成了一对引物,以PrV容A株细胞培养毒为模板,筛选最佳反应条件和试剂工作浓度,建立了区分PrV野毒株和疫苗弱毒的鉴别PCR方法.该方法能从PrV容A株(RA)、上海株(SH)、鲁A株(LA)中扩增出一条848bp的片段,但Bartha-K61株没有扩增出该片段.测序结果表明PCR扩增产物和方法的特异性.对正常细胞与其它6种引起猪病毒性疫病相关病毒进行检测,结果均为阴性,没有出现交叉反应.对PrV容A株细胞毒提取物DNA进行检测,其最低检出量为5pg.PCR对感染野毒的发病猪不同组织器官检测发现,淋巴结检出率最高,依次为脾、脑(海马角)、肺、肾、肝等.对2003~2004年期间江苏、浙江、安徽、福建、上海等省市的37个大中型猪场送检的172份病料进行PCR检测病料阳性率为20.34%(35/172),猪场阳性率为40.54%(15/37).实验结果表明所建立的PCR技术可用于伪狂犬病野毒感染的快速鉴定和流行病学调查.【总页数】4页(P612-615)【作者】周斌;苏鑫铭;张素芳;贾赟;曹瑞兵;陈溥言【作者单位】南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095;南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095;南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095;南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095;南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095;南京农业大学农业部动物疫病诊断与免疫重点开放实验室,江苏,南京,210095【正文语种】中文【中图分类】R373.9【相关文献】1.鉴别伪狂犬病病毒野毒与疫苗毒荧光定量PCR方法的建立 [J], 赵丽;崔保安;陈红英;魏战勇;郑兰兰;吕晓丽;贾艳艳;赵绪永2.鉴别猪伪狂犬病病毒野毒与疫苗毒双重PCR检测方法的建立 [J], 赵丽;卢婷婷;李存法;陈忠杰;连瑞丽3.鉴别猪伪狂犬病病毒gE基因缺失疫苗和野毒感染的二重PCR诊断方法的建立和应用 [J], 赵雪丽;闫若潜;吴志明;曹伟伟;王淑娟;谢彩华;马震原;周兵强;王东方4.伪狂犬病病毒野毒感染快速检测方法的比较 [J], 杨红杰;李雪明;于红欣;邹战明;杨倩;周双海5.猪伪狂犬病病毒野毒LNA探针real-time PCR检测方法的建立 [J], 李艳;李春玲;楚品品;雷雯;勾红潮;蒋智勇;蔡汝健;宋帅;卞志标;杨东霞因版权原因,仅展示原文概要,查看原文内容请购买。

十一、伪狂犬病检测方法伪狂犬病病毒分离鉴定1 材料准备DMEM培养基、 BHK-21细胞、新生犊牛血清、青霉素、链霉素溶液、培养箱、倒置显微镜。
溶液配制见附录0.22ul微孔滤膜、细胞培养瓶、 CO2A(标准的附录)2 操作步骤2.1病料的采集对于刚死亡或活体送检并处死的动物, 无菌采取肝、脾、肺、肾及其脑组织, 特别是三叉神经节、嗅球, 4℃送实验室检测。
2.2样品处理待检组织在灭菌乳钵内剪碎, 加入灭菌玻璃砂研磨, 用灭菌生理盐水或DME培养基制成1: 5乳剂, —70℃重复冻融后, 经3000rpm离心30分钟后, 取上清液经0.22μm微孔滤膜过滤后, 加入青链霉素溶液至最终浓度为100U/mL, —70℃保存作为接种材料。
2.3 病料接种将病料滤液接种已长成单层的BHK-21细胞, 接种量为培养基量的10%, 37℃恒温箱中吸附1小时后, 加入含10%新生犊牛血清( 经过56℃水浴灭活30分钟, 过滤除菌, 无支原体) 的DMEM培养基, 置37℃温箱中培养。
2.4观察结果接种后24—48小时, BHK-21细胞应出现典型的细胞病变效应( Cyto pathogenic effect, CPE) , 表现为细胞变圆, 脱落。
如第一次接种不出现CPE, 应将细胞培养物冻融后盲传三代, 如仍无CPE, 则判为伪狂犬病病毒阴性。
2.5病毒的鉴定将出现CPE的细胞培养物重复冻融后, 用聚合酶链式反应、荧光抗体试验等两种方法中任一方法作进一步鉴定。
伪狂犬病聚合酶链式反应1 材料准备:待检组织、组织匀浆器、蛋白酶K, 十二烷基磺酸钠( SDS) , 苯酚、氯仿, 异戊醇( 分析纯) 、 TEN缓冲液。
溶液配制见附录C(标准的附录)引物: 扩增伪狂犬病病毒基因中434—651bp之间217bp基因片段, 由上海生物工程公司合成。
序列为, 上游引物P1: 5’-CAGGAGGACGAGCTGGGGCT-3’,下游引物P2: 5’-GTCCACGCCC-CGCTTGAAGCT-3仪器设备有: 凝胶电泳紫外线检测仪, PCR扩增仪, 电泳仪2操作步骤:2.1 样品的采集: 对于病死或扑杀动物, 取脑组织; 对于待检活猪, 用已灭菌的棉签, 伸入猪鼻腔中, 采取鼻粘液, 即为鼻拭子, 冷藏条件送实验室检测。


猪伪狂犬病的诊断与鉴别方法猪伪狂犬病是由狂犬病毒V系病毒引起的一种新型狂犬病,也被称为马钩菌性狂犬病或伪狂犬病。
猪伪狂犬病在亚洲、欧洲、南美洲等猪养殖区已经成为一种普遍的疾病,对猪养殖业造成了严重的经济损失。
本文将系统地介绍猪伪狂犬病的诊断与鉴别方法。
病原学猪伪狂犬病是一种DNA病毒感染病,其病原体狂犬病毒V系病毒与狂犬病毒同属于家畜及人类中较为常见的病毒。
传染源主要是疑似或确诊养猪场中的猪,且其唾液、尿液、粪便、血液等各种体液均可携带病毒。
病原体可通过直接接触、飞沫传播、皮肤和黏膜等途径进入寄主体内,并在体内大量繁殖、扩散,引起机体免疫反应,影响猪的生长发育,甚至导致死亡。
临床表现猪伪狂犬病的临床症状多样,主要表现为猪的食欲下降、体重下降、行走困难、神经兴奋症状等。
此外,病猪也会表现出食欲旺盛、睡眠质量变差、牙齿外露、鼻唇积液、呼吸急促、害怕光照等症状。
在发病初期,猪伪狂犬病与其他家畜疾病症状十分相似,因此在早期诊断十分困难。
诊断方法猪伪狂犬病的诊断一般采用病理学检查、血清学检查、分子学检查等综合方法。
下面将分别介绍这些检查方法。
病理学检查通过对猪的死亡组织和脑组织进行病理学检查,可发现神经元减少、神经胶质细胞增生、神经元胞质空泡变性、细胞核固缩等特征性改变,有助于病理学诊断猪伪狂犬病。
血清学检查猪伪狂犬病的血清诊断主要是通过血清学检测法进行的。
病毒单克隆抗体可以与感染的病毒结合形成免疫复合物,通过酶标记法、荧光标记法、金标记法等将免疫复合物依次检测、染色和检视,从而确定猪是否感染猪伪狂犬病毒。
分子学检查猪伪狂犬病的分子学检测方法主要是通过PCR技术对病毒核酸进行扩增和分析,以确认病猪体内是否存在病毒。
PCR技术检测猪伪狂犬病的敏感性和特异性都比较高,因此其检测结果较为可靠。
鉴别方法鉴别猪伪狂犬病的方法主要是通过病型鉴别、病原学鉴别、血清学鉴别、分子学鉴别等多种方法进行筛选。
下面将分别介绍这些鉴别方法。

伪狂犬病病毒gE基因荧光定量PCR检测方法的建立李雪明;于红欣;杨红杰;王俊;周双海【摘要】伪狂犬病病毒(PRV)野毒有gE基因,而其疫苗毒株无gE基因,这为检测有无PRV野毒感染提供参考.用PCR方法扩增PRV的gE基因片段,构建含有PRV gE基因片段的重组质粒.以系列稀释后的重组质粒作为模板,应用SYBR Green I来进行检测PRV gE基因的实时荧光定量PCR扩增.结果显示:在(6.9×107~6.9×101) copies/μL范围内,相邻扩增曲线之间间距均匀,所有产物具有单一整齐的熔解曲线峰,标准曲线具有优良的线性关系.该方法最低可准确检测69 copies/μL 的核酸模板,重复性试验的变异系数小于2%,对PRV-gE基因缺失疫苗毒株和常见猪源DNA病毒的检测结果均为阴性,对临床样品的检出率高于常规PCR方法.研究结果表明,建立了1种特异性强、灵敏度高、重复性好的检测PRV gE基因的SYBR Green I荧光定量PCR方法,可用于PRV野毒感染的定量检测.【期刊名称】《北京农学院学报》【年(卷),期】2015(030)004【总页数】4页(P74-77)【关键词】伪狂犬病病毒;gE基因;荧光定量PCR;伪狂犬病病毒野毒【作者】李雪明;于红欣;杨红杰;王俊;周双海【作者单位】北京农学院动物科学技术学院,北京102206;北京市顺义区动物疫病预防控制中心,北京101300;北京农学院动物科学技术学院,北京102206;北京农学院动物科学技术学院,北京102206;北京市顺义区动物疫病预防控制中心,北京101300;北京农学院动物科学技术学院,北京102206;北京农学院动物科学技术学院,北京102206【正文语种】中文【中图分类】S852.65伪狂犬病病毒(pseudorabies virus,PRV)是双链DNA病毒,属于疱疹病毒科,能够感染多种家畜和野生动物;PRV对猪的危害最大,PRV感染可引起种猪繁殖障碍及哺乳仔猪大批死亡,年龄较大的猪则多系隐性感染,但可长期带毒排毒[1]。
飞沫感染狂犬病-伪狂犬病怎么检测伪狂犬病怎么检测伪狂犬病的流行病学特征这种疾病是一种急性传染病,可被多种家畜和野生动物感染。
猪在家畜中更常见,但狗也可能被感染。
当疾病在养猪场爆发时,狗经常在猪之前或同时出现。
其病原体是伪狂犬病病毒。
因为这种疾病与狂犬病有相似的症状,所以以前被认为是与狂犬病相同的疾病。
后匈牙利学者阿胡杰斯基证明,这种疾病与狂犬病不是同一种疾病,而是一种独立的疾病,所以也称为阿尔茨海默病。
因此,病猪是各种动物的传染源。
狗经常在吃了病猪肉或死鼠肉后被感染。
病狗虽然致死率高,但是不能解毒。
该病主要通过消化道感染,但也可通过呼吸道和皮肤伤口感染。
伪狂犬病病毒对外界环境有很强的抵抗力。
但是这种病毒对化学药物不是很有抵抗力,比如石灰乳、盐酸、氢氧化钠、等。
可以快速。
伪狂犬病诊断要点(1)流行特征猪和小鼠是该病最重要的传染源,其他动物的感染主要与接触这两类动物有关。
从感染猪的角度来看,狗的自然感染与饲养感染该病毒的啮齿动物有关,饲养感染该病的牛、羊肉也是二次感染途径。
此外,它还可以被飞沫和伤口感染。
这种病是散发的,有些是区域性的。
)和流行特征,可以做出初步诊断。
对于症状不典型的病例,单靠临床诊断是很难确诊的。
伪狂犬病的防控措施第一,禁止狗进入猪场。
第三,生病的狗要及时隔离。
有条件的话可以给狗注射抗伪狂犬病的高度免疫血清,有一定疗效。
患病犬的粪便应及时清洗消毒。
第四,根据犬猪接触情况和吃猪肉的情况进行接种。
2ml;5ml,3周后再一次,剂量为1ml。
犬瘟热感染的几种原因小鹿犬犬瘟热是犬类第一类传染性疾病,严重威胁狗狗生命健康的急性传染病。
?具体下面一一介绍。
一、飞沫传染这是一种比较常见的传染犬瘟热的途径。
当您带着您的狗狗在人员密集和众多的狗爸爸妈妈们一起聊天时,也许您的狗狗和众多的狗狗一起玩时被病犬感染了。
因为犬瘟热病毒可以通过喷嚏、飞沫等随着空气一同感染健康的狗狗。
二、间接传染。
这主要通过人类或者其他东西导致健康的狗狗感染犬瘟热。
伪狂犬诊断标准伪狂犬病是一种由伪狂犬病毒引起的急性传染病,主要侵害动物的神经系统和呼吸道。
这种病毒可以感染多种动物,包括猪、狗、猫、牛、羊等。
伪狂犬病会导致动物的死亡和严重的经济损失。
因此,建立伪狂犬病的诊断标准对于预防和治疗这种疾病非常重要。
一、引言伪狂犬病是一种高度传染性的疾病,对于动物的健康和生命安全造成了极大的威胁。
为了准确诊断伪狂犬病,及时采取有效的防治措施,降低经济损失,制定本标准。
二、范围本标准适用于伪狂犬病的诊断和鉴别诊断,包括临床诊断、病理学诊断、实验室诊断等方法。
三、规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
1.GB/T 18640-2018 动物疫病诊断与防治规范总则2.GB/T 27985-2011 动物病毒检测规范3.GB/T 36879-2018 动物疫病监测技术规范四、诊断标准1.临床诊断:伪狂犬病可导致动物的神经系统和呼吸道症状,包括不安、惊厥、流涎、呕吐、咳嗽等症状。
在临床诊断中,应注意与狂犬病等其他类似疾病的鉴别诊断。
2.病理学诊断:伪狂犬病毒感染会导致动物的组织病变,包括神经元变性、坏死和炎症反应等。
病理学诊断可通过观察组织病变的特征性表现进行确诊。
3.实验室诊断:实验室诊断是伪狂犬病确诊的主要方法之一。
可采用的方法包括聚合酶链式反应(PCR)、反转录聚合酶链式反应(RT-PCR)、核酸杂交等分子生物学方法,以及病毒分离、血清学检测等传统方法。
其中,PCR等分子生物学方法具有高灵敏度和特异性,可用于检测伪狂犬病毒的特异性基因片段。
血清学检测可检测动物血清中的特异性抗体,用于评估免疫状态和流行病学调查。
4.鉴别诊断:伪狂犬病应与狂犬病、猪脑炎等其他神经系统疾病进行鉴别诊断。
这些疾病也具有类似的临床症状和病理学表现,但病原不同。
鉴别诊断可通过临床症状、病理学检查和实验室检测等方法进行综合判断。
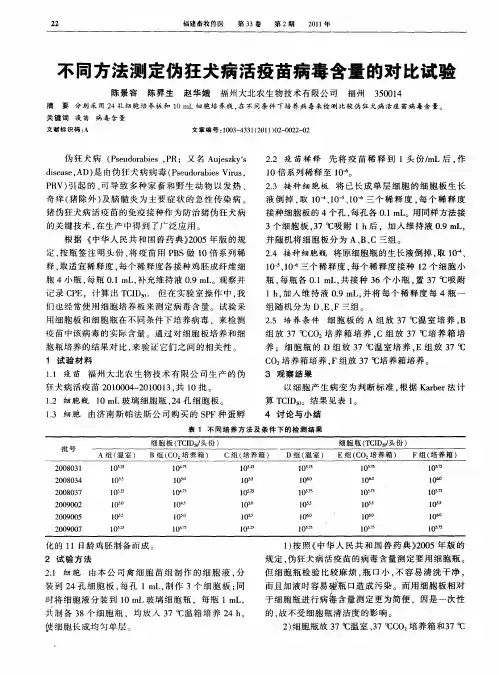
十一、伪狂犬病检测方法伪狂犬病病毒分离鉴定1 材料准备DMEM培养基、BHK-21细胞、新生犊牛血清、青霉素、链霉素溶液、0.22ul 微孔滤膜、细胞培养瓶、CO2培养箱、倒置显微镜。
溶液配制见附录A(标准的附录)2 操作步骤2.1病料的采集对于刚死亡或活体送检并处死的动物,无菌采取肝、脾、肺、肾及其脑组织,尤其是三叉神经节、嗅球,4℃送实验室检测。
2.2样品处理待检组织在灭菌乳钵内剪碎,加入灭菌玻璃砂研磨,用灭菌生理盐水或DME培养基制成1:5乳剂,—70℃反复冻融后,经3000rpm离心30分钟后,取上清液经0.22μm微孔滤膜过滤后,加入青链霉素溶液至最终浓度为100U/mL,—70℃保存作为接种材料。
2.3 病料接种将病料滤液接种已长成单层的BHK-21细胞,接种量为培养基量的10%,37℃恒温箱中吸附1小时后,加入含10%新生犊牛血清(经过56℃水浴灭活30分钟,过滤除菌,无支原体)的DMEM培养基,置37℃温箱中培养。
2.4观察结果接种后24—48小时,BHK-21细胞应出现典型的细胞病变效应(Cyto pathogenic effect, CPE),表现为细胞变圆,脱落。
如第一次接种不出现CPE,应将细胞培养物冻融后盲传三代,如仍无CPE,则判为伪狂犬病病毒阴性。
2.5病毒的鉴定将出现CPE的细胞培养物反复冻融后,用聚合酶链式反应、荧光抗体试验等两种方法中任一方法作进一步鉴定。
伪狂犬病聚合酶链式反应1 材料准备:待检组织、组织匀浆器、蛋白酶K,十二烷基磺酸钠(SDS),苯酚、氯仿,异戊醇(分析纯)、TEN缓冲液。
溶液配制见附录C(标准的附录) 引物:扩增伪狂犬病病毒基因中434—651bp之间217bp基因片段,由上海生物工程公司合成。
序列为,上游引物P1:5’-CAGGAGGACGAGCTGGGGCT-3’,下游引物P2:5’-GTCCACGCCC-CGCTTGAAGCT-3仪器设备有:凝胶电泳紫外线检测仪,PCR扩增仪,电泳仪2操作步骤:2.1 样品的采集:对于病死或扑杀动物,取脑组织;对于待检活猪,用已灭菌的棉签,伸入猪鼻腔中,采取鼻粘液,即为鼻拭子,冷藏条件送实验室检测。
十一、伪狂犬病检测方法伪狂犬病病毒分离鉴定1 材料准备DMEM培养基、BHK-21细胞、新生犊牛血清、青霉素、链霉素溶液、0.22ul 微孔滤膜、细胞培养瓶、CO2培养箱、倒置显微镜。
溶液配制见附录A(标准的附录)2 操作步骤2.1病料的采集对于刚死亡或活体送检并处死的动物,无菌采取肝、脾、肺、肾及其脑组织,尤其是三叉神经节、嗅球,4℃送实验室检测。
2.2样品处理待检组织在灭菌乳钵内剪碎,加入灭菌玻璃砂研磨,用灭菌生理盐水或DME培养基制成1:5乳剂,—70℃反复冻融后,经3000rpm离心30分钟后,取上清液经0.22μm微孔滤膜过滤后,加入青链霉素溶液至最终浓度为100U/mL,—70℃保存作为接种材料。
2.3 病料接种将病料滤液接种已长成单层的BHK-21细胞,接种量为培养基量的10%,37℃恒温箱中吸附1小时后,加入含10%新生犊牛血清(经过56℃水浴灭活30分钟,过滤除菌,无支原体)的DMEM培养基,置37℃温箱中培养。
2.4观察结果接种后24—48小时,BHK-21细胞应出现典型的细胞病变效应(Cyto pathogenic effect, CPE),表现为细胞变圆,脱落。
如第一次接种不出现CPE,应将细胞培养物冻融后盲传三代,如仍无CPE,则判为伪狂犬病病毒阴性。
2.5病毒的鉴定将出现CPE的细胞培养物反复冻融后,用聚合酶链式反应、荧光抗体试验等两种方法中任一方法作进一步鉴定。
伪狂犬病聚合酶链式反应1 材料准备:待检组织、组织匀浆器、蛋白酶K,十二烷基磺酸钠(SDS),苯酚、氯仿,异戊醇(分析纯)、TEN缓冲液。
溶液配制见附录C(标准的附录) 引物:扩增伪狂犬病病毒基因中434—651bp之间217bp基因片段,由上海生物工程公司合成。
序列为,上游引物P1:5’-CAGGAGGACGAGCTGGGGCT-3’,下游引物P2:5’-GTCCACGCCC-CGCTTGAAGCT-3仪器设备有:凝胶电泳紫外线检测仪,PCR扩增仪,电泳仪2操作步骤:2.1 样品的采集:对于病死或扑杀动物,取脑组织;对于待检活猪,用已灭菌的棉签,伸入猪鼻腔中,采取鼻粘液,即为鼻拭子,冷藏条件送实验室检测。
2.2样品处理所采病料经组织研磨器充分研磨,按1:5用TEN缓冲液悬浮收集于离心管内,-70℃反复冻融3次,7000r/min离心5min,如样品为鼻试子,则加入2ml TEN缓冲液,充分挤压,取出棉签,7000rpm,离心5分钟,取上清液。
取上清液472.5μl,加入25μl 10%SDS和2.5μl的20mg/ml 蛋白酶K,50℃水浴摇床上放置2h后加入等量的饱和酚500μl,涡旋20s。
离心取上清液,加等量的酚:氯仿:异戍醇(25:24:1)抽提一次,再用氯仿:异戍醇(24:1)抽提一次,最后用乙醇沉淀,真空抽干后加入20μl双蒸水溶解,-20℃贮存备用。
2.3. PCR的操作程序先将制备的模板DNA置100℃水浴10分钟作变性处理,,然后立即放于冰浴中。
PCR反应体系为:总体积25μl,含有50m •mol/L KCl,10m mol/L Tris-HCl(pH 9.0),0.1%Triton X-100•,•100•μmol/L dNTPs,0.35μmol/L引物,2 m mol/L MgCl2,及0.5U Taq酶,1μl模板DNA。
常用的反应体系组成如下10×缓冲液 2.5 μl15mM MgCl2 2.5 μldNTPs 2.0 μl引物各2.0μlTaq聚合酶 1.0μlDNA模板 2.0μl灭菌去离子水 11.0μl矿物油约 20μl扩増条件为:94℃变性3分钟,进入循环,94℃60秒,65℃60秒,72℃60秒,40个循环后72℃延伸5分钟。
2.4 PCR产物的检测PCR扩增产物在1%的琼脂糖凝胶上电泳,溴化乙锭染色,在紫外光下观察结果。
为进一步进行PCR扩增产物的特异性鉴定,可取PCR产物用SalI酶切,酶切产物在2%琼脂糖凝胶上电泳,EB染色,在紫外光下观察并与标准分子量比较,可见产生的140bp和77bp两个片段。
伪狂犬病荧光抗体试验1材料准备:碳酸盐缓冲甘油、磷酸盐缓冲液、丙酮(分析纯),伪狂犬病荧光抗体、冰冻切片机,荧光显微镜。
溶液配制见附录D(标准的附录)2操作步骤2.1样品采集扑杀可疑动物,取大脑、淋巴结、扁桃体迅速送检实验室,如不能及时送出,必须冻结保存,避免腐败、自溶。
本法也可用于对疑似伪狂犬病病毒的培养物进行鉴定。
2.2切片制备将样品组织块切成1cm ×1cm的面,不经任何固定处理,直接贴于冰冻切片托上,进行切片,切片厚度要求5—7um,将切片展贴于0.8mm ×1mm厚的洁净载玻片上。
2.3固定:将切片置纯丙酮中固定15分钟,取出立即放入0.01mol/L,pH7.2的磷酸盐缓冲液中,轻轻漂洗3—4次,取出,自然干燥后尽快进行荧光抗体染色。
2.4 染色将伪狂犬病荧光抗体滴加于切片表面,置温盒内于37℃作用30分钟,取出后放入磷酸盐缓冲液中充分漂洗,再用0.5moL/L,pH9.0—9.5碳酸盐缓冲甘油封固盖片(0.1mm厚),染色后应尽快镜检,必要时可放置低温待检。
2.5观察将染色后的切片标本置激发光为蓝紫光或紫外光的荧光显微镜下观察。
2.6判定:于荧光显微镜视野中,见细胞中出现明亮的黄绿色荧光,判为伪狂犬病病毒感染阳性。
伪狂犬病微量中和试验(固定病毒,稀释血清法)1 材料准备0.25%胰酶(配制见附录B)、BHK-21细胞,多道可调微量移液器, ,96孔细胞培养板,CO2培养箱, 倒置显微镜。
2 操作步骤2.1 病毒半数组织细胞感染量(TCID50)的测定:2.1.1 病毒培养和收获将伪狂犬病毒接种于长成单层的BHK-21细胞,接种量为液体培养基量的10%,37℃培养,待出现病变后,冻融,收获病毒。
2.1.2 病毒的滴定用DMEM培养基将伪狂犬病病毒作连续10倍稀释,即10—1、10—2……每个稀释度取100μL加入96孔细胞培养板中,随后加入经0.25%胰酶消化的BHK-21细胞100μL(细胞含量以105/mL左右为宜),每个稀释度作8个重复,并设空白细胞培养对照。
置37℃5%CO2培养箱中。
2.1.3 TCID50计算逐日观察细胞病变,并记录细胞病变孔数,直到对照细胞老化脱落为止。
按照Reed-Muench法计算病毒的TCID50(具体的计算示例见附录B)。
2.2中和试验将无菌采集的待检猪血清置56℃水浴灭活30分钟。
用DMEM 培养基作倍比稀释,在细胞培养板各孔中加入50μL培养基,随后在第一孔中加入经待检猪血清50μL混合后,用微量移液器取出50μL,加到第二孔中,混匀后取出50μL再加入第三孔中,依此类推。
血清稀释度即为1:2、1:4、1:8……,每份待检血清稀释度作2—4个重复。
将50μL含200个TCID50的病毒液加入到不同稀释度血清孔中,37℃作用1小时,每孔中再加入100μL经胰酶消化分散的BHK-21细胞,同时设病毒对照、阳性血清、阴性血清,待检血清、正常细胞对照。
2.3计算抗体中和效价逐日观察,直至细胞对照出现老化脱落为止,按Reed-Muench两氏法,计算抗体中和效价。
如抗体效价为1:2及1:2以上,则判为伪狂犬病抗体阳性。
伪狂犬病酶联免疫吸附试验(间接法)1材料准备:抗原、酶标抗体,底物(OPD—H2O2),酶联免疫检测仪;溶液配制见附录F(标准的附录)2 操作步骤:2.1 包被将PRV抗原加入酶标板孔内,每孔100uL,37℃作用1h后置4℃冰箱过夜。
2.2 洗涤弃去孔内液体,用洗涤液洗3次,每次3min,用吸水纸拍干2.3 封闭各孔加入封闭液100uL 37℃作用1h。
按2.2步骤洗涤2.4 加入待检血清待检血清经56o C30分钟灭活将待检血清用洗涤液稀释,每孔100uL,37℃作用1h。
重复2.2步骤。
2.5 加入酶标抗体用洗涤液将酶标抗体按工作浓度稀释,每孔100uL,37℃作用1h。
重复2.2步骤。
2.6 加入底物(OPD-H22):每孔100uL,室温避光显色25分钟。
2.7 终止反应每孔加入50uL终止液终止反应。
2.8 测定OD值在酶联免疫检测仪上490nm波长处读数。
2.9血清阴阳性判定标准的确定取60份经中和试验检测为PRV抗体阴性的猪血清,按1:20稀释后进行间接ELISA试验,测定490nm波长处OD值,规定以60份血清的平均OD值加上3倍标准差作为判定阴阳性的临界值。
伪狂犬病乳胶凝集试验1材料准备:伪狂犬病乳胶凝集抗原、伪狂犬病阳性血清、阴性血清、稀释液,玻片,溶液配制见附录E(标准的附录)2操作步骤:2.1待检血清不须经热灭活或其它方式的灭活处理2.2将待检血清用稀释液作倍比稀释后,各取15μL与等量乳胶凝集抗原在洁净干燥的玻片上用竹签搅拌充分混合,在3—5分钟内观察结果;可能出现以下几种凝集结果,即:100%凝集:混合液透亮,出现大的凝集块75%凝集:混合液几乎透明,出现大的凝集块50%凝集:约50%乳胶凝集,凝集颗粒较细25%凝集;混合液浑浊,有少量凝集颗粒0%凝集:混合液浑浊,无凝集颗粒出现如出现50%凝集程度以上的(含50%凝集程度),判为伪狂犬病抗体阳性,否则判为抗体阴性。
如为阴性,可用微量中和试验进一步检测。
伪狂犬病琼脂扩散试验1材料准备琼脂扩散抗原、阴性血清和阳性血清;优质琼脂粉、平皿2操作步骤2.1 0.8%琼脂板的制作将1克琼脂粉溶于100毫升Tris─盐酸缓冲液(Tris 6.5克, NaCl 2.9克, NaN3 0.2克, 蒸馏水 1000毫升, 用HCl调pH值至7.2)中,趁热倾倒于玻璃平皿上,厚度为2—3mm,待冷却凝集后,打孔,中央一孔,周围6孔,孔径为2mm,周围孔之间距离2mm,周围孔与中央孔间距为4mm—6mm,用酒精灯微热封底。
2.2加样将琼脂扩散抗原加到中央孔中,周围孔加经热灭活的待检血清,设阴性血清和阳性血清对照。
置温盒37℃作用,24—48小时后观察结果。
2.3结果判定在抗原孔与待检血清孔之间出现白色沉淀线,抗体可判为阳性;如待检血清抗体水平较低,可以观察到与待检血清相邻的阳性血清沉淀线末端略向抗原抗弯曲。
阴性血清与抗原孔之间则没有沉淀线。
伪狂犬病区分强弱毒感染鉴别乳胶凝集试验1.猪伪狂犬病gG鉴别诊断乳胶凝集试验伪狂犬病gG鉴别诊断乳胶凝集试验是用伪狂犬病毒gG基因的基因工程表达产物致敏乳胶抗原来检测动物血清、全血或乳汁中抗gG蛋白的抗体。
用于伪狂犬病毒感染猪与gG基因缺失疫苗注苗猪的免疫学鉴别诊断。
1.1材料准备:伪狂犬病毒gG蛋白致敏乳胶抗原、伪狂犬病毒致敏乳胶抗原、伪狂犬病毒阳性血清和注射gG基因缺失疫苗血清、玻片、吸头等。