化工原理(天大版)---(下册)第二章 吸收
- 格式:ppt
- 大小:1.84 MB
- 文档页数:59




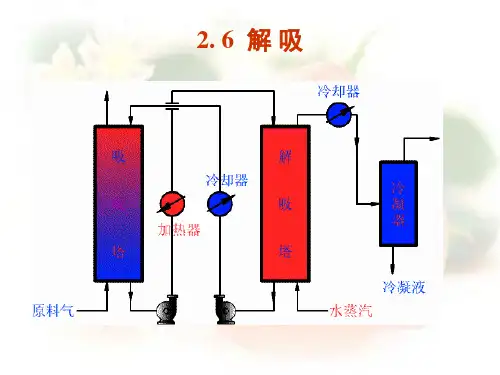

---------------------------------------------------------------最新资料推荐------------------------------------------------------1 / 10化工原理下册课件第二篇 章 吸收第6次课解吸及其他条件下的吸收2. 6 解 吸 2. 6 解 吸 一、概述 1 、作用: ① ① 吸收剂的再生,以便循环使用; ② 回收溶质,得到分离后气体。
2 、解吸常用的方法:压力低,温度高,有利于脱吸 加热溶液(加热解吸) ,增大溶液中溶质的 平衡分压 用水蒸汽(气提) ,加热、降低气相中溶质的 分压 ;适用于溶质为不凝性气体,或溶质冷凝液不溶于水 通惰性气体(惰性气体气提) ,降低操作压力,主要用于吸收剂的再生,不能直接得到纯净的溶质组分。
Y=mX B A X 1 X 2 Y 2 * Y 2 Y 1 1、 、 物料衡算:-=-=二 、解吸塔的计算 解吸过程的操作线总是在平衡线的下方, 解吸过程的推动力是吸收的相反值。
2 、操作线方程:3 、最小气液比:4 、填料层高度的求法:Z=H OG N OG =H OL N OL ((1 )对数平均推动力法((2 )吸收因数法:-=AY YY YAANOL *1 1*2 1) 1 ( ln11-=2.7 强化吸收过程的途径从从可以看出,影响吸收的主要因素: K Y 、吸收推动力和相接触面积。
吸收过程的主要阻力集中在滞流膜上。
要提高吸收总系数, 必须设法降低气膜和液膜的厚度。
通过加大流体的流动速度,增加流体的湍动程度,则可减小滞流膜层的厚度。
一、提高吸收总系数K Y ( 或K G ) 或K X ( 或K L ) 三、增大单位吸收传质面积面积主要由设备来决定,对于填料塔,应该注意:填料的选型,应尽量选比表面积大的填料。
增大气液分散度,液体喷淋均匀,填料充分润湿,保证上升气泡和液层充分接触,达到传质目的。





化工原理下2化工原理下册《第二版》天津大学出版社,,这是我们学习化工原理时,部分参考资料,有兴趣的可以看一下!!吸收过程用液体吸收剂吸收气体中某一组分,是该组分从气相转移到液相的传质过程。
它包括三个过程骤:1)该组分从气相主体传递到气、液两相的界面;2)在相界面上溶解而进入液相;3)再从液相一侧界面向液相主体传递;化工原理下册《第二版》天津大学出版社,,这是我们学习化工原理时,部分参考资料,有兴趣的可以看一下!!2.2.6 吸收过程机理一、双膜理论 1.气液两相间存在稳定的相界面,界面两侧各有一层有效膜,溶质以分子扩散的传质方式由气相主体进入液相主体。
2.在相界面处,气液两相达到平衡。
3.在气液两相主体中,溶质浓度均匀。
二、溶质渗透理论三、表面更新理论化工原理下册《第二版》天津大学出版社,,这是我们学习化工原理时,部分参考资料,有兴趣的可以看一下!!2.2.7 吸收速率方程一、膜吸收速率方程式1.气膜分吸收速率方程令则仿效上式,得D P kG RTzG pBm气膜分传质(吸收)系数,kmol/(m2 s kPa)。
N A k y ( y A y Ai )N A kY (YA YAi )化工原理下册《第二版》天津大学出版社,,这是我们学习化工原理时,部分参考资料,有兴趣的可以看一下!!N A kG ( pA pAi )NA k y yA yAi yA yAi NA 1/ ky1/ kG1/ k ypA pAi NA 1/ kG气膜阻力由道尔顿分压定律pA pyApAi pyAiN A kG ( pA pAi ) kG ( pyA pyAi ) kG p ( yA yAi )比较得4k y pkG化工原理下册《第二版》天津大学出版社,,这是我们学习化工原理时,部分参考资料,有兴趣的可以看一下!!1.液膜分吸收速率方程令D' C kL z L CSm液膜分传质(吸收)系数,kmol/(m2 s kmol/m3)。
第二章 吸收习题解答1从手册中查得101.33KPa 、25℃时,若100g 水中含氨1g,则此溶液上方的氨气平衡分压为0.987KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H(kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33NH NH C P H *=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331170.582/100110000.5820.590/()0.987NH NH a NH C kmol m C H kmol m kP P *==+∴===⋅ (2).求m .由333333330.9870.00974101.331170.010*********0.009740.9280.0105NH NH NH NH NH NH NH NH y m x P y Px y m x ****======+===2: 101.33kpa 、1O℃时,氧气在水中的溶解度可用p o2=3.31×106x 表示。
式中:P o2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧.解:氧在空气中的摩尔分数为0.21.故222266101.330.2121.2821.28 6.43103.31106 3.3110O O aO O P Py kP P x -==⨯====⨯⨯⨯ 因2O x 值甚小,故可以认为X x ≈即:2266.4310O O X x -≈=⨯所以:溶解度6522322()()6.431032 1.141011.4118()()kg O g O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。
第二章 吸收1. 从手册中查得101.33 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为0.987 KPa 。
已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。
解:(1) 求H 由33NH NH C P H*=.求算.已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出:以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则:333331/170.582/100110000.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *==+∴===⋅ (2). 求m .由333333330.9870.00974101.331/170.01051/17100/180.00974/0.9280.0105NH NH NH NH NH NH NH NH y m x P y P x m y x ****======+=== 2. 101.33 kpa 、10 ℃时,氧气在水中的溶解度可用p O2=3.31×106x 表示。
式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。
试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。
解: 氧在空气中的摩尔分数为0.21.故:222266101.330.2121.2821.28 6.43103.31106 3.3110O O a O O P Py kP P x -==⨯====⨯⨯⨯ 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=⨯所以:溶解度6522232()6.4310321.1410()/()11.4118()g O kg O kg H O m H O --⎡⎤⨯⨯==⨯=⎢⎥⨯⎣⎦3. 某混合气体中含有2%(体积)CO 2,其余为空气。