高考化学复习资料3
- 格式:doc
- 大小:150.50 KB
- 文档页数:4
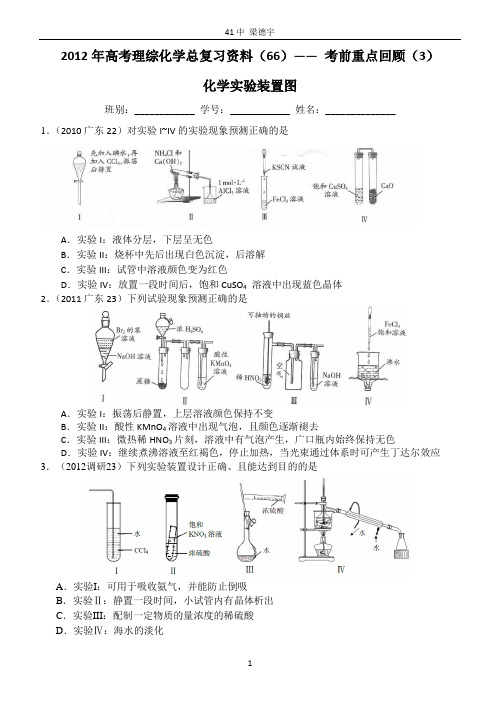
2012年高考理综化学总复习资料(66)——考前重点回顾(3)化学实验装置图班别:____________ 学号:____________ 姓名:______________ 1.(2010广东22)对实验I~IV的实验现象预测正确的是A.实验I:液体分层,下层呈无色B.实验II:烧杯中先后出现白色沉淀,后溶解C.实验III:试管中溶液颜色变为红色D.实验IV:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体2.(2011广东23)下列试验现象预测正确的是A.实验I:振荡后静置,上层溶液颜色保持不变B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应3.(2012调研23)下列实验装置设计正确、且能达到目的的是A.实验I:可用于吸收氨气,并能防止倒吸B.实验Ⅱ:静置一段时间,小试管内有晶体析出C.实验III:配制一定物质的量浓度的稀硫酸D.实验Ⅳ:海水的淡化4.(2012一模23)对于实验Ⅰ~Ⅳ的实验现象预测正确的是A .实验I : 试管中先出现白色胶状物质,后溶解B .实验II : 振荡后静置,下层溶液颜色保持不变C .实验III :抽去中间玻璃片,瓶内产生白烟D .实验IV :BaCl 2溶液变浑浊,品红溶液褪色 5、下列实验Ⅰ~Ⅳ中,正确的是A .实验Ⅰ:配制一定物质的量浓度的溶液B .实验Ⅱ:除去Cl 2中的HClC .实验Ⅲ:用水吸收NH 3D .实验Ⅳ:制备乙酸乙酯6.下列实验不能..达到预期目的的是A .利用Ⅰ制取Fe(OH)2B .利用Ⅱ装置制取C 2H 4C .利用Ⅲ装置进行铜与浓硝酸反应的实验D .利用Ⅳ装置收集NH 3ⅠⅡ NH 3→H 2ⅢⅣ水Ⅲ浓硝酸 ⅡⅠ 4溶液7.(双选)下列装置、操作及说法正确的是A .图1探究NaHCO 3的热稳定性B .图2证明铁生锈与空气有关C .图3定量测定H 2O 2的分解速率D .图4不能..证明CH 3CH 2OH 发生消去反应生成了乙烯8. (双选)下列叙述正确的是A .装置甲可防止铁钉生锈B .装置乙可除去CO 2中混有的SO 2C .装置丙可验证H Cl 气体在水中的溶解性D .装置丁可用于实验室制取乙酸乙酯 9.(双选)下列实验操作或装置正确的是A .I 高温煅烧石灰石B .II 酸碱中和滴定C .III 电解食盐水制Cl 2和H 2D .IV 定容图1 图2 图3 图4410.(双选)关于下列各装置图的叙述中,正确的是①②③④A.实验室用装置①制取氨气B.装置②可用于制备氢氧化亚铁并观察其颜色C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸D.装置④是原电池,锌电极为负极,发生氧化反应11.下图所示的实验方法、装置或操作中正确的是12.下列装置能达到实验目的的是①②③④A.装置①将化学能转化为电能B.图②用于稀释浓硫酸C.装置③可用于分馏石油D.装置④可用于收集氢气13.(2011一模8)下列实验装置设计正确的是盐酸NH4ClCl2干燥氯气A稀释浓硫酸B实验室制氨气C测定盐酸浓度D14.下列实验不能..达到目的的是15.(双选)下列实验装置(固定装置略去)和操作正确的是A.分离CCl4和水B.中和滴定C.合成乙酸乙酯D.中和热的测定16.下列操作或仪器的选用正确的是17. 下列实验装置设计完全正确、且能达到目的的是CBA。
高考有机化学总复习专题一:有机物的结构和同分异构体:(一)有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)依次。
2、电子式的写法:驾驭7种常见有机物和4种基团:7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、结构式的写法:驾驭8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
(留意键的连接要精确,不要错位。
)4、结构简式的写法:结构简式是结构式的简写,书写时要特殊留意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接依次、方式、基团和官能团。
驾驭8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)同分异构体:要与同位素、同素异形体、同系物等概念区分,留意这四个“同”字概念的内涵和外延。
并能娴熟地作出推断。
1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的推断:找对称轴算氢原子种类,留意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:C n H2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。
③、加聚反应。
(三)、炔烃:(1)通式:C n H2n-2(n≥2),代表物CH≡CH,官能团-C≡C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。

2012年高考理综化学总复习资料(3)——物质类别之间的反应1.(2010广东32改)碳酸锂广泛应用于陶瓷和医药等领域.以β-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤I前,β-锂辉石要粉碎成细颗粒的目的是____________________________________。
(2)步骤I中,酸浸过程中发生的化学反应方程式有:_____________________________________________________________________________ ____________________________________________________________________________。
-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na (3)酸浸后得到的酸性溶液中含有Li+、SO24+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
写出加入上述物质时所发生反应的离子方程式:____________________________________________________________。
此时得到的浸出渣的成分是__________________________。
(4)步骤II中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质几种金属离子。
请写出加入石灰乳和Na2CO3溶液所发生反应的方程式:_____________________________________________________________________________ ____________________________________________________________________________。

2023年高考化学知识点归纳总结大全(最
新打印版)
一、物质的组成与结构
- 原子与分子
- 元素周期表
- 化学键与化合价
二、化学反应与化学方程式
- 化学反应的基本概念
- 化学方程式的表示与读写
- 化学方程式的平衡
三、化学计算
- 相对分子质量与摩尔质量计算
- 物质的量与质量的转化计算
- 氧化还原反应计算
四、离子反应与沉淀反应
- 电离与离子
- 溶液中的化学反应
- 沉淀反应的判定与应用
五、氧化还原反应
- 氧化与还原的基本概念
- 氧化还原反应的电子转移过程
- 氧化还原反应的应用
六、酸碱中和反应
- 酸与碱的基本概念
- 酸碱中和反应的基本规律
- 强酸强碱的溶液与中和反应
七、金属与非金属及其化合物- 金属的性质与反应
- 非金属的性质与反应
- 金属与非金属化合物的基本概念
八、有机化学基础知识
- 有机物的基本概念
- 烃及其类别
- 功能团及其命名方法
这份归纳总结大全包含了2023年高考化学考试所需的主要知识点。
阅读和复这些内容将帮助您更好地应对考试,祝您取得优异成绩!
*[高考]: 高级中等教育学校招生全国统一考试。

高考化学复习笔记笔记是最珍贵的课堂记录,也是最清晰的复习资料。
下面是店铺为您带来的高考化学复习笔记,希望对大家有所帮助。
高考化学复习笔记:基本概念与基本理论(一) 物质的组成1、分子和由分子构成的物质⑴分子是构成物质的一种能独立存在的微粒,它保持着这种物质的化学性质分子有一定的大小和质量;分子间有一定距离;分子在不停地运动着(物理变化是分子运动状态改变的结果);分子间有分子间作用(范德华力)。
⑵由分子构成的物质(在固态时为分子晶体)。
一些非金属单质(如H2、O2、Cl2、S、惰性气体等);气态氢化物;酸酐(SiO2除外);酸类和大多数有机物等。
2、原子和由原子构成的物质⑴原子是参加化学变化的最小微粒。
化学反应的实质是原子的拆分和化合,是原子运动形态的变化原子有一定的种类、大小和质量;由原子构成的物质中原子间也有一定间隔;原子不停地运动着;原子间有一定的作用力。
⑵由原子构成的物质(固态时为原子晶体)。
金刚石、晶体硅、二氧化硅、碳化硅(SiC)等。
3、离子和由离子构成的物质⑴离子是带有电荷的原子或原子团。
带正电荷的阳离子如Na+、Fe3+、H3O+、NH4+、[Ag(NH3)2]+等;带负电荷的阴离子如Cl-、S2-、OH-、SO42-、[Fe(CN)6]3- 等。
⑵由离子构成的物质(固态时为离子晶体)。
绝大多数盐类(AlCl3等除外);强碱类和低价金属氧化物等是由阳离子和阴离子构成的化合物。
【注意】离子和原子的区别和联系:离子和原子在结构(电子排布、电性、半径)和性质(颜色,对某物质的不同反应情况,氧化性或还原性等)上均不相同。
阳离子原子阴离子(简单阳、阴离子)(二) 物质的分类1、元素⑴元素是具有相同核电荷数(即质子数)的同一类原子的总称(元素的种类是由核电荷数或质子数决定的)。
人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素,同一元素的不同核素之间互称为同位素。
⑵元素存在状态① 游离态--在单质中的元素由同种元素形成的不同单质--同素异形体,常有下列三种形成方式:组成分子的原子个数不同:如O2、O3;白磷(P4)和红磷等晶体晶格的原子排列方式不同:如金刚石和石墨晶体晶格的分子排列方式不同:如正交硫和单斜硫② 化合态的元素--在化合物中的元素【注意】元素和原子的区别,可从概念、含义、应用范围等方面加以区别。

高考化学复习资料:学会电荷守恒物料守恒质子守恒,搞定90%高考化在线1对1 家教网三好网中小学辅导高考化学复习资料:学会电荷守恒、物料守恒、质子守恒,搞定90%高考化学题!在比较离子浓度大小关系的题目中,我们经常会到溶液中,有关离子浓度的三大守恒关系,即:电荷守恒、物料守恒和质子守恒.学会这三大守恒,会做90%化学题!一、电荷守恒壹基于溶液的电中性原理,我们可以得出以下结论:溶液中所有阳离子所带的正电荷总数,等于所有阴离子所带的负电荷总数。
利用这一对等关系,我们可以写出溶液中有关电荷守恒的离子关系式。
比如:写出NaHCO3溶液中,有关电荷守恒的离子关系式。
解决这一问题,首先要找出所有的阳离子和阴离子:阳离子有:Na+ 、H+ ,阴离子有:OH—、HCO3-、CO32-;其次,我们要明白电荷数与离子数之间的关系,比如:Na+所带正电荷总数,等于Na+数,而CO32-所带的负电荷数,等于CO32-数的2倍。
我们可以写出关系式了,即:c(Na+) + c(H+) = c(OH-) + c(HCO3-) + 2c(CO32-)。
下载更多高中化学学习资料、高考绝密复习总结资料,请关注微信账号:高中化学gaozhonghuaxue100 ;北京高考 bjgk010 ;打开微信搜索关注一下账号你就可获取!在线1对1 家教网三好网中小学辅导二、物料守恒贰一般常用到的有关物料守恒的关系式包括三类:⒈含特定元素的微粒守恒例如:在/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:c + c + c = /L;⒉不同元素间形成的特定微粒比守恒例如:在Na2CO3溶液中,根据Na与C形成微粒的关系有:c = 2[c + c + c]分析:上述Na2CO3溶液中,C原子守恒,n(Na) : n(C)恒为2:13.混合溶液中弱电解质及其对应离子总量守恒例如:相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:2c(Na+)=c(Ac-)+c(HAc)分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
2023年高考化学《酸碱中和滴定的拓展应用与图像分析》基础知识梳理及题型分析一、氧化还原滴定1.原理以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
2.试剂常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
3.指示剂氧化还原滴定的指示剂有三类(1)氧化还原指示剂;(2)专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝;(3)自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。
4.实例(1)酸性KMnO4溶液滴定H2C2O4溶液(2)Na2S2O3溶液滴定碘液[典题示例1] 中华人民共和国国家标准(GB2760—2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。
某兴趣小组用装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A 的名称是__________,水通入A 的进口为________。
(2)B 中加入300.00 mL 葡萄酒和适量盐酸,加热使SO 2全部逸出并与C 中H 2O 2完全反应,其化学方程式为__________________________________________________________。
(3)除去C 中过量的H 2O 2,然后用0.090 0 mol·L -1NaOH 标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH =8.8,则选择的指示剂为________;若用50 mL 滴定管进行实验,当滴定管中的液面在刻度“10”处时,则管内液体的体积(填序号)________(①=10 mL ,②=40 mL ,③<10 mL ,④>40 mL)。
(4)滴定至终点时,消耗NaOH 溶液25.00 mL ,该葡萄酒中SO 2含量为________g·L -1。
高三化学总复习资料高三化学总复习资料高三是每个学生都要经历的一段艰苦的时光,尤其是面对即将到来的高考。
对于理科生来说,化学是其中一门重要的科目。
为了帮助同学们更好地复习化学知识,我整理了一份高三化学总复习资料,希望能对大家有所帮助。
第一部分:基础知识回顾在高三化学的复习中,首先要回顾基础知识。
这包括元素周期表、化学键、化学方程式等。
元素周期表是化学的基础,通过熟悉元素周期表的排列规律,可以帮助我们理解元素的性质和周期性。
化学键则是物质中原子之间的连接方式,可以分为离子键、共价键和金属键等。
化学方程式是描述化学反应的方式,通过掌握化学方程式的写法和平衡方法,可以更好地理解和解答化学反应相关的问题。
第二部分:重点知识梳理在高三化学的复习中,我们需要重点关注一些重要的知识点。
比如,化学反应的速率与反应机理、溶液的浓度与溶解度、化学平衡与平衡常数等。
了解化学反应的速率与反应机理可以帮助我们理解反应速率的影响因素以及反应机理的推断方法。
掌握溶液的浓度与溶解度可以帮助我们计算溶液的浓度以及理解溶解度与温度、压力等因素的关系。
而化学平衡与平衡常数则是理解化学反应平衡状态的基础,通过平衡常数的计算和应用,可以解答与化学平衡相关的问题。
第三部分:实验技巧与应用在高三化学的复习中,实验技巧与应用也是非常重要的一部分。
通过实验,我们可以观察和验证化学理论的真实性。
在实验技巧方面,我们需要掌握实验器材的使用方法、实验操作的注意事项以及实验数据的处理和分析方法。
在实验应用方面,我们需要了解实验在生活和工业中的应用,比如化学分析、质量控制和环境保护等方面。
第四部分:解题技巧与答题方法在高三化学的复习中,解题技巧与答题方法是非常关键的。
通过掌握解题技巧,我们可以更加高效地解答复杂的化学问题。
在解题技巧方面,我们需要注意题目的关键词和条件,合理选择解题方法和步骤,以及注意解答过程中的逻辑性和严谨性。
在答题方法方面,我们需要熟悉高考化学试题的题型和要求,合理安排时间和答题顺序,以及注意答题的完整性和准确性。
高考化学复习第十五讲 物质结构第三章A 组考点 考查晶胞中粒子个数的计算1.(2013·江苏高考)Zn 与S 所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,Zn 离子的数目为________。
②该化合物的化学式为________。
2.利用“卤化硼法”可合成含B 和N 两种元素的功能陶瓷,右图为其晶胞结构示意图,则每个晶胞中含有B 原子的个数为________,该功能陶瓷的化学式为________。
考点 考查晶体密度与微粒距离间的关系计算晶体微粒与M(摩尔质量,g/mol)、ρ(晶体密度,g/cm 3)之间的关系若1个晶胞中含有x 个微粒,则1 mol 晶胞中含有x mol 微粒,其质量为xM g ;又1个晶胞的质量为ρa 3g(a 3为晶胞的体积,单位为cm 3),则1 mol 晶胞的质量为ρa 3N A g ,因此有xM =ρa 3NA 。
3.(2013·全国卷Ⅱ节选)F 、K 和Ni 三种元素组成的一个化合物的晶胞如图所示。
(1)该化合物的化学式为________;Ni 的配位数为________;(2)列式计算该晶体的密度________g·cm -3。
4.(2012·海南高考节选)用晶体的X 射线衍射法可以测得阿伏加德罗常数。
对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm 。
又知铜的密度为 g·cm -3,则铜晶胞的体积是 ________cm 3,晶胞的质量是________g ,阿伏加德罗常数为______________(列式计算,已知Ar(Cu)=。
5.某离子晶体晶胞的结构如图所示。
X()位于立方体顶点,Y()位于立方体中心。
试分析:(1)晶体的化学式为________。
(2)晶体中距离最近的2个X 与1个Y 形成的夹角∠XYX 是________。
(3)设该晶体的摩尔质量为M g/mol ,晶体的密度为ρ g/cm 3,阿伏加德罗常数的值为NA ,则晶体中两个距离最近的X 之间的距离为________cm 。
高考化学复习资料(三)
13、中学化学常见气体单质:H2、O2、N2、Cl2、(F2)
固体单质:S、Na、Mg、Al、Fe、Cu
液体单质:Br2
14、中学化学常见化合物:NaCl、NaOH、Na2CO3、NaHCO3、FeCl2、FeCl3、H2SO4、
HCl、CaCO3、SO2、H2O、NO、NO2、HNO3
Ⅲ、有机化学
1、最简式相同的有机物
1.CH:C2H2和C6H6
2.CH2:烯烃和环烷烃
3.CH2O:甲醛、乙酸、甲酸甲酯
4.C n H2n O:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
2、同分异构体
1、醇——醚C n H2n+2O x
2、醛—酮—环氧烷(环醚)C n H2n O
3、羧酸—酯—羟基醛C n H2n O2
4、氨基酸—硝基烷
3、能发生取代反应的物质及反应条件
1.烷烃与卤素单质:卤素蒸汽、光照;
2.苯及苯的同系物与①卤素单质:Fe作催化剂;
②浓硝酸:50~60℃水浴;浓硫酸作催化剂
③浓硫酸:70~80℃水浴;
3.卤代烃水解:NaOH的水溶液;
4.醇与氢卤酸的反应:新制的氢卤酸;
5.酯类的水解:无机酸或碱催化;
6.酚与浓溴水或浓硝酸
(乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。
)
4、能发生加成反应的物质
1.烯烃的加成:卤素、H2、卤化氢、水
2.炔烃的加成:卤素、H2、卤化氢、水
3.二烯烃的加成:卤素、H2、卤化氢、水
4.苯及苯的同系物的加成:H2、Cl2
5.苯乙烯的加成:H2、卤化氢、水、卤素单质
6.不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)
7.含醛基的化合物的加成:H2、HCN等
8.酮类物质的加成:H2
9.油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。
5、能与氢气加成的: 、C=C 、 、C=O
( 和 中的C=O 双键不发生加成)
6、能与NaOH 反应的:—COOH 、 、 、 ―X
7、能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
8、能发生缩聚反应的物质
1. 苯酚和甲醛:浓盐酸作催化剂、水浴加热 3.自身含有醇羟基和羧基的有机物 2. 二元醇和二元羧酸等 4.氨基酸 缩合聚合(简称缩聚):单体之间通过脱去小分子(如H 2O 等)生成高分子的反应。
例如:
9、能发生银镜反应的物质
凡是分子中有醛基(-CHO )的物质均能发生银镜反应。
1. 所有的醛(R -CHO ); 2. 甲酸、甲酸盐、甲酸某酯; 注:能和新制Cu(OH)2反应的——除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
10、能与溴水反应而使溴水褪色或变色的物质 (一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等) 3. 石油产品(裂化气、裂解气、裂化汽油等);
4. 苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀) 5. 含醛基的化合物
6. 天然橡胶(聚异戊二烯) (二)无机
1. -2价硫(H 2S 及硫化物);
2. +4价硫(SO 2、H 2SO 3及亚硫酸盐); 3. +2价铁:
6FeSO 4+3Br 2=2Fe 2(SO 4)3+2FeBr 3
6FeCl 2+3Br 2=4FeCl 3+2FeBr 3 变色 2FeI 2+3Br 2=2FeBr 3+2I 2
4.Zn 、Mg 等单质 如Mg +Br 2H 2O
===MgBr 2
(此外,其中亦有Mg 与H +、Mg 与HBrO 的反应) 5.-1价的碘(氢碘酸及碘化物) 变色
6.NaOH 等强碱:Br 2+2OH ‾==Br‾+BrO‾+H 2O
O O C O OH C OH
O O C C C
7.Na 2CO 3等盐:Br 2+H 2O==HBr +HBrO
2HBr +Na 2CO 3==2NaBr +CO 2↑+H 2O HBrO +Na 2CO 3==NaBrO +NaHCO 3 8.AgNO 3:AgNO 3+HBr==AgBr↓+HNO 3 浅黄色沉淀 (三)能萃取溴而使溴水褪色的物质 上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2; 下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、液态环烷烃、低级酯、液态饱和烃(如已烷等)等
11、能使酸性高锰酸钾溶液褪色的物质 (一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等); 2. 苯的同系物;※
3. 不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等); 4. 含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等); 5. 酚类
6. 石油产品(裂解气、裂化气、裂化汽油等); 7. 煤产品(煤焦油);
8. 天然橡胶(聚异戊二烯)。
(二)无机
1. 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物); 2. 亚铁盐及氢氧化亚铁;
3. -2价硫的化合物(H 2S 、氢硫酸、硫化物); 4. +4价硫的化合物(SO 2、H 2SO 3及亚硫酸盐); 5. 双氧水(H 2O 2,其中氧为-1价)
※注:苯的同系物被KMnO 4(H +)溶液氧化的规律:
侧链上与苯环直接相连的碳原子被氧化成羧基,其他碳原子则被氧化成CO 2。
倘若侧链中与苯环直接相连的碳原子上没有氢,则不能被氧化。
如:
Ⅳ、化学实验:
1、不宜长期暴露空气中的物质 1.由于空气中CO 2的作用:
生石灰、NaOH 、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO 2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na 2O 、Na 2O 2; 2.由于空气中H 2O 的作用:
浓H 2SO 4、P 2O 5、硅胶、CaCl 2、碱石灰等干燥剂、浓H 3PO 4、无水硫酸铜、CaC 2、面碱、NaOH 固体、生石灰;
3.由于空气中O 2的氧化作用:
钠、钾、白磷和红磷、NO 、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO 2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
CH 3 KMnO 4(H +) COOH CH 2CH 3 KMnO 4(H +) COOH C(CH 3)3 C(CH 3)3。