果树中花青苷合成研究进展
- 格式:doc
- 大小:43.50 KB
- 文档页数:10

果汁中的花青苷化学分析方法花青苷是一类在自然界中广泛存在的天然色素,具有强大的抗氧化性能和保健作用。
果汁作为一种流行的饮品,其中含有丰富的花青苷。
因此,对果汁中花青苷的化学分析方法的研究,不仅有助于评估果汁的品质,还有助于揭示其保健功效的科学机制。
目前,对果汁中花青苷的化学分析方法主要包括色谱法、质谱法和光谱法等。
下面将分别对这些方法进行介绍。
色谱法是一种常用的分离分析方法,包括高效液相色谱(HPLC)和气相色谱(GC)。
其中,HPLC是目前分析果汁中花青苷最常用的方法之一、该方法通过将果汁中的花青苷化合物与色谱柱固定相进行相互作用,实现对花青苷的有效分离和测定。
HPLC色谱柱的选择,如C18柱、C8柱等,以及不同的流动相组成和温度条件都会影响花青苷的分离效果和检测灵敏度。
此外,还可以结合质谱检测器对花青苷进行鉴定和定量。
质谱法是一种分析样品化学组成和结构的强大工具,常用的质谱方法包括质谱仪(MS)和飞行时间质谱仪(TOF-MS)。
质谱法可以通过对花青苷分子的分子量、碎片离子和碎片离子比例进行分析,来鉴定和定量花青苷。
此外,质谱法还可以结合色谱法进行联用,实现对花青苷的完整分析。
光谱法是通过测量化合物在特定波长下的吸光度来定量分析的方法。
对于花青苷的分析,最常使用的光谱法是紫外-可见分光光度法(UV-Vis)。
通过设置特定波长下的吸光度峰,可以对花青苷进行定量分析。
此外,近红外光谱(NIR)和荧光光谱等光谱技术也可以用于花青苷的鉴定和定量。
总的来说,这些化学分析方法在果汁中花青苷的检测和定量方面具有各自的优势和适用范围。
选择合适的方法需要考虑样品复杂性、分析要求和设备条件等因素。
未来,可以通过方法的改进和优化,进一步提高对果汁中花青苷的分析灵敏度和准确性,以满足不同需求的科学研究和工业应用。

浆果类水果中花青苷高效液相色谱测定方法的建立付红蕾;王堃宇;万浩亮;张佳;姜鹏;刘晓丽;韩令喜;李倩;魏亦山;聂继云【期刊名称】《农产品质量与安全》【年(卷),期】2024()3【摘要】建立了高效液相色谱法测定浆果类水果中矮牵牛素-3-O-葡萄糖苷等16种花青苷的方法。
浆果类水果中的花青苷经盐酸甲醇溶液振荡提取,C18色谱柱分离,二极管阵列检测器检测,以保留时间定性,外标法定量。
结果表明,花青苷在0.5~50 mg/L(矮牵牛素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷)和0.5~100 mg/L(其余14种花青苷)范围内,线性关系良好,相关系数(R^(2))>0.99;方法检出限为0.05~0.20 mg/kg,方法定量限为0.15~0.60 mg/kg;实验室内相对标准偏差<10%(n=5),实验室间相对标准偏差<15%(n=3)。
该方法操作简便、结果稳定、灵敏度和精密度高,可用于浆果类水果中矮牵牛素-3-O-葡萄糖苷等16种花青苷的检测。
【总页数】8页(P25-31)【作者】付红蕾;王堃宇;万浩亮;张佳;姜鹏;刘晓丽;韩令喜;李倩;魏亦山;聂继云【作者单位】青岛农业大学园艺学院(青岛);青岛市农产品质量安全中心;江苏省徐淮地区徐州农业科学研究所【正文语种】中文【中图分类】R28【相关文献】1.前列欣浓缩丸中芍药苷高效液相色谱测定方法的建立2.超高效液相色谱-串联四极杆飞行时间质谱和超高效液相色谱-串联三重四极杆质谱用于血浆中苦杏仁苷及其代谢产物野黑樱苷的定性和定量分析3.中药复方制剂中盐酸小蘖碱、黄芩苷和芦丁含量的高效液相色谱测定方法建立4.液相色谱-串联质谱法同时测定浆果类、瓜果类水果中19种植物生长调节剂的残留量因版权原因,仅展示原文概要,查看原文内容请购买。


花青苷的研究进展余凡;赵冠杰;李新生;陈小玲;李雯;孙照【期刊名称】《现代食品》【年(卷),期】2017(000)019【摘要】花青苷类化合物广泛存在于自然界各种植物中,且对人体无毒副作用。
本文以万方数据库和中国知网已发表的文章为基础,综述花青苷的化学组成及性质、分离纯化方法、药理活性和花青苷的应用等方面的研究,为进一步开发和利用花青苷资源提供依据。
【总页数】6页(P21-26)【作者】余凡;赵冠杰;李新生;陈小玲;李雯;孙照【作者单位】陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站;陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站;陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站;陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站;陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站;陕西理工大学陕西省资源生物重点实验室;陕西理工大学生物科学与工程学院;城固县食品药品监督管理局;城固县农业机械管理站【正文语种】中文【中图分类】Q946【相关文献】1.花青苷的研究进展 [J], 余凡;赵冠杰;李新生;陈小玲;李雯;孙照2.花青苷应用于眼科常见疾病研究进展 [J], 龚帅;祁珊珊;李雯;李新生;白山3.植物花青苷代谢调控机理研究进展 [J], 应震;周庄4.蔬菜花青苷生物合成及转录调控的研究进展 [J], 曹琳娇; 李晓杰; 焦棒棒; 梁毅; 马长生5.外源添加剂对苹果中花青苷影响的研究进展 [J], 孙媛媛因版权原因,仅展示原文概要,查看原文内容请购买。

◆◆2011年第4期辣椒杂志(季刊)引言花青素(Anthocyanidin),又称为花色素,是一类广泛存在于多种植物中的水溶性天然色素,自然状态下,植物体内的花青素常与各种单糖结合而形成糖苷,称为花色苷(Anthocyanin)。
自然界广泛存在的花色素以紫红色的矢车菊色素(Cyanidin)、砖红色的天竺葵色素(Pelargonidin)及蓝紫色的翠雀素(Delphinidin)为主,并由此再衍生出其他3种花色素,如矮牵牛花色素(Petunidin)及锦葵色素由翠雀素经不同程度的甲基化而来,芍药花色素(Peonidin)则是由矢车菊素经甲基化形成的。
pH 值影响花青素类物质的颜色,pH<7时呈红色,pH 在7~8时呈紫色,pH>11呈蓝色。
花色素为植物体内类黄酮生化合成的产物,而类黄酮化合物对植物体本身具有多种生物学功能,如在植物花色形成、吸引授粉虫媒和种子传播、花粉萌发、防止病原微生物侵染、抵抗紫外线辐射以及植物和微生物互相识别等过程中都发挥着十分重要作用[1-2]。
植物花青素生物合成相关基因研究进展周惠1文锦芬2邓明华1朱海山1*(1云南农业大学园林园艺学院云南昆明650201)(2昆明理工大学现代农业工程学院云南昆明650500)摘要花青素是一种水溶性色素,是构成花瓣和果实颜色的主要色素之一。
它是植物二级代谢产物,具有重要的营养和药用作用。
综述了植物花青素生物合成途径及生物合成途径中关键酶的研究现状和发展趋势,为今后进一步研究花青素提供参考借鉴。
关键词植物;花青素;酶;基因Research Progress in Plant Anthocyanidin Biosynthesis GenesZhou Hui 1Wen Jinfen 2Deng Minghua 1Zhu Haishan 1*(1College of Horticulture and Landscape,Yunnan Agricultural University,Kunming 650201;2Faculty of Modern Agricultural Engineering,Kunming University of Science and Technology,Kunming 650500)Abstract Anthocyanidin is a natural plant pigment,one of the important pigments in the petal and fruit color,and a plant secondary metabolism product with important nutritional and medical functions.This paper discusses the biosynthesis pathway of anthocyanidin,some related anthocyanidin synthases and the biochemical functions of anthocyanidin in plants,and reviews the current situation and the future trend of related anthocyanidin researches.Key w ords plant;anthocyanidin;enzyme;gene收稿日期:2011-09-28作者简介:周惠(1988-),女,硕士研究生,E-mail:chuangwaiyumeng@ 通讯作者:朱海山,男,博士,教授,主要从事茄科蔬菜遗传育种研究专题综述◆◆2011年第4期辣椒杂志(季刊)1花青素的生物合成途径植物花青素和类黄酮物质生物合成和降解代谢途径的研究在20世纪80年代至90年代初就较为成熟。
食品色素变化实验报告——花青苷引言食品色素在我们的生活中扮演了重要的角色,它们不仅能够增加食物的吸引力,还可以影响我们对味道和质感的感知。
花青苷是一种常见的食品色素,广泛存在于天然食材中,如紫葡萄、蓝莓和红葡萄酒。
在本次实验中,我们将深入探讨花青苷的性质、变化和应用,以及对其的评估和实验结果的总结。
花青苷的性质花青苷是一种属于花青素类的天然化合物,它赋予许多食物和饮料鲜艳的紫色、蓝色和红色。
花青苷的分子结构中包含花青素骨架,它具有多种生物活性,如抗氧化、抗炎症和抗癌作用。
这使得花青苷成为健康食品和保健品中的重要成分。
花青苷的变化pH值对花青苷颜色的影响花青苷的颜色对食品的吸引力至关重要。
实验中,我们改变了花青苷溶液的pH值,观察其颜色变化。
结果显示,花青苷在酸性条件下呈现鲜艳的红色,而在中性或碱性条件下呈现蓝色。
这是由于花青苷分子在不同pH值下的结构变化导致的。
这个性质在食品工业中用来调整食品的颜色,以满足消费者的口味和需求。
温度对花青苷的稳定性另一个实验中,我们测试了花青苷在不同温度下的稳定性。
结果表明,花青苷在高温下容易分解,导致颜色褪去。
这一发现对于食品加工和储存非常重要,因为温度的控制可以影响食品的色泽和质量。
光照对花青苷的降解花青苷也对光敏感,容易受到紫外光的影响而降解。
在实验中,我们将花青苷暴露在紫外光下,观察其颜色的变化。
结果显示,花青苷在紫外光下逐渐失去颜色,这也是为什么食品包装常常采用不透明材料来保护食品中的花青苷。
花青苷的应用食品着色剂由于其丰富的颜色和稳定性,花青苷在食品工业中广泛用作食品着色剂。
它可以为食品赋予各种吸引人的颜色,从紫红色到深蓝色,适用于糕点、果酱、饮料和糖果等各种食品。
营养保健品花青苷被认为具有抗氧化和抗炎症性质,因此在营养保健品中也被广泛应用。
它被认为有助于改善心血管健康、抵抗炎症和减轻氧化应激。
实验结果总结通过我们的实验,我们深入了解了花青苷的性质、变化和应用。
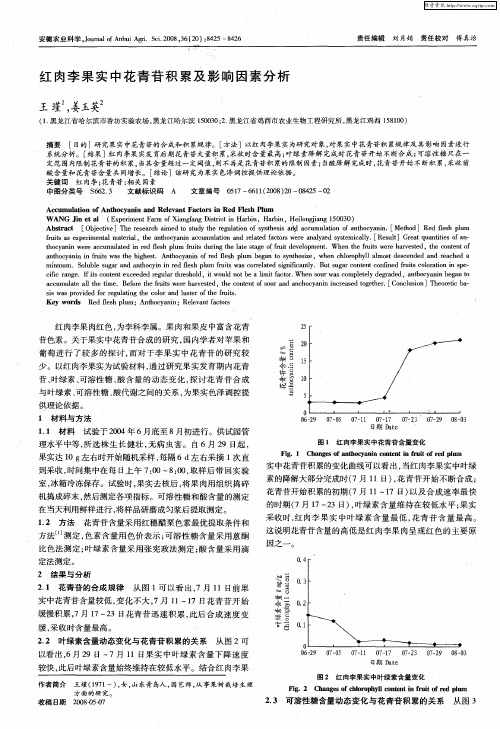
果树中花青苷合成研究进展作者:王会良何华平(等)来源:《湖北农业科学》2013年第20期摘要:对果树中花青苷合成方面的相关研究进展进行了综述。
分别从结构基因和调节基因两个方面对花青苷合成的分子机理进行了总结和分析,同时探讨了环境因子对花青苷积累的影响,对花青苷合成机理中的疑点及研究前景进行了展望。
关键词:花青苷;合成;基因;机理;果树中图分类号:S66;Q946.83 文献标识码:A 文章编号:0439-8114(2013)20-4857-05Advances on the Research of Anthocyanin Synthesis in Fruit TreesWANG Hui-liang,HE Hua-ping,GONG Lin-zhong,WANG Fu-rong,LIU Yong,ZHU Xiao-min(Institute of Fruit and Tea,Hubei Academy of Agricultural Sciences/Fruit and Tea Subcenter of Hubei Innovation Center of Agricultural Science and Technology,Wuhan 430209, China)Abstract: In this paper, the advance on the research of anthocyanin synthesis in fruit trees is reviewed. The molecular mechanism of anthocyanin synthesis is summarized and analyzed from both structural gene and regulatory gene. Influences of environmental factors on anthocyanin accumulation are discussed. Doublts of mechanisms of anthyocyanin synthesis and prospects of research is proposed.Key words: anthocyanin; synthesis; gene; mechanism; fruit trees果实颜色是果实的重要经济性状。
花青苷是类黄酮合成途径的合成产物之一,是多种花和果实中红色、紫色、蓝色等颜色的呈色物质。
花青苷在植物中扮演重要的角色,如吸引传粉、种子传播、减少UV光损伤、抗病原体的侵染等[1,2]。
此外,花青苷还具有抗氧化活性,并且对人体健康具有潜在好处,如可预防癌症、炎症、冠状动脉硬化等疾病[3-6]。
近年来,花青苷合成机理研究成为当前研究的热点,在这方面研究的科研成果,对于加深人们对花青苷合成机理的认识,加快培育富含花青苷的优良果树新品种具有重要意义。
在果树方面,花青苷的很多结构基因及各种调节基因已经被克隆并进行了详细的分析验证,其中,对苹果和葡萄的相关研究较为深入。
研究表明,部分调节基因的表达受环境因子的影响,如光照、温度、营养状况等[7-13],因此,环境因子也可影响花青苷的合成。
为此,本文对近几年来有关果实花青苷积累的调控机理研究进行了综述。
1 花青苷形成的分子机理1.1 花青苷生物合成途径花青苷合成(图1)起始于苯丙氨酸解氨酶(PAL)催化的苯丙氨酸到肉桂酸的反应,PAL是苯丙烷类代谢途径中的第一个酶。
而后在肉桂酸羟化酶(C4H)和对香豆酰CoA连接酶(4CL)的催化下形成香豆素-CoA,1分子香豆素-CoA与来自乙酸的3分子丙二酰-CoA在查尔酮合成酶(CHS)的催化下形成黄色的4-羟基查尔酮,查尔酮异构酶(CHI)催化4-羟基查尔酮形成无色的柚苷配基,即4,5,7-3羟基黄烷酮。
这是第一个稳定的类黄酮化合物,它经不同酶的修饰可形成不同的类黄酮化合物。
这些修饰作用包括羟基化、甲基化、酰基化、糖基化及还原作用,在各种植物中能形成3 500种以上不同类黄酮衍生物。
其中,形成花青苷的途径是柚苷配基在黄烷酮-3-羟化酶(F3H)的作用下转化为二氢黄酮醇(DHK),DHK在类烷酮-3′-羟化酶(F3′H)的作用下形成二氢栎皮酮(DHQ),DHQ经二氢黄酮醇-4-还原酶(DFR)还原成无色花青素,再经花青素合成酶(ANS)合成显色的花青素。
最后在葡萄糖基转移酶(UFGT)的作用下生成各种花青苷[14-21]。
1.2 结构基因与花青苷的合成起初,关于花青苷合成机理的研究,主要集中在代谢途径上相关结构基因的研究。
前人研究表明,拟南芥、苹果、荔枝、葡萄等植物中的PAL、CHI、DFR、UFGT等花青苷合成相关酶与花青苷的合成关系密切,但对不同酶在花青苷合成中的作用大小,研究结果却不尽一致[22-24]。
Honda等[25]分离了CHS、F3H、DFR、ANS、UFGT等5个花青苷合成的结构基因,首次报道了花青苷合成酶基因间协调表达与苹果着色的关系,在果实成熟阶段,红色品种红玉和富士中的表达量远远高于在黄色品种王林中的表达量,花青苷合成相关基因的表达水平与花青素浓度呈正相关。
Kim等[26]从cDNA文库中分离了F3H、DFR、ANS、UFGT的cDNA序列,推导的氨基酸序列与其他植物基因序列具有高度的同源性。
Takos等[27]克隆了3个与缩合单宁(CT)合成相关的酶基因和2个无色花青素还原酶基因(MdLAR1、MdLAR2),发现在果实成熟过程中,当其他路径基因高水平转录、花青苷大量积累的时候,CT的丰度却很少。
此外,利用已知的结构基因序列合成引物,从葡萄、苹果、草莓、蓝莓中克隆了CHS、CHI、F3H、DFR、ANS、UFGT等结构基因[19,28,29]。
许多研究表明[23,30,31],果树中花青苷合成途径与玉米、矮牵牛、拟南芥、金鱼草中的合成途径基本相同,结构基因同源性很高。
Kondo等[32]研究指出,在苹果果实发育过程中,CHS、F3H、DFR、ANS、UFGT 5个基因协同表达,这些基因的表达水平与花青苷积累呈正相关。
不同果实中甚至是果实的不同发育阶段、果实的不同组织部位,这些酶的功能也可能不尽相同[33]。
1.3 调节基因与花青苷的合成与其他物种一样,果树中花青苷结构基因的表达受一个由MYB转录因子(TF)、基本螺旋-环-螺旋TF(bHLH)、WD重复蛋白组成的复合物(MBW)的调控,对苹果和葡萄中关于转录因子调控花青苷合成的研究较为深入,很多转录因子已经被分离验证(图1)。
在苹果上,成功分离得到3个MYB基因MdMYB1、MdMYBA、MdMYB10,经验证表明这3个基因都属于R2R3类基因,并且调控花青苷的积累[23,30]。
Wang等[34]认为这3个基因互为等位基因。
该基因的甲基化程度差异决定了苹果果皮的不同着色模式[35]。
苹果果实红肉性状与MdMYB10启动子区的一个增强子原件有关,并且此基因具有自我调节功能[36]。
苹果果皮红色受MdMYB1 和MdMYBA的调控[23,37]。
前人研究表明,MYB类需借助于bHLH伴侣蛋白来促进花青苷的积累。
在苹果上,克隆得到2个类似bHLH共转录因子(MdbHLH3和MdbHLH33),这2个因子参与激活结构基因及MYB10的表达,并且MYB10与MdbHLH3的结合比与MdbHLH33的结合更能有效地促进结构基因的转录[30]。
在葡萄上,VvMYBA1和VvMYBA2特异调控UFGT基因的表达,从而调节果实着色。
果皮着色深浅与VvMYBA1和VvMYBA2之间的加性效应有关[38-40],两基因同时失活会导致果皮因无法合成花青苷而呈白色[41]。
其他有些MYB因子(如VvMYB5a和VvMYB5b)参与了苯丙氨酸反应途径的支路反应,这也包括花青苷生成途径。
转化VvMYB5a基因的烟草,其单宁含量增加[42]。
Deluc等[43]研究表明VvMYB5b基因参与调控花青苷和原花青苷的合成。
葡萄上已经分离得到了2个bHLH蛋白(VvMYCA1、VvMYC1)和2个WD蛋白(VvWDR1、VvWDR2)。
VvMYCA1和VvWDR1对花青苷的合成都具有正调控作用,VvWDR1并不直接作用于结构基因,而可能是通过与MYB/bHLH结合成复合体的方式起作用,VvMYCA1则可能是调控UFGT和ANR的表达。
其他果实上也对MYB类因子进行了研究,如梨[44]、杨梅[45]、草莓[46]等。
研究表明,部分MYB类基因对花青苷的合成具有负调控作用,Wang等[47]的研究表明,苹果中MdMYB17基因的表达减少了花青苷的积累。
2 外在因素对花青苷合成的影响光照是影响花青苷合成最重要的环境因子之一[48,49]。
完全不照光的果实中,没有花青苷的合成,光照强度低于全光照的50%时,随着光照强度的增强,花青苷浓度增加[50]。
不同着色强度品种花青苷合成对光强的需求量不同,深红色品种着色比浅红色品种容易,在较低的光强下也能较好着色[33]。
光照影响花青苷合成在基因转录水平上起作用,但光影响结构基因还是调控基因尚未研究清楚[51]。
柳蕴芬等[52]研究表明,套袋明显抑制了桃果肉红色的形成,套袋果实成熟时a*值为10.32,仅为不套袋果的19.4%;但如果套袋果实在采收前15 d摘袋,则见光后的果实果肉花青苷合成能力迅速恢复,采收时花青苷含量达到248.85 nmol/g。
杜纪红等[53]的研究则表明,油桃果实套袋遮光处理后20 d,果皮中花青苷含量迅速下降并接近于0,此后一直保持较低的水平,直到果实成熟时略有回升,其含量仅为对照的2%。
Zhou等[54]的研究表明,经黑暗处理后,红色桃叶片中花青苷合成途径上结构基因的表达出现了下降趋势。
光质对花青苷的合成有着重要作用。
红光(R)照射离体套袋红富士苹果果实不着色,紫外光UVA(>320 nm)灼伤果实果皮而变褐色;UVB(280~320 nm)及其组合光源刺激果实PAL酶活性增加,促进糖含量增长,并使果实花青苷大量积累,促进红富士苹果着红色。
白光对红富士苹果果实PAL酶活性、花青苷及糖分含量的增加也有一定促进作用,但不如UVB及其组合光源照射效果好[55]。
温度在很大程度上影响了花青苷的合成,并一定程度上影响花青苷的稳定性。
温度对花青苷合成的影响比较复杂,相对低温促进花青苷的合成,但也并不完全如此。
温度对于葡萄[56]、矮牵牛[57]、血橙[8]、玫瑰[58]等植物中营养器官内花青苷的积累具有重要作用。
在苹果、梨上,低温处理增加了果实中的花青苷含量,并促进了结构基因的表达[9,59,60]。