乙酸乙酯皂化数据
- 格式:xlsx
- 大小:14.37 KB
- 文档页数:1

乙酸乙酯的皂化反应测反应活化能
乙酸乙酯的皂化反应是指乙酸乙酯与碱反应生成乙酸钠和乙醇。
该反应的化学方程式如下:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
要测量皂化反应的活化能,可以通过变化反应物浓度或温度的方法来研究速率常数(k)的变化关系。
然后,利用阿累尼乌斯
方程和活化能公式可以计算得到反应的活化能。
具体步骤如下:
1. 准备一系列乙酸乙酯和NaOH的反应体系,分别控制不同
的反应物浓度或温度。
2. 在不同体系下测定反应速率,并得到速率常数k的值。
3. 根据阿累尼乌斯方程 ln(k/T) = ln(A) - E_a/RT,其中k为速
率常数,T为温度(K),A为指前因子(Arrhenius常数),
R为理想气体常数,E_a为反应的活化能。
4. 根据测定得到的速率常数k和温度T的数据,通过线性拟
合的方法计算得到E_a的值。

乙酸乙酯皂化反应实验报告一、实验目的1、了解二级反应的特点,学会用图解法求二级反应的速率常数。
2、掌握用电导法测定乙酸乙酯皂化反应速率常数和活化能的方法。
3、熟悉电导率仪的使用方法。
二、实验原理乙酸乙酯的皂化反应是一个典型的二级反应:CH₃COOC₂H₅+NaOH → CH₃COONa + C₂H₅OH在反应过程中,各物质的浓度随时间而改变。
若乙酸乙酯和氢氧化钠的初始浓度相同,均为 c₀,则反应速率方程为:r = dc/dt = kc²式中,c 为时间 t 时反应物的浓度,k 为反应速率常数。
积分上式可得:kt = 1/c 1/c₀由于反应是在稀的水溶液中进行,因此可以认为反应过程中溶液的体积不变。
同时,NaOH 和 CH₃COONa 是强电解质,在浓度不大时,电导率与其浓度成正比。
设溶液在起始时的电导率为κ₀,反应完全结束时的电导率为κ∞,在时间 t 时的电导率为κt。
则:κ₀= A₁c₀(A₁为比例常数)κ∞ = A₂c₀(A₂为比例常数)κt = A₁(c₀ c) + A₂c所以:c =(κ₀ κt) /(κ₀ κ∞)将其代入速率方程积分式,可得:kt =(κ₀ κt) / c₀(κ₀ κ∞)t通过实验测定不同时间 t 时的κt,以κt 对(κ₀ κt) / t 作图,应得到一条直线,直线的斜率即为反应速率常数 k。
三、实验仪器与试剂1、仪器电导率仪恒温水浴槽秒表移液管(25ml)容量瓶(100ml)烧杯(100ml)2、试剂乙酸乙酯(AR)氢氧化钠(AR)去离子水四、实验步骤1、配制溶液配制 00200 mol/L 的 NaOH 溶液:用电子天平称取 08000 g NaOH固体,溶解于去离子水中,然后转移至 1000 ml 容量瓶中,定容至刻度,摇匀。
配制 00200 mol/L 的乙酸乙酯溶液:用量筒量取 218 ml 乙酸乙酯,放入 100 ml 容量瓶中,用去离子水定容至刻度,摇匀。

2.3 动力学部分实验十二 二级反应——乙酸乙酯皂化1目的要求(1) 测定乙酸乙酯皂化反应的速率常数。
(2) 了解二级反应的特点,学会用图解法求二级反应的速率常数。
(3) 熟悉电导率仪的使用。
2基本原理(1) 乙酸乙酯皂化反应速率方程,乙酸乙酯皂化反应,是双分子反应,其反应为:CH 3COOC 2H 5+Na ++OH -=CH 3COO -+Na ++ C 2H 5OH在反应过程中,各物质的浓度随时间而改变。
不同反应时间的OH -的浓度,可以用标准酸滴定求得,也可以通过间接测量溶液的电导率而求出。
为了处理方便起见,设CH 3COOC 2H 5和NaOH 起始浓度相等,用a 表示。
设反应进行至某一时刻t 时,所生成的CH 3COONa 和C 2H 5OH 浓度为x ,则此时CH 3COOC 2H 5和NaOH 浓度为(a-x )。
即CH 3COOC 2H 5+Na ++OH -=CH 3COO -+Na ++ C 2H 5OHt=0 a a 0 0t=t a-x a-x x xt →∞ (a-x )→0 (a-x )→0 x →a x →a 上述反应是一典型的二级反应。
其反应速率可用下式表示:2)(x a k dt dx -= (2.12.1) 式中k 为二级反应速率常数。
将上式积分得)(1x a x ta k -⋅= (2.12.2) 从式(2.12.2)中可以看出,原始浓度a 是已知的,只要能测出t 时的x 值,就可以算出反应速度常数k 值。
或者将式(2.12.2)写成kt x a x a =-⋅)(1 (2.12.3) 以)(1x a x a -⋅对t 作图,是一条直线,斜率就是反应速率常数k 。
k 的单位是11min --⋅⋅mol L (SI 单位是113--⋅⋅s mol m )如果知道不同温度的反应速率常数)(1T k 和)(2T k ,按阿累尼乌斯(Arrhenius)公式可计算出该反应的活化能 )()()(ln 121221T T T T R E T k T k E -== (2.12.4) (2)电导法测定速率常数:首先假定整个反应体系是在接近无限稀释的水溶液中进行的,因此可以认为CH 3COONa 和NaOH 是全部电离的,而CH 3COOC 2H 5和C 2H 5OH 认为完全不电离。

乙酸乙酯皂化反应的ea值
乙酸乙酯皂化反应的 Ea 值是指该反应的活化能。
皂化反应是
指酯与碱(如氢氧化钠)发生水解反应,生成相应的醇和盐(即皂)。
乙酸乙酯是一种常见的酯类化合物,其皂化反应的 Ea 值可
以通过实验测定或计算得到。
从实验角度来看,测定乙酸乙酯皂化反应的 Ea 值需要进行动
力学研究。
一种常用的方法是通过变温实验,测定在不同温度下反
应速率的变化。
根据 Arrhenius 方程,可以通过绘制反应速率常数
与温度的倒数的线性关系图,斜率即为 Ea/R,其中 R 是气体常数。
通过斜率可以计算得到 Ea 值。
另一种计算 Ea 值的方法是使用计算化学方法,如密度泛函理
论(DFT)等。
这种方法基于量子化学原理,通过计算分子的结构和
能量来预测反应的活化能。
这种计算方法需要借助计算化学软件和
计算资源,可以得到较为准确的 Ea 值。
乙酸乙酯皂化反应的 Ea 值可以受到多种因素的影响,例如反
应物浓度、温度、催化剂的存在等。
不同条件下的 Ea 值可能会有
所差异。
因此,在实际研究中,需要综合考虑这些因素,并进行合
理的控制和设计实验,以获得准确的 Ea 值。
总之,乙酸乙酯皂化反应的 Ea 值可以通过实验测定或计算化学方法得到,但具体的数值需要根据实验条件和计算方法来确定。
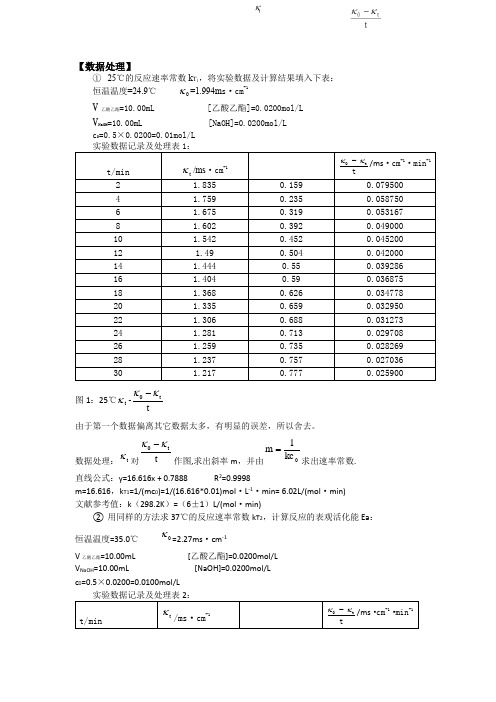
【数据处理】① 25℃的反应速率常数k T 1,将实验数据及计算结果填入下表:恒温温度=24.9℃ 0κ=1.994m s ·cm-1V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/LVNaOH=10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.01mol/L图1:25℃t κ-tt0κκ-由于第一个数据偏离其它数据太多,有明显的误差,所以舍去。
数据处理:t κ对tt0κκ-作图,求出斜率m ,并由0kc 1m =求出速率常数.直线公式:y=16.616x + 0.7888 R 2=0.9998m=16.616,k T 1=1/(mc 0)=1/(16.616*0.01)mol ·L -1·min= 6.02L/(mol ·min) 文献参考值:k (298.2K )=(6±1)L/(mol ·min)② 用同样的方法求37℃的反应速率常数k T 2,计算反应的表观活化能Ea : 恒温温度=35.0℃0κ=2.27ms ·cm -1V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L V NaOH =10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.0100mol/L图1:25℃t κ-tt0κκ-直线公式:y=13.369x + 0.8954 R 2=0.969m=13.369,k T 2=1/(mc 0)=1/(13.369*0.01)mol ·L -1·min= 7.48L/(mol ·min) 文献参考值:k (308.2K )=(10±2)L/(mol ·min) b .计算反应的表观活化能:文献值:Ea=46.1kJ/mol ln(k T 2/k T 1)=Ea/R ·(1/T 1-1/T 2) ∴Ea=Rln(k T 2/k T 1)/[T 1T 2/(T 2-T 1)]=8.314×ln (7.84/6.02)/[298×308÷(308-298)]J/mol =20.16kJ/mol分析:31.4℃时速率常数符合文献参考值,说明乙酸乙酯混合比较充分,电导率能较好地反应其反应速率,37.4℃时,实验过程中加入乙酸乙酯后混合得并不充分就开始测定,且有部分溶液露在恒温水面之上,温度并没有37.4℃。

乙酸乙酯皂化反应速率常数标准值【引言】乙酸乙酯皂化反应速率常数标准值(Standard Rate Constant of Ethyl Acetate Saponification Reaction)是一个在化学研究中常用的重要参数。
本文将围绕这一主题展开,深入分析乙酸乙酯皂化反应速率常数标准值的定义、重要性和测定方法,旨在为读者提供全面、深入和灵活的理解。
【主题解析】1. 乙酸乙酯皂化反应速率常数标准值的定义乙酸乙酯皂化反应速率常数标准值是指在一定温度和反应体系条件下,乙酸乙酯与碱溶液发生皂化反应时,反应速率的恒定数值。
它是衡量该反应速率快慢的定量指标。
2. 乙酸乙酯皂化反应速率常数标准值的重要性乙酸乙酯皂化反应速率常数标准值在化学领域中具有重要的意义:- 反应动力学研究:通过测定乙酸乙酯皂化反应速率常数标准值,可以推导出反应的速率方程,进而了解该反应的动力学特征。
- 反应机理研究:乙酸乙酯皂化反应速率常数标准值可以为揭示反应机理提供重要线索,帮助我们理解反应中不同物质间的相互作用过程。
- 工业应用:乙酸乙酯皂化反应广泛应用于化学工业中,例如生产肥皂、乳化剂、乳液等,其速率常数标准值与产品质量和生产效率密切相关。
【测定方法】乙酸乙酯皂化反应速率常数标准值的测定依赖于实验方法和数据处理技术。
以下是常用的测定方法之一:1. 初始速率法:该方法通过在不同时间点测量反应物质浓度的变化,来确定乙酸乙酯皂化反应速率常数标准值。
实验中,可以利用分光光度法、滴定法、色谱法等手段监测反应物质的浓度变化。
2. 温度变化法:改变反应温度,并测定相应的反应速率常数标准值,以求得反应的热力学参数,如活化能、活化熵等。
【个人观点与理解】乙酸乙酯皂化反应速率常数标准值作为化学领域中的重要指标,对于研究和应用具有重要意义。
在我的理解中,乙酸乙酯皂化反应是一种典型的化学反应,通过测定其速率常数标准值,可以了解该反应的动力学特性以及反应物与产物之间的相互转化过程。
乙酸乙酯皂化反应速率常数实验报告实验目的:本实验旨在通过测定乙酸乙酯的皂化反应速率常数,了解乙酸乙酯与水的反应速率,探究因素对反应速率的影响。
实验原理:乙酸乙酯与水的皂化反应是一种酯水解反应,反应式为酯+水→醇+酸。
本实验中,乙酸乙酯和水在碱催化下进行反应,生成乙醇和乙酸。
皂化反应是一个准一级反应,可以通过以下的速率方程进行表达:v=k[C]。
实验步骤:1.准备工作:清洗实验仪器、称取所需乙酸乙酯和水的质量。
2.在反应容器中加入一定量的碱溶液,使之充分溶解。
3.称取所需质量的乙酸乙酯,加入到反应容器中,并立即加热,以促进反应速率。
4.记录所需时间内反应液的体积变化。
5.根据所得实验数据,计算反应速率常数。
实验结果与分析:根据实际实验数据计算可得反应速率常数,通过对反应物质量、温度、催化剂浓度等因素进行改变,可以得到不同的速率常数。
在本实验中条件不变的情况下,反应物质量的变化会直接影响反应速率常数的大小。
实验结论:通过本实验可以得出乙酸乙酯皂化反应速率常数的实验结果,并且通过分析实验数据可以了解到反应物质量对于反应速率常数的影响。
这对于理解反应速率的调控以及研究相关反应机理具有重要意义。
实验中可能存在的误差及改进措施:1.实验中,加热乙酸乙酯和水的过程中可能有一部分乙酸乙酯挥发掉,造成实验结果的不准确。
应该采取遮盖或者使用密闭容器的方式,防止挥发现象的发生。
2.实验中,应该确保所用的碱溶液浓度稳定,以免对实验结果造成干扰。
可以使用多次实验并取平均值的方式,降低误差的影响。
3.实验中,应该注意反应温度的控制,避免过高或过低的温度对实验结果的干扰。
可以使用水浴或恒温培养箱等设备来保持稳定的实验温度。
总结:本实验通过测定乙酸乙酯皂化反应速率常数,对于了解反应速率、反应条件对反应速率的影响具有重要意义。
通过实验数据的分析,可以得到乙酸乙酯与水反应速率常数的实验结果,并且在实验中的改进措施可以提高实验的准确性和可靠性。
乙酸乙酯皂化反应实验报告实验目的:1.了解乙酸乙酯的皂化反应;2.掌握通过测定棕榈酸钠溶液的浓度来计算出乙酸乙酯的皂化价的方法;3.理解酯类在碱性溶液中的转化机理。
实验原理:乙酸乙酯(CH3COOC2H5)是一种常见的酯类物质,在碱性条件下可以发生皂化反应。
皂化是指酯在碱性溶液中,水解为相应的酸盐和醇。
乙酸乙酯的皂化反应可以用以下化学方程式表示:CH3COOC2H5+NaOH→CH3COONa+C2H5OH根据上述方程式,可以看出一摩尔的乙酸乙酯与一摩尔的氢氧化钠发生反应后,生成一摩尔的乙醇和一摩尔的乙酸钠。
实验步骤:1. 预先准备好0.05mol/L的棕榈酸钠溶液;2.用针筒量取一定体积的乙酸乙酯,使其完全滴入250mL锥形瓶中;3.在加入乙酸乙酯的同时,加入适量的棕榈酸钠溶液;4.快速地搅拌混合物并观察反应沉淀的产生情况;5.等沉淀产生稳定后,用取10mL混合液于滴定瓶中,加入几滴酚酞指示剂;6. 用0.05mol/L盐酸标准溶液滴定,记录消耗滴定溶液的体积;7.重复3至6步骤,直到得到一组滴定数据为止;8.就计算所得的数据,计算乙酸乙酯的皂化价和皂化度。
实验结果:通过实验记录的滴定数据,可以计算乙酸乙酯的皂化价。
假设一次滴定所需的盐酸体积为V mL,棕榈酸钠的浓度为C mol/L,则棕榈酸钠的滴定反应可以表示为:C mol/L * V mL = 0.05 mol/L * 10 mL由此可以计算出棕榈酸钠的浓度C。
假设一摩尔的乙酸乙酯与一摩尔的棕榈酸钠发生反应生成x摩尔的乙酸钠,由此可以计算乙酸乙酯的皂化度:皂化度(%)=x/1*100%实验讨论:在实验中,乙酸乙酯与棕榈酸钠的皂化反应可以较快地发生,反应产物是乙酸钠和乙醇。
通过滴定棕榈酸钠溶液,可以得到棕榈酸钠的浓度,从而计算出乙酸乙酯的皂化价和皂化度。
本实验中所用到的棕榈酸钠溶液浓度为0.05mol/L,这是一种适中的浓度。
如果浓度过高,滴定过程可能会过于繁琐;如果浓度过低,则需要加大样品的量才能够滴定至终点,从而增加实验误差。
实验九 乙酸乙酯皂化反应速率常数的测定1 前言实验目的测定乙酸乙酯皂化反应的速率常数; 实验内容在30℃时,用电导率仪先测定 1mol ·L -1的NaOH 溶液的电导率,然后将20ml ·L -1的NaOH 溶液与20ml ·L -1的乙酸乙酯溶液混合,测定其电导率随时间的变化关系;然后将实验温度升高到37℃,重复上述实验; 实验原理对于二级反应A +B → 产物如果A,B 两物质起始浓度相同,均为a,则反应速率的表示式为2x -a )(k dt dx = 1 式中:x 为t 时刻生成物的浓度;式1定积分得:⎥⎦⎤⎢⎣⎡-=)(1x a a xt k 2以 xa x -对t 作图,若所得为直线,证明是二级反应;并可以从直线的斜率求出k;所以在反应进行过程中,只要能够测出反应物或生成物的浓度,即可求得该反应的速率常数k;温度对化学反应速率的影响常用阿伦尼乌斯方程描述2ln RT E dTkd a = 3 式中:Ea 为反应的活化能;假定活化能是常数,测定了两个不同温度下的速率常数kT 1和kT 2后可以按式3计算反应的活化能Ea;⎪⎪⎭⎫ ⎝⎛-⨯=122112)()(lnT T T T R T k T k E a 4 乙酸乙酯皂化反应是一个典型的二级反应,其反应式为:反应系统中,OH -电导率大,CH 3COO -电导率小;所以,随着反应进行,电导率大的OH -逐渐为电导率小的CH 3COO -所取代,溶液电导率有显着降低;对于稀溶液,强电解质的电导率κ与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和;若乙酸乙酯皂化反应在稀溶液中进行,则存在如下关系式:a A 10=κ 5a A 2=∞κ 6x A x a A t 21)(+-=κ 7式中:A 1,A 2分别是与温度、电解质性质和溶剂等因素有关的比例常数;κ0、κt 、κ∞分别为反应开始、反应时间为t 和反应终了时溶液的总电导率;由式5—式7,得ax t ⎪⎪⎭⎫ ⎝⎛--=∞κκκκ00 8代入式2并整理,得∞+⎪⎭⎫⎝⎛-=κκκκtak tt 01 9因此,以t κ对ttκκ-0作图为一直线即说明该反应为二级反应,且由直线的斜率可求得速率系数k ;由两个不同温度下测得的速率系数k T 1与kT 2,可以求出反应的活化能Ea;由于溶液中的化学反应实际上非常复杂,如上所测定和计算的是表观活化能;2 实验方法实验仪器和试剂仪器 DDS-llA 型电导率仪1台;自动平衡记录仪1台;恒温水浴1套;DJS-1型电导电极1支;双管反应器2只、大试管1只;100mL 容量瓶1个;20mL 移液管3支;刻度移液管1支;试剂 L 的NaOH 溶液;乙酸乙酯AR ;新鲜去离子水或蒸馏水; 实验步骤1 仪器准备:接通电导率仪的电源,校正电导率仪,正确选择其量程,并将电导率仪的记录输出与记录仪相连;2 配制乙酸乙酯溶液:用容量瓶配制L 的乙酸乙酯溶液100mL;乙酸乙酯密度与温度的关系式ρ= 10其中ρ、t 的单位分别为kg/m 3和℃需要乙酸乙酯约;已知室温等于℃,计算得需要乙酸乙酯;3 0κ的测量;将恒温水浴调至30℃,用移液管吸取L 的NaOH 溶液装入干净的大试管中再加入20mLH 2O,将电导电极套上塞子,电极经去离子水冲洗并用滤纸吸干后插入大试管中,大试管放入恒温水浴恒温约10min,将电导率仪的“校正测量”开关扳到“测量”位置,记录仪开始记录;4 t κ的测定;将洁净干燥的双管反应器置于恒温水浴中,有移液管取20mL L 乙酸乙酯溶液,放入粗管;将电极用电导水认真冲洗3次,用滤纸小心吸干电极上的水,然后插入粗管,并塞好;用另一支移液管取20mL LNaOH 溶液放入细管,恒温约5min;用洗耳球迅速反复抽压细管两次,将NaOH 溶液尽快完全压入粗管,使溶液充分混合;记录仪必须在反应前开始记录,大约20min 可以停止测量;5 重复以上步骤,测定37℃时反应的0κ与t κ;3 结果与讨论由实验室仪器读出室温为℃,大气压为;表1,表2中的第二列由记录仪采集,可见附图t κ-t 关系图上的数据;第一列时间并非直接由记录仪采集的数据读出,而是在t κ-t 关系图上找出最高点,记下最高点对应的时间,之后将各数据点对应的时间减去最高点对应的时间即为表中第一列t;第三列中的0κ同样由记录仪采集,见附图0κ的测量,得30℃时,0κ=格,37℃时,0κ=格;注:附图分别为30℃时0κ的测量图、37℃时0κ的测量图、30℃时t κ-t 关系图、37℃时t κ-t 关系图;表1 乙酸乙酯皂化反应动力学实验数据记录30℃时间t/min格子数t κ/格0κ—t κ/ t以表1中的第二列对第三列作图,得图1;图1 ℃时t κ ~0κ—t κ/ t 图线由图1知,实验的线性拟合较好,该反应为二级反应;由公式9得,图1中直线的斜率为Ca ︒30k 1,在该实验中,a=L,所以。
物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定一.实验目的及要求1.了解测定化学反应速率常数的一种物理方法----电导法。
2.了解二级反应的特点,学会用图解法求二级反应的速率常数。
3.掌握DDS-307型数字电导率仪和控温仪使用方法。
二.实验原理乙酸乙酯皂化反应是典型的二级反应。
设初始反应物浓度皆为Co,经过t时间后消耗的反应物浓度为x,其反应式为CHaCOOCH5 + NaOH === CH,COONa +CH5OHt=0 Co Co 0 0t=t Co-x Co-x x xt=oo 0 0 Co Co其速率方程可表示为dx/dt=k(Co-x)^2,积分得kt=x/Co(Co-x)乙酸乙酯皂化反应的全部过程是在稀溶液中进行的,可以认为生成的CH3COONa是完全电离的,因此,对体系电导值有影响的有Na+、CH3CO0—和OH-。
Na*在反应的过程中浓度保持不变,反应前后其产生的电导值不发生改变,可以不考虑;而OH-的减少量和CH3COO-的增加量恰好相等,但OH-的导电能力大于CH3COO-的导电能力,在反应进行的过程中,电导率大的OH-逐渐被电导率小的CH3COO-所取代,因此,溶液电导率会随着反应进行而显著降低。
对于稀溶液而言,强电解质的电导率:与其浓度成正比,溶液的总电导率就等于组成该溶液的电解质电导率之和。
本实验采用电导法测量乙酸乙酯在皂化反应中电导率κ随时间t的发化。
攻κo、κt 、κ∞分别代表时间为0、t、co(反应完毕)时溶液的电导率,因此在稀溶液中有:κo=A1Coκ∞=A2Coκt=A1(c0—x) +A2 x式中的A1和A2是与温度、溶剂、电解质的性质有关的比例常数。
由以上三式可以推出:因此,对于二级反应,以κt对κo/t-κt/t 作图得到一条直线,直线的斜率为1/c o k,由此可以求出反应常数k。
由两个不同温度下的反应速率常数k(T1)和k(T2),根据阿伦尼乌斯公式可求出该反应的的活化能。