[课件]医疗器械生物相容性评价要求PPT
- 格式:ppt
- 大小:4.79 MB
- 文档页数:10

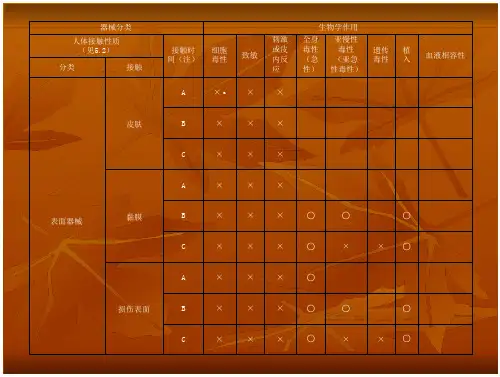

医疗器械生物相容性评价要求医疗器械生物相容性评价是指对医疗器械与生物体接触时产生的生物学反应进行评估的过程。
其目的是确定医疗器械对人体组织或体液的接触是否安全,以及对生物体是否产生不良影响。
根据国际标准和法规,医疗器械生物相容性评价需要满足以下几个主要要求。
首先,医疗器械生物相容性评价需要进行全面的物理化学分析。
这包括对医疗器械的材料成分、制造工艺、表面处理和可能存在的污染物进行详细分析。
物理化学测试可以确定医疗器械是否包含有害物质,例如重金属、残留溶剂或有害物质,以及是否存在器械破碎与粉尘脱落等情况。
其次,医疗器械生物相容性评价需要进行细胞毒性测试。
细胞毒性测试是评估器械对人体细胞的直接影响的重要手段。
通过将医疗器械与不同类型的细胞(如小鼠纤维母细胞、人类纤维母细胞、人类白细胞等)接触,观察和记录细胞的形态、增殖能力和细胞膜完整性等指标的变化来评估其细胞毒性。
第三,医疗器械生物相容性评价需要进行体外致敏测试。
致敏反应通常是指人体免疫系统对特定物质产生过敏反应。
通过接触医疗器械与免疫系统相关的细胞或体外免疫学试验系统,评估器械的致敏潜力。
这些测试可以确定医疗器械是否会导致过敏反应,并对不同类型的免疫细胞或物质产生变化。
第四,医疗器械生物相容性评价需要进行皮肤刺激测试。
皮肤刺激测试是评估外体与皮肤接触后对皮肤的直接影响的重要手段。
通过将医疗器械与动物或人体的皮肤接触,观察和记录皮肤的变化,如红肿、瘙痒、水泡等,来评估医疗器械对皮肤是否刺激。
最后,医疗器械生物相容性评价需要进行体内植入试验。
体内植入试验是评估医疗器械对人体组织和器官的影响的最重要手段。
通过将医疗器械植入动物体内,观察和记录植入部位的组织反应、炎症或纤维化等指标的变化来评估其影响。
除了以上主要要求外,医疗器械生物相容性评价还需要考虑其他因素,如器械的持久性、局部和全身反应等。
此外,医疗器械的生物相容性评价需要根据不同种类的器械和其应用领域的要求进行具体设计和开展。

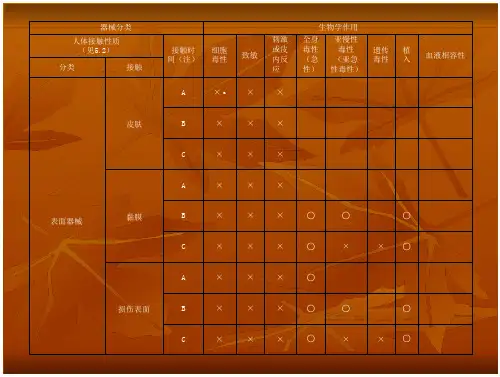

医疗器械生物相容性评价要求引言医疗器械的生物相容性评价是确保器械与人体组织和生物体相容的重要步骤。
它对于确保器械的质量、安全性和效能至关重要。
本文旨在介绍医疗器械生物相容性评价的要求,包括评价标准、实验方法和技术要求。
评价标准医疗器械生物相容性评价的标准通常依据ISO 10993系列标准来制定。
ISO 10993系列标准包含了一系列评价项目和方法,用于评估医疗器械与人体之间的相互作用。
根据ISO 10993标准,器械的生物相容性评价需要考虑以下几个方面:1.毒性评价:评估器械对生物体的毒性作用,包括急性毒性、亚慢性和慢性毒性。
2.局部刺激和过敏原评价:评估器械对组织的刺激性和过敏原性。
3.整体系统毒性评价:评估器械在全身水平上对生物体的影响。
4.免疫学评价:评估器械对免疫系统的影响。
5.遗传学评价:评估器械对遗传物质的影响。
6.感染性评价:评估器械的感染风险。
7.其他特殊评价:根据器械的特殊属性,可能需要进行其他特殊评价。
实验方法为了评估医疗器械的生物相容性,需要进行一系列实验。
常用的实验方法包括但不限于以下几种:1.细胞毒性实验:通过培养细胞与器械接触,观察细胞生长、代谢和形态等指标的变化,以评估器械对细胞的毒性作用。
2.刺激性实验:将器械接触到动物体表面或者注射到动物体内,观察皮肤炎症、红肿、溃疡等指标的变化,以评价器械对组织的刺激性。
3.过敏原实验:通过接触器械,观察动物是否产生过敏反应,如皮肤红疹、瘙痒等。
4.免疫学实验:通过调节免疫系统的指标,评估器械对免疫系统的影响。
5.感染性实验:通过培养器械与微生物接触,观察细菌、真菌等的生长情况,以评估器械的感染风险。
技术要求医疗器械生物相容性评价需要遵循严格的技术要求,以确保结果的准确性和可靠性。
以下是一些常见的技术要求:1.实验室条件:评价实验需要在符合相关规范的实验室条件下进行,包括温度、湿度、洁净度等要求。
2.试剂选择:选择符合相关标准的试剂,避免对实验结果的影响。




医疗器械生物相容性评价要求
2.评价项目全面:评价项目应包括局部和全身影响,例如物理性能、
化学性能、生物相应性、毒性、组织相容性等。
3.方法准确可靠:评价需采用科学的方法和技术,确保结果准确可靠。
常用方法包括细胞培养、动物实验、组织切片等。
4.评价条件适当合理:评价需在符合实际使用条件的情况下进行,如
温度、湿度、压力等因素对评价结果的影响应充分考虑。
5.评价结果可比较:评价结果需采用统一的计量单位和参数,以便不
同医疗器械的结果能够进行比较和分析。
6.评价结果解释:评价结果需进行全面的解释,包括对评价结果的意义、可能产生的影响和相关的风险等。
7.评价报告完整详细:评价结果需完整记录在评价报告中,并包括样
品信息、评价方法、评价结果、分析和结论等内容。
8.文件管理规范:评价文件需进行规范的管理,包括存档、索引、备
份等,以便日后查阅和审查。
9.合规性验证:评价报告需经过合规性验证,确保评价过程和结果符
合法规和标准的要求。
10.跟踪管理和修正:对于评价结果中存在的问题和不足,需进行后
续的跟踪管理和修正,以提高评价工作的质量。
总之,医疗器械生物相容性评价要求全面、准确、可靠,并符合相关
的法规和标准。
评价结果需进行充分的解释和记录,文件管理需规范,评
价过程需经过合规性验证,并且要进行后续的跟踪管理和修正。
这些要求
的落实可以保证评价结果的客观性和可靠性,从而促进医疗器械的研发和应用。