水中总硬度的测定_2008_
- 格式:ppt
- 大小:235.50 KB
- 文档页数:11

>水的总硬度的测定总硬度 (Total hardness)是指水中钙、镁离子的总浓度,并换算成氧化钙计算。
硬度对工业用水关系很大,尤其是锅炉用水。
各种工业对水的硬度都有一定的要求。
饮用水中硬度过高会影响肠胃的消化功能,我国生活饮用水卫生标准中规定总硬度(以CaCO<sub>3</sub>计)不得超450mg/L。
总硬度的测定方法有:① EDTA 络合滴定法,此方法使用设备简单、快速,是一般常选用的方法。
② 原子吸收法,该方法简单、快速、灵敏、准确,干扰易于消除。
当用 EDTA 法测定有干扰时,最好改用原子吸收法。
③ 等离子发射光谱法,此方法快速、灵敏度高、干扰少,且可同时测定多种元素。
(一)实验方法:EDTA 络合滴定法(二)实验原理在 PH10 的条件下,用 EDTA 溶液络合滴定钙和镁离子,用铬黑T 作指示剂。
铬黑T能与水中钙和镁离子形成紫色或紫红色络合物。
滴定中游离的钙、镁离子首先与 EDTA 反应,与指示剂络合的钙和镁离子随后与EDTA反应,到达终点时,钙、镁离子全部与 EDTA 络合而使铬黑T 游离,溶液由紫红色变为天蓝色。
(三)仪器(1)50ml 酸式滴定管(2)100mL 量筒(3)250mL 三角瓶(四)药品(1)乙二胺四乙酸二钠(简称 EDTA-2Na 或Na<sub>2</sub>H<sub>2</sub>Y·2H<sub>2</sub>O )(2)氯化铵(3)硫酸镁(4)铬黑T(5)硫化钠(6)盐酸羟胺(7)浓氨水(8)碳酸钙或锌粒(9)氯化钠(五)试剂(1)氯化铵-氨水溶液(试剂A): 称取 16.9g 氯化铵,溶于 143mL 浓氨水中。
(2)EDTA-Mg 溶液(试剂B): 称取 0.78g 硫酸镁(MgSO<sub>4</sub>·7H<sub>2</sub>O)及1.179g EDTA-2Na 二水合物,溶于 50mL 蒸馏水中,加入 2mL 试剂A、5滴铬黑T 指示剂或 0.2g 铬黑T干粉,用 0.01mol/L EDTA 溶液滴定至溶液由紫红色变为天蓝色。

水中的总硬度用edta测定方法水中的总硬度是指水中钙离子和镁离子的总含量。
EDTA(乙二胺四乙酸)是一种常用的络合剂,能够与钙离子和镁离子形成稳定的络合物,因此可以用于测定水中的总硬度。
以下是使用EDTA测定水中总硬度的具体方法:一、实验原理EDTA与水中的钙离子和镁离子反应生成稳定的络合物,通过滴定法测定生成络合物的量,可以计算出水中的钙离子和镁离子的总浓度,从而得出水的总硬度。
二、实验步骤1.准备实验溶液:取100mL水样,加入2mL缓冲液(pH=10),摇匀备用。
2.滴定:将实验溶液放入三角瓶中,用EDTA标准溶液滴定至终点,记录消耗的EDTA体积(V1)。
3.绘制标准曲线:用不同浓度的钙离子和镁离子混合溶液绘制标准曲线,得到EDTA与钙离子和镁离子的反应方程式。
4.计算:根据滴定消耗的EDTA体积(V1)和反应方程式,计算出水样中钙离子和镁离子的总浓度,再根据换算系数计算出水的总硬度。
三、实验注意事项1.实验过程中要保证水样的pH值在规定范围内(一般要求pH=10),否则会影响实验结果。
2.滴定时要缓慢进行,并不断搅拌,以保证反应充分进行。
3.绘制标准曲线时,要使用相同浓度的缓冲液,以保证实验结果的准确性。
4.实验过程中使用的试剂和器具要保持清洁,避免污染实验溶液。
5.如果水样中含有其他金属离子(如铁、锌等),会影响EDTA与钙离子和镁离子的反应,因此需要进行相应的处理(如加入掩蔽剂)以保证实验结果的准确性。
四、实验结果分析通过滴定法测定水中总硬度的方法具有操作简便、快速准确等优点,适用于各种不同类型的水样。
实验结果可以通过计算得到水中钙离子和镁离子的总浓度,再根据换算系数计算出水的总硬度。
同时,也可以通过与标准曲线比较,判断水样中钙离子和镁离子的浓度是否符合规定要求。
五、实验结论通过使用EDTA滴定法测定水中总硬度的方法,可以得到水中钙离子和镁离子的总浓度,从而判断出水样的硬度状况。
实验结果表明,该方法具有操作简便、快速准确等优点,适用于各种不同类型的水样。

水中总硬度的测定—EDTA滴定法1范围本标准规定了水中总硬度的测定方法。
本标准适用于原水和循环冷却水中总硬度的测定。
2规范性文件下列文件的条款通过本标准的引用而成为本标准的条款。
中国石油化工总公司冷却水分析和试验方法。
3方法提要PH=10左右时,乙二胺四乙酸二钠盐(EDTA)能与水中的钙、镁离子生成稳定的络合物,钙、镁离子也能与指示剂生成络合物,但其稳定性不如EDTA与钙、镁离子所生成的络合物,当用EDTA滴定接近终点时,与指示剂络合的钙、镁离子被EDTA取代,从而显示出游离指示剂的颜色,指示终点。
4试剂和材料本标准中所用试剂和水,在没注明其它要求时,均使用分析纯试剂和蒸馏水或同等纯度的水。
本标准中所用标准溶液、制剂和制品,在没有其它要求时,均按GB/T601、GB/T603制备。
4.1 铬黑T指示剂:称取0.5g铬黑T和2.0g盐酸羟胺,溶于乙醇,用乙醇稀释至100ml。
此溶液使用前制备;4.2三乙醇胺溶液:1+2;4.3氨—氯化铵缓冲溶液:称取20g氯化铵,溶于100ml浓氨水中,用水稀释至1000ml;4.4乙二胺四乙酸二钠盐标准溶液:c(EDTA)=0.02500mol/L。
5仪器、设备5.1酸式滴定管:25ml;5.2量筒及刻度吸管;5.3锥形瓶:250ml。
6分析步骤取水样100ml于250ml锥形瓶中,加(4.2)三乙醇胺溶液2~3ml和(4.3)氨~氯化铵缓冲溶液5ml,再加(4.1)铬黑T指示剂约两滴,在剧烈摇动下,立即用(4.4)EDTA标准溶液滴定至溶液由酒红色变成纯蓝色即为终点。
7结果计算水样中总硬度以3CaCO 的质量分数x (mg/L )计,数值以()610-表示,按式(1)计算: ()61/100010V c M x V ρ⨯⨯=⨯⨯=1100.081000V c V ⨯⨯=⨯………..(1) 式中:V —消耗EDTA 标准溶液的体积,单位为毫升(ml );c —EDTA 标准溶液的浓度,单位为摩尔每升(mol/L );M —碳酸钙的摩尔质量的数值,单位为克每摩尔(g/mol );1V —水样的体积,单位为毫升(ml ); ρ—水样的密度,单位为克每立方厘米(g/3cm ),(一般情况下取ρ=1.0g/3cm )。

水的总硬度的测定11页概述水的总硬度是指水中所有容易生成沉淀的阳离子如钙离子(Ca2+)和镁离子(Mg2+)的总量。
本实验目的在于通过复杂度滴定法测定不同水样的总硬度,掌握复杂度滴定法的操作步骤,了解硬度及其测定方法,提高实验操作技能。
实验设备和试剂设备:电子天平、热水浴器、过滤瓶、50ml滴定瓶、分液漏斗、滴定管、移液管、比色皿、橙口柠檬酸等。
试剂:5%硝酸银溶液、0.05mol/L EDTA二钠溶液、N-(2-羟乙基)-乙二胺-N,N,N’,N'-四乙酸(简称EDTA)、环己二胺四乙酸(简称HEDTA)等。
实验原理硬度是指水中可生成包括镁、钙等卤水、碱性金属离子的总质量。
硬度以石灰度(数据单位:mg/L)、本质性(mg/L)和总硬度(mg/L)等单位表示。
总硬度就是水中钙和镁离子的含量总和,同时称作水的矿化度,是衡量水质优劣的重要指标。
此次实验中利用复杂度滴定法测定水样中的总硬度。
硬度是由水中的钙离子、镁离子等碱性金属离子所造成的. 在自然水中, 碳酸钙、碳酸镁和硫酸钙等多种化合物存在,这些化合物经水加热或沉淀过程,就会生成反应产物防止我们测量硬度.我们通过加入复杂度生成剂EDTA和指示剂,EDTA可以在和碱性金属离子形成稳定的络合物,保持在水样中,然后用AgNO3溶液与剩余的EDTA滴定复杂离子来测量复杂度。
通过这种方法,HEDTA等复杂生成剂同样能用来形成络合物,以测量样水中的总硬度。
实验流程实验分成两部分:1. 在硝酸镁溶液的帮助下,将样品中的阴离子全部沉淀,以此减少复杂离子对电位的影响,便于测量。
2. 加入复杂生成剂EDTA和指示剂,EDTA可以在和碱性金属离子形成稳定的络合物,保持在水样中,然后用AgNO3溶液与剩余的EDTA滴定复杂离子来测量复杂度。
具体操作步骤1. 样品的制备:按照固定方法筛选可能导致水样硬度变化的水源,将样品过滤至无明显悬浮物,这是接下来水样处理的基础条件。


实验七配位滴定法测定自来水的总硬度一、实验目的1、了解水的硬度的测定意义和常用硬度的表示方法;2、学习EDTA标准溶液的配制与标定;3、掌握配位滴定法测定自来水总硬度的原理和方法。
4、熟悉铬黑T指示剂终点颜色判断和近终点时滴定操作控制,了解金属指示剂的特点。
二、实验原理通常将含较多量Ca2+、Mg2+的水叫硬水,水的总硬度是指水中Ca2+、Mg2+的总量,它包括暂时硬度和永久硬度,水中Ca2+、Mg2+以酸式碳酸盐形式存在的称为暂时硬度,遇热即成碳酸盐沉淀。
反应如下:Ca(HCO3)2→ CaCO3(完全沉淀)+H2O+CO2↑Mg(HCO3)2→MgCO3(不完全沉淀)+H2O+CO2↑+H2OMg(OH)2↓+CO2↑若以硫酸盐、硝酸盐和氯化物形式存在的称为永久硬度,再加热亦不产生沉淀(但在锅炉运行温度下,溶解度低的可析出成锅垢)。
水的硬度是表示水质的一个重要指标,对工业用水关系极大。
水的硬度是形成锅垢和影响产品质量的重要因素。
因此,水的总硬度即水中Ca2+、Mg2+总量的测定,为确定用水质量和进行水的处理提供了依据。
由Mg2+形成的硬度称为“镁硬”,由Ca2+形成的硬度称为“钙硬”。
水的总硬度测定一般采用配位滴定法,在pH≈10的氨性缓冲溶液中,以铬黑T(EBT)为指示剂,用EDTA标准溶液直接测定Ca2+、Mg2+的总量。
由于K CaY>K MgY> K Mg·EBT>K Ca·EBT,铬黑T先与部分Mg配位为Mg·EBT(红色)。
当EDTA滴入时,EDTA与Ca2+、Mg2+配位,终点时EDTA夺取Mg·EBT的Mg2+,将EBT置换出来,溶液由红色变为蓝色。
测定钙硬时,另取等量水样加NaOH调节溶液pH为12~13,使Mg2+生成Mg(OH)2沉淀,加入钙指示剂用EDTA滴定,测定水中Ca2+的含量。
由EDTA溶液的浓度和用量,可算出水的总硬度,由总硬度减去钙硬即为镁硬。

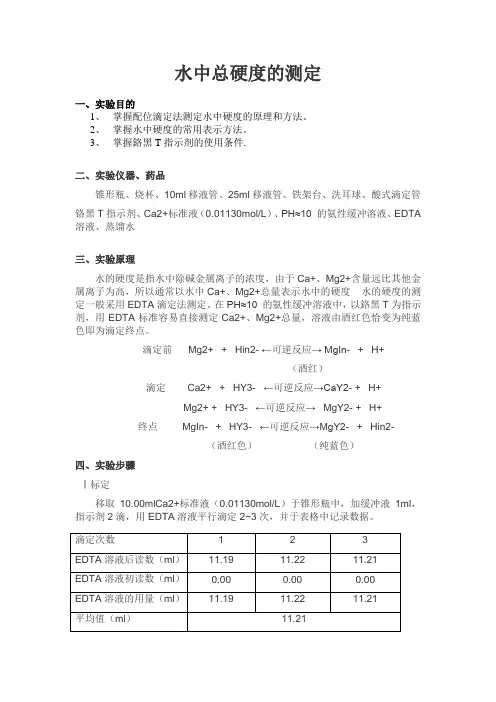
水中总硬度的测定一、实验目的1、掌握配位滴定法测定水中硬度的原理和方法。
2、掌握水中硬度的常用表示方法。
3、掌握鉻黑T指示剂的使用条件.二、实验仪器、药品锥形瓶、烧杯、10ml移液管、25ml移液管、铁架台、洗耳球、酸式滴定管铬黑T指示剂、Ca2+标准液(0.01130mol/L)、PH≈10 的氨性缓冲溶液、EDTA 溶液、蒸馏水三、实验原理水的硬度是指水中除碱金属离子的浓度,由于Ca+、Mg2+含量远比其他金属离子为高,所以通常以水中Ca+、Mg2+总量表示水中的硬度水的硬度的测定一般采用EDTA滴定法测定。
在PH≈10 的氨性缓冲溶液中,以鉻黑T为指示剂,用EDTA标准容易直接测定Ca2+、Mg2+总量,溶液由酒红色恰变为纯蓝色即为滴定终点。
滴定前Mg2+ + Hin2- ←可逆反应→ MgIn- + H+(酒红)滴定 Ca2+ + HY3- ←可逆反应→CaY2- + H+Mg2+ + HY3- ←可逆反应→MgY2- + H+终点MgIn- + HY3- ←可逆反应→MgY2- + Hin2-(酒红色)(纯蓝色)四、实验步骤Ⅰ标定移取10.00mlCa2+标准液(0.01130mol/L)于锥形瓶中,加缓冲液1ml,指示剂2滴,用EDTA溶液平行滴定2~3次,并于表格中记录数据。
Ⅱ测定移取25.00ml自来水于锥形瓶中,加缓冲液1ml,指示剂2滴,滴定至终点,平行滴定2~3次,并于表格中记录数据。
五、实验数据记录及处理实验数据已填于上述表格中实验数据计算:EDTA溶液浓度标定:由C(Ca2+)*V(Ca2+)=C(EDTA)*V(EDTA)得C(EDTA)= C(Ca2+)*V(Ca2+)/V(EDTA)= 0.01130mol/l*10.00ml/11.21ml =0.01008mol/l自来水硬度测定:由n(EDTA)=C(EDTA)V(EDTA)n(Caco3):n(EDTA)=1:1 n(Caco3)=m (Caco3)/ M(Caco3)自来水硬度ρ=m (Caco3)/ Vaq 所以计算可得ρ=0.135g/l=135mg/l六、注意事项:1.各个使用仪器用前需要润洗的注意润洗;2. 络合反应速度较慢,滴定时滴加速度不能太快,特别是临近终点时,要边滴边摇晃。

水的总硬度的测定水的总硬度的测定一、目的要求1.了解EDTA测定水的总硬度的基本原理。
2.把握水的总硬度的测定方法。
二、基本原理在pH=10时,EDTA能与钙、镁形成稳定的搭配物,其稳定性比铬黑T与镁形成的搭配物的稳定性强。
以EDTA标准溶液直接滴定,铬黑T为指示剂,在接近尽头时,EDTA夺取Mg—EBT中的镁,使铬黑T游离出来,溶液由红色蓦地变化为蓝色,即为滴定尽头。
滴定时,加入三乙醇胺和KCN来除去水中少量的Fe3+、Al3+、Cu2+、Pb2+等离子的干扰。
三、试剂1.铬黑T指示剂:0.5g铬黑T与50g氯化钠充分混合。
2.氨—氯化铵缓冲溶液(pH=10):称取5.4g氯化铵,加适量水溶解后,加入35ml氨水,再加水稀释至100ml。
3.1%KCN溶液4.1:1三乙醇胺5.1:1HCl溶液6.钙指示剂:0.5g钙指示剂与50g氯化钠充分混合7.0.01mol/L钙标准溶液: **称取干燥(110℃)至恒重的0.5g基准碳酸钙于250ml烧杯中,用1:1的HCl溶液加热完全溶解,冷却后转入500ml的容量瓶中,用水稀释至刻度,摇匀。
8.0.01mol/LEDTA标准溶液的配制与标定。
配制:称取3.7gEDTA二钠盐(分子量为372.2),用去离子水稀释至1000ml,摇匀,贮存于聚乙烯瓶中待标定。
标定:用移液管精准移取25.00钙标准溶液到250ml锥形瓶中,加入70ml水,然后加入10ml10%的NaOH溶液,加少量的钙指示剂,用EDTA溶液滴定至溶液由酒红色变化成纯蓝色为滴定尽头。
记录消耗EDTA的体积V(EDTA)。
平行测定三次。
计算公式:c(EDTA)=四、操作方法精准吸取水样100.00ml于锥形瓶中,加入三乙醇胺6ml、KCN 溶液1ml、氨—氯化铵缓冲溶液10ml、铬黑T指示剂少许,用EDTA 标准溶液滴定至溶液由红色变为蓝色即为尽头。
记录消耗EDTA标准溶液的体积。
平行测定三次。

一、实验原理总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L水中含的碳酸钙的mg数,即mg/L.钙硬度即每1L水中含的钙离子的mg数,mg/L.镁硬度即每1L水中含的镁离子的mg数,mg/L测定条件:以NH3-NH4Cl 缓冲溶液控制溶液pH=10,以铬黑T为指示剂,用EDTA滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA的滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA的体积即可换算出水样的总硬度。
总硬度=(CV1)EDTA M CaCO3/0.1实验步骤总硬度的测定用100mL吸管移取2份水样,分别加5mL NH3-NH4Cl 缓冲溶液(PH=10),2~3滴铬黑T指示剂,用EDTA标准溶液滴定,溶液由酒红色变为纯蓝色即为终点。
NH3-NH4Cl 缓冲溶液(PH=10):取氯化铵5.4g,加水20ml溶解后,加浓氨溶液35ml,再加水稀释至100ml,即得。
液态铬黑T的配制方法:称取0.50g铬黑T和2.0g盐酸羟胺溶于乙醇,用三乙醇胺稀释至100ml冰箱冷藏3个月。
选择工作基准试剂的原则是与测定对象尽量一致,因此在水硬度的测定中,标定EDTA溶液的工作基准试剂也可选用CaCO3。
<1> CaCO3基准试剂的干燥将CaCO3放烘箱中于393K下干燥2h,稍冷后置于干燥器中冷至室温。
<2> CaCO3标准溶液配制准确称取0.17~0.20gCaCO3,先用少量水湿润,盖上表面皿,缓慢加1:1 HCl 10mL,加热溶解。
溶解后将溶液转入250mL容量瓶中,用水稀释至刻度,摇匀。
<3> 0.01mol·L-1 EDTA标准溶液的标定a. 用吸管吸取25.00mLCa2+试液,加入10mLpH=10的氨缓冲溶液,2~3滴K-B指示剂(0.2g酸性铬蓝K和0.4g萘酚B,配制为1000mL水溶液),用EDTA溶液滴定至溶液由紫红色变为蓝绿色,即为终点。

水的总硬度的测定实验报告《水的总硬度的测定实验报告》实验目的:本实验旨在通过测定水样的总硬度,了解水中的钙和镁离子含量,从而评估水的质量。
实验原理:水的总硬度是指水中钙和镁离子的总和。
通常使用EDTA(乙二胺四乙酸)滴定法来测定水样的总硬度。
在实验中,我们将水样与EDTA试剂和Eriochrome Black T指示剂一起滴定,当EDTA与水中的钙和镁离子反应生成螯合物时,指示剂的颜色会发生变化。
通过记录滴定消耗的EDTA滴数,再结合反应方程式,就可以计算出水样的总硬度。
实验步骤:1. 取适量水样倒入容器中。
2. 加入Eriochrome Black T指示剂,使水样呈现出明显的蓝色。
3. 用标定好的EDTA溶液滴定水样,同时搅拌容器。
4. 当水样颜色由蓝色变为粉红色时,停止滴定,并记录所耗EDTA滴数。
5. 重复以上步骤,直至结果一致。
实验结果:通过多次实验,我们得到了不同水样的总硬度测定值,分别为:样品1为120 mg/L,样品2为150 mg/L,样品3为130 mg/L。
实验分析:根据实验结果,我们可以得出不同水样的总硬度不同,说明它们含有不同程度的钙和镁离子。
根据相关标准,水样的总硬度在某一范围内属于优质饮用水,而超出范围则可能对人体健康造成影响。
因此,通过测定水样的总硬度,可以评估水的质量,为水质监测和饮用水处理提供重要参考。
结论:本实验通过EDTA滴定法测定了水样的总硬度,得到了水样中钙和镁离子的含量。
实验结果表明,不同水样的总硬度存在差异,这对水质的评估具有重要意义。
在实际应用中,我们可以根据水样的总硬度来评估水的质量,并采取相应的处理措施,以保障人们的饮用水安全。
水的总硬度测定水的总硬度测定实验目的1、学习EDTA 标准溶液的配制与标定方法。
2、学习水的总硬度的测定方法。
3、了解金属指示剂的变色原理和使用方法。
实验原理由于EDTA 酸不易溶于水,通常采用EDTA 二钠盐配制标准溶液。
0.1mol/L EDTA 二钠盐溶液的PH ,按理论计算,应为4.42,一般不用市售的EDTA 试剂直接配制准确浓度的标准溶液,而需要用适当的基准物来标定。
用于标定EDTA 溶液的基准物很多,常用的有Zn 、ZnO 、CaCO 3、Mg 、Cu 等,本实验采用CaCO 3溶解并制成钙标准溶液。
吸取一定量此标准溶液,用 NH 3-NH 4Cl(pH=10)缓冲溶液,以K-B 为指示剂,用0.01mol ·L -1EDTA 溶液滴定至溶液由紫红色变为蓝绿色,即为终点。
水的硬度主要是由于水中含钙盐和镁盐所形成。
硬度对工业用水关系很大,如锅炉给水要经常进行硬度分析,为水的处理提供依据。
在水中以碳酸氢盐形式存在的钙、镁盐,加热能被分解,析出沉淀而除去,这类盐所形成的硬度称为暂时硬度。
例如O H CO CaCO HCO Ca 22323)(+↑+↓−→−∆Mg(HCO 3)23(沉淀不完全)+CO +H 2O+H 2OMg(OH) +CO而钙、镁的硫酸盐、氯化物、硝酸盐等所形成的硬度称为永久硬度,暂时硬度和永久硬度之和为总硬度。
测定水的总硬度就是测定水中钙、镁的总量,一般采用EDTA 配位滴定法。
用EDTA 滴定水中Ca 2+、Mg 2+离子总量时,采用NH 3·H 2O -NH 4CL 缓冲溶液控制溶液的酸度为PH =10,以铬黑T 为指示剂,滴定至溶液由酒红色变为纯蓝色即为终点:+--=--++−−→−+H HIn MgY Y H MgI PH a 221022 式中H 2Y 2-表示EDTA ,Hi n 2-表示铬黑T 。
酒红色 蓝色水的硬度有多种表示方法,随各国的习惯而有所不同,目前我国通常是以度(°)计。
⽔的总硬度测定实验⼆、⽔的总硬度的测定⼀、实验⽬的1.学习EDTA标准溶液的配制及标定⽅法。
2.了解⽔的硬度的测定意义和常⽤的硬度表⽰⽅法。
3.掌握EDTA法测定⽔的硬度的原理和⽅法。
4.掌握铬⿊T等⾦属指⽰剂的应⽤,了解⾦属指⽰剂的特点。
⼆、实验原理1⼄⼆胺四⼄酸(简称EDTA)能和Ca2+Zn2+ Mg2+等许多⾦属离⼦按照1:1的⽐例络合,形成⽆⾊的EDTA⾦属络合物。
M n+代表⾦属离⼦,Y代表EDTA, 上述反应可⽤下式表⽰:M n++ Y----[MY]n+。
根据络合反应到达终点,即⾦属离⼦完全被络合时所消耗的EDTA的量,推算出⾦属离⼦的量。
反之,也可以根据⾦属离⼦的量推算EDTA的量如何判断⾦属离⼦完全被络合了呢?需要⽤⾦属指⽰剂来指⽰。
⾦属指⽰剂也能够和⾦属离⼦形成络合物,⽽且指⽰剂本⾝的颜⾊和指⽰剂与⾦属离⼦形成的络合物的颜⾊是不同的。
(⼆甲酚橙指⽰剂本⾝显黄⾊,与Zn2+等的络合物呈紫红⾊,铬⿊T 指⽰剂本⾝显蓝⾊,与Zn2+等的络合物呈紫红⾊)同时,指⽰剂和⾦属离⼦的络合能⼒要⽐EDTA络合能⼒弱。
⽤EDTA溶液滴定⾄近终点时,指⽰剂被游离了出来,溶液发⽣颜⾊改变。
2、⽔的硬度主要是⽔中含有Ca2+和Mg2+离⼦形成的,其他⾦属离⼦如Al3+、Fe3+、Mn2+、Zn2+、Cu2+等离⼦也形成硬度,但⼀般含量甚微,在测量硬度时可忽略不计。
硬度有暂时硬度和永久硬度,⽔中的Ca2+、Mg2+的酸式碳酸盐加热能被分解出沉淀⽽除去,这种盐形成的硬度叫暂时硬度,Ca、Mg的其他盐类(如硫酸盐、氯化物等),经加热不能分解,这种盐形成的硬度叫永久硬度,暂时硬度和永久硬度的总和就是总硬度。
测定⽔的总硬度⼀般采⽤络合滴定法,⽤EDTA标准溶液直接测定Ca、Mg总量,然后换算成相应的硬度单位。
测Ca、Mg总量时,⼀般是在pH=10的氨性缓冲溶液中进⾏,⽤铬⿊T做指⽰剂,等当点前,Ca、Mg和铬⿊T形成紫红⾊的络合物,当⽤EDTA标准溶液滴定⾄等当点时,游离出指⽰剂,溶液呈现铬⿊T的纯蓝⾊。
一、实验目的1. 了解水的硬度及其表示方法;2. 掌握EDTA滴定法测定水总硬度的原理和方法;3. 熟悉酸度控制、指示剂选择等实验操作;4. 培养学生分析问题、解决问题的能力。
二、实验原理水的硬度是指水中钙、镁离子的含量。
通常,水的硬度分为总硬度和暂时硬度。
总硬度是指水中所有钙、镁离子的含量,暂时硬度是指水中可溶性碳酸盐的钙、镁离子含量。
本实验采用EDTA滴定法测定水总硬度。
EDTA滴定法的基本原理是:在一定的pH条件下,EDTA与钙、镁离子形成稳定的络合物,根据络合物形成的颜色变化来判断滴定终点。
本实验采用铬黑T作为指示剂,在pH=10的氨性溶液中,铬黑T与钙、镁离子形成酒红色络合物。
随着EDTA的加入,络合物中的金属离子逐渐被EDTA夺出,释放出铬黑T,使溶液颜色由酒红色变为纯蓝色,此时即为滴定终点。
三、实验仪器与试剂1. 仪器:移液管、锥形瓶、酸式滴定管、滴定台、滴定夹、滴管、电子天平、pH计2. 试剂:EDTA标准溶液(0.02mol/L)、NH3-NH4Cl缓冲溶液、铬黑T(0.5%)、三乙醇胺(1:2)、NaOH(40g/L)、水样四、实验步骤1. 配制EDTA标准溶液:准确称取0.18g乙二胺四乙酸二钠(EDTA),溶解于100mL水中,转移至1000mL容量瓶中,定容至刻度,摇匀。
此溶液为0.02mol/L的EDTA标准溶液。
2. 准备水样:取适量水样,用移液管移取100.00mL水样于锥形瓶中。
3. 加入三乙醇胺:向锥形瓶中加入1.0mL三乙醇胺溶液。
4. 加入NH3-NH4Cl缓冲溶液:向锥形瓶中加入1.0mLNH3-NH4Cl缓冲溶液。
5. 加入铬黑T:向锥形瓶中加入少量铬黑T(约0.05g)。
6. 滴定:用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。
7. 记录消耗的EDTA标准溶液体积V1。
8. 重复实验两次,求平均值。
五、数据处理1. 计算水总硬度:根据EDTA标准溶液的浓度、消耗体积以及水样的体积,计算水总硬度(以CaCO3计)。
水的总硬度测定实验报告水的总硬度测定实验报告引言:水是人类生活中必不可少的资源,但不同地区的水质存在差异。
其中一个重要的指标是水的硬度,它影响着水的使用和处理方式。
本实验旨在通过测定水的总硬度,了解水质的特点,并探讨硬水对生活和环境的影响。
实验目的:1. 学习使用EDTA滴定法测定水的总硬度;2. 了解不同水样的硬度差异;3. 探讨硬水对生活和环境的影响。
实验原理:水的硬度主要由钙离子(Ca2+)和镁离子(Mg2+)所引起。
EDTA(乙二胺四乙酸)是一种能与钙和镁形成稳定络合物的螯合剂。
利用EDTA与钙、镁离子的络合反应,可以测定水的总硬度。
实验步骤:1. 取一定量的水样,加入几滴甲基橙指示剂,溶解均匀;2. 使用标准EDTA溶液滴定水样,直到溶液由红色变为橙色;3. 记录滴定过程中所需的EDTA溶液体积;4. 重复以上步骤,取其他水样进行测定。
实验结果:通过实验测定,我们得到了不同水样的总硬度浓度。
例如,自来水样品A滴定所需的EDTA溶液体积为20mL,而自来水样品B滴定所需的EDTA溶液体积为15mL。
根据EDTA溶液的浓度,可以计算出水样的总硬度。
实验讨论:1. 不同水样的硬度差异:通过测定不同水样的总硬度,我们发现不同地区的水质存在明显差异。
这是由于地下水中的溶解矿物质含量不同所致。
硬度高的水样可能含有较高浓度的钙和镁离子。
2. 硬水对生活和环境的影响:硬水在洗涤和清洁过程中容易形成水垢,影响清洁效果。
此外,硬水还会导致管道和设备的堵塞,增加维护成本。
对于植物和土壤来说,硬水中的钙和镁离子可以提供植物所需的营养,但过量的钙和镁离子也会对植物生长产生负面影响。
结论:本实验通过EDTA滴定法测定了不同水样的总硬度,并讨论了硬水对生活和环境的影响。
实验结果表明,不同地区的水质存在明显差异,硬水对于洗涤和清洁过程有一定的影响。
通过深入研究水的硬度,我们可以更好地了解水质特点,并采取相应的措施来解决硬水问题,提高水资源的利用效率。
水中总硬度测定方法
嘿,朋友们!今天咱就来聊聊水中总硬度测定方法这档子事儿。
你说这水啊,就跟人似的,表面看着都差不多,但内里的“性格”可不一样呢!水中的总硬度就是它的一个重要“性格特点”。
那怎么知道这水的“硬脾气”有多大呢?这就得靠一些特别的方法啦!
咱可以用一种叫“EDTA 滴定法”的玩意儿。
这就好比是一场水和试剂的“舞蹈比赛”。
EDTA 就像是个厉害的裁判,它能和水中的钙离子、镁离子这些“舞蹈选手”结合。
我们先在水里加点指示剂,就像给这场“舞蹈”加上了聚光灯。
然后慢慢滴加 EDTA 这个裁判,看着颜色的变化,就知道比赛啥时候结束啦!等颜色一变,嘿,那就是我们得到答案的时候咯!
还有一种方法叫“原子吸收分光光度法”。
这可厉害了,就好像是给水里的钙离子、镁离子拍了个超级清楚的“特写照片”。
通过这个特别的“相机”,我们能准确地知道它们的数量,从而了解水的硬度。
你想想啊,如果我们不搞清楚水的硬度,那可就麻烦啦!就好比你要做一道美味的汤,结果水太硬,那汤的味道能好吗?或者你洗衣服的时候,水硬邦邦的,衣服能洗得干净又舒服吗?所以说啊,搞清楚水中总硬度真的超级重要呢!
咱普通人可能平时不太会去专门测这个,但了解一下总没坏处呀!说不定哪天就用上了呢。
就像你平时可能不会特意去学修水管,但哪天水管漏了,你知道点小常识不就能更好地应对啦?
总之呢,水中总硬度测定方法就像是打开水的秘密之门的钥匙。
我们了解了它,就能更好地和水这个“朋友”相处啦!你说是不是这个理儿呢?别小看这小小的测定方法,它可有着大用处呢!。
水的总硬度的测定实验课时:4学时实验类型:综合性实验教学对象:本科生一、目的与要求1.掌握络合滴定法的原理及其应用。
2. 熟悉络合滴定法中的直接滴定法、滴定条件的选择及指示剂的应用。
3.了解水的硬度的概念及其表示方法。
二、方法与原理水的总硬度是指水中钙镁离子的总量。
测定水的硬度常采用配位滴定法,用EDTA溶液滴定水中Ca、Mg总量,然后换算为相应的硬度单位。
用EDTA滴定钙镁离子总量时,一般是在pH=10的NH3—NH4Cl缓冲溶液中进行,以铬黑T(EBT)为指示剂。
化学计量点前,Mg2+与铬黑T形成酒红色络合物,滴入EDTA后,金属离子逐步被络合,当达到反应化学计量点时,已与指示剂络合的金属离子被EDTA夺出,游离出指示剂,使溶液由酒红色变为纯蓝色。
滴定过程反应如下:滴定前:EBT + Mg2+ = Mg-EBT(蓝色) (酒红色)滴定时:EDTA + Ca2+ = Ca-EDTA(无色)EDTA + Mg2+ = Mg-EDTA(无色)终点时: EDTA + Mg-EBT = Mg-EDTA + EBT(酒红色) (蓝色)若水样中存在Fe3+,Al3+等微量杂质时,可用三乙醇胺进行掩蔽,Cu2+ 、Pb2+、Zn2+等重金属离子可用Na2S或KCN掩蔽。
水硬度的测定分为水的总硬度以及钙-镁硬度,前者是测定Ca、Mg总量,后者是分别测定Ca、Mg分量。
如测定钙硬度,可控制pH介于12~13之间,选用钙指示剂进行测定。
镁硬度可由总硬度减去钙硬度求出。
三、内容提要1.EDT A溶液的配制天平称取计算量的EDTA二钠盐于200ml烧杯中,加水温热溶解,冷却。
2.EDT A的标定用CaCO3为基准物质,铬黑T为指示剂标定EDTA3.水总硬度的测定取水样100mL于锥形瓶中,加HCl1~2滴酸化水样,煮沸数分钟以除去CO2,冷却后加入5mL1∶1三乙醇胺(若水样中含有重金属离子,则加入1mL2%Na2S溶液掩蔽),5mL氨性缓冲溶液,2~3滴铬黑T(EBT)指示剂,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色即为终点。