甲苯氯化中氯化氢的氧化与循环
- 格式:pdf
- 大小:277.74 KB
- 文档页数:4
![甲苯氯化制备对氯甲苯和邻氯甲苯的方法[发明专利]](https://uimg.taocdn.com/54f25eba690203d8ce2f0066f5335a8102d26619.webp)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101497552A [43]公开日2009年8月5日[21]申请号200910030310.7[22]申请日2009.03.19[21]申请号200910030310.7[71]申请人江苏钟腾化工有限公司地址212300江苏省丹阳市化工路3号[72]发明人钟华 陆敏山 刘巧宝 孙建平 潘晓鑫 [74]专利代理机构镇江京科专利商标代理有限公司代理人夏哲华[51]Int.CI.C07C 25/02 (2006.01)C07C 17/12 (2006.01)C07C 17/383 (2006.01)权利要求书 3 页 说明书 8 页 附图 3 页[54]发明名称甲苯氯化制备对氯甲苯和邻氯甲苯的方法[57]摘要甲苯氯化制备对氯甲苯和邻氯甲苯的方法,是原料甲苯进干燥器干燥后和氯气在催化剂的作用下,进行直接氯化,得到混氯甲苯、副产盐酸和少量残渣,氯化工艺得到的混氯甲苯作为原料送到混氯甲苯分离工艺,经精密分馏得到邻氯甲苯,对氯甲苯和少量的残液。
采用本发明,塔式固定床循环氯化工艺,这保证了气液接触更加充分,反应热能及时移出,反应效果更佳,副产物减少,解决了传统吸收过程中正压或常压系统中氯化氢气体泄漏导致的环境污染问题。
避免了废水的产生,两塔串联连接的精馏分离方式,降低了塔的安装高度,提高了分离效率,最终产品对氯甲苯和邻氯甲苯的纯度均≥99.9%wt。
200910030310.7权 利 要 求 书第1/3页 1、甲苯氯化制备对氯甲苯和邻氯甲苯的方法,是原料甲苯进干燥器干燥后与氯气在催化剂的作用下,进行直接氯化得到混氯甲苯、副产盐酸和少量残渣,氯化工艺得到的混氯甲苯作为二次原料送到混氯甲苯分离工艺,经精密分馏得到邻氯甲苯、对氯甲苯和少量的残液;其特征在于:1)、所述的直接氯化法:是以甲苯为原料,经干燥器(1)干燥后与辅助催化剂在配料槽(2)内搅拌均匀,将物料打入氯化塔(3)内,启动氯化循环泵,缓慢开启氯气进料流量计,在催化剂的作用下进行氯化反应,根据反应塔内温度控制氯气流量,塔温控制在25℃-72℃之间,绝压压力为0.06~0.095Mpa,氯化液循环氯化,通过冷却器(4)移出反应热;氯化产生的氯化氢气体通过尾气吸收装置生成盐酸,在取样检测达到指标值后停止氯化,向蒸馏釜(5)出料,蒸馏釜(5)釜温60℃-155℃,釜内绝压0.05~0.085Mpa,氯化液在蒸馏釜(5)内先利用真空抽吸和蒸汽加热进行曝气,脱除溶解的氯化氢气体,然后再经过蒸馏去除催化剂,进入脱甲苯塔(6),脱除未反应的甲苯和轻组分后得到主要含对氯甲苯和邻氯甲苯的混合物即混氯甲苯;2)、所述的混氯甲苯分离工艺:是将混氯甲苯连续进入塔内温度为70℃-130℃,绝压压力为0.003~0.025Mpa的初分塔(10)顶部,塔顶富含邻氯甲苯的混合物进入邻塔I(12),邻塔I(12)的汽相直接通入邻塔I I(14)底部,邻塔I(12)和邻塔I I(14)的塔内温度为70℃-125℃,绝压压力为0.008~0.028Mpa,邻塔II(14)底部物料通过循环泵泵入邻塔I(12)顶部,邻塔I I(14)顶部得到产品邻氯甲苯其含量≥99.9%wt,邻塔I(12)塔底馏分进初分塔(10)循环分离;同时初分塔(10)底部富含对氯甲苯的物料进入对塔II(17)顶部,对塔II塔(17)顶得到轻组分进初分塔循环分离,对塔II(17)塔底物料通过循环泵泵入对塔I(15)顶部,对塔I(15)和对塔I I (17)的塔内温度为80℃-135℃,绝压压力为0.005~0.020Mpa,对塔I(15)的汽相直接通入对塔I I(17)的底部,对塔I(15)底部得到对氯甲苯中间料进入贮槽(18),对氯甲苯中间料泵入塔内温度为90℃-140℃,绝压压力为0.003~0.015Mpa的对精塔(19)顶部连续精馏,塔顶得到含量≥99.9%wt高纯度的对氯甲苯,塔底为残液。

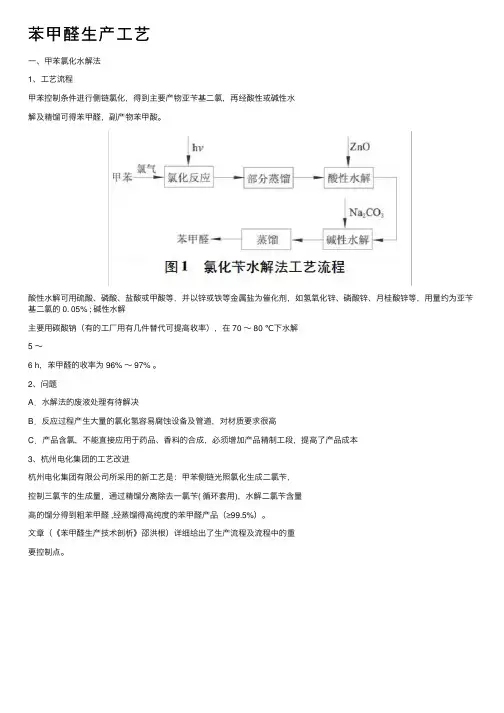
苯甲醛⽣产⼯艺⼀、甲苯氯化⽔解法1、⼯艺流程甲苯控制条件进⾏侧链氯化,得到主要产物亚苄基⼆氯,再经酸性或碱性⽔解及精馏可得苯甲醛,副产物苯甲酸。
酸性⽔解可⽤硫酸、磷酸、盐酸或甲酸等,并以锌或铁等⾦属盐为催化剂,如氢氧化锌、磷酸锌、⽉桂酸锌等,⽤量约为亚苄基⼆氯的 0. 05% ; 碱性⽔解主要⽤碳酸钠(有的⼯⼚⽤有⼏件替代可提⾼收率),在 70 ~ 80 ℃下⽔解5 ~6 h,苯甲醛的收率为 96% ~ 97% 。
2、问题A.⽔解法的废液处理有待解决B.反应过程产⽣⼤量的氯化氢容易腐蚀设备及管道,对材质要求很⾼C.产品含氯,不能直接应⽤于药品、⾹料的合成,必须增加产品精制⼯段,提⾼了产品成本3、杭州电化集团的⼯艺改进杭州电化集团有限公司所采⽤的新⼯艺是:甲苯侧链光照氯化⽣成⼆氯苄,控制三氯苄的⽣成量,通过精馏分离除去⼀氯苄( 循环套⽤),⽔解⼆氯苄含量⾼的馏分得到粗苯甲醛 ,经蒸馏得⾼纯度的苯甲醛产品(≥99.5%)。
⽂章(《苯甲醛⽣产技术剖析》邵洪根)详细给出了⽣产流程及流程中的重要控制点。
⼆、甲苯液相氧化法1. 钴盐为催化剂、溴化物为催化助剂、空⽓为氧源的液相氧化⼯艺此⼯艺中苯甲醛作为副产物⽣产,经常出现在以甲苯为原料⽣产⼰内酰胺(意⼤利SNIA⼯艺)、苯甲酸的⼯艺流程中。
国外早已⼯业化,国内没有使⽤此法将苯甲醛作为主产品的⽣产⼚家。
优点:产品不含氯,应⽤范围⼴缺点:氧化⼯艺不好控制,甲苯很容易被过度氧化成苯甲酸;产品中杂质较多,除苯甲醇、苯甲酸外还存在苯甲酸苄酯等酯类化合物。
⽽且,甲苯的单程转化率不超过20%,若要提⾼苯甲醛的选择性还需要进⼀步降低甲苯转化率到个位数⽔平,增加了⽣产中的动⼒消耗改进措施:A.可以通过加⼊惰性⽓体的⽅式控制氧源中氧⽓的浓度防⽌过度氧化B.降低反应温度,减少物料在反应器中的停留时间C.在反应体系中加⼊⼀种或多种脂肪族或芳⾹族的含氮化合物,提⾼苯甲醛在反应产物中的分布2. 三氧化⼆锰法绿⾊氧化⼯艺利⽤⼆氧化锰在 650 ℃下灼烧得到三氧化⼆锰,使⽤该原料与中等浓度的硫酸与甲苯在反应器内进⾏固、油、⽔三相反应,甲苯氧化成苯甲醛。


突破07 包含特殊装置的有机实验1.氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。
现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:回答下列问题:(1)仪器E的名称是____________;其作用是_______________________;其进水口为____________(填“a”或“b”)。
(2)装置B中的溶液为____________;装置F的作用是________________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________。
(4)装置A中反应的离子方程式为____________________________________。
(5)检测氯化苄样品的纯度:①称取13.00g样品于烧杯中,加入50.00mL4mol•L-1NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40%HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。
取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是________________________。
【答案】(1)球形冷凝管导出Cl2、HCl气体,冷凝回流甲苯 b (2)饱和食盐水防止水蒸气进入装置(3)使漏斗与烧瓶内压强一致,液体顺利流下(4)2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O (5)97.3 样品混有二氯化苄、三氯化苄等杂质【解析】(1)根据仪器构造可知仪器E的名称是球形冷凝管,其作用是导出Cl2、HCl气体,冷凝回流甲苯;冷却时才有逆向冷却,则其进水口为b;(2)生成的氯气中含有氯化氢,则装置B中的溶液为饱和食盐水,用来除去氯化氢;装置F中的无水氯化钙是干燥剂,其作用是防止水蒸气进入D装置;(3)恒压滴液漏斗可以保持内外压强相等,因此用恒压滴液漏斗代替分液漏斗的优点是使漏斗与烧瓶内压强一致,液体顺利流下;(4)装置A中制备氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(5)①2.87g固体是氯化银,物质的量是2.87g÷143.5g/mol=0.02mol,因此根据氯原子守恒可知氯化苄的物质的量是0.02mol×100mL/20mL=0.1mol,质量是0.1mol×126.5g/mol=12.65g,则该样品的纯度为12.65g13.00g×100%=97.3%;②由于样品混有二氯化苄、三氯化苄等杂质,因此实际测量结果可能偏高。

甲苯与氯气反应方程式甲苯与氯气反应是一种重要的有机合成反应,在化学工业中有着广泛的应用。
该反应可以通过以下方程式表示:C6H5CH3 + Cl2 → C6H5Cl + HCl甲苯与氯气反应生成氯代甲苯和氯化氢。
甲苯是一种有机化合物,化学式为C6H5CH3。
它是一种无色液体,有特殊的香气,常用作溶剂和原料。
氯气是一种无色刺激性气体,化学式为Cl2,具有强烈的腐蚀性。
甲苯与氯气反应是一种卤代烃的合成反应,该反应通常在光照或加热的条件下进行。
在该反应中,甲苯的苯环上的氢原子被氯气中的氯原子取代,形成氯代甲苯。
反应过程中,氯气分子中的一个氯原子与甲苯分子中的氢原子发生亲电取代反应,生成一个氯代甲苯分子,并释放出一个氯化氢分子。
这个反应属于亲电取代反应,由于甲苯中的苯环具有电子密度较高的特点,容易受到亲电试剂的攻击。
氯气中的氯原子是一种强亲电试剂,可以与甲苯中的氢原子发生取代反应。
在反应中,氯原子被苯环上的氢原子替代,形成氯代甲苯。
甲苯与氯气反应的机理可以简单描述为以下几个步骤:1. 氯气分子吸附到甲苯的苯环上。
2. 氯气中的氯原子与甲苯分子中的氢原子发生亲电取代反应,生成氯代甲苯。
3. 生成的氯代甲苯与氯气继续反应,进一步取代甲苯分子中的氢原子,生成更多的氯代甲苯。
4. 反应生成的氯化氢与甲苯中的氢原子进一步反应,生成氯代甲苯和氯化氢。
甲苯与氯气反应是一种重要的有机合成反应,可以用于制备氯代甲苯。
氯代甲苯是一种重要的有机化合物,在化学工业中有广泛的应用,可以用作溶剂、化学试剂和原料。
此外,甲苯与氯气反应还可以用于制备其他卤代甲苯化合物,如溴代甲苯和碘代甲苯。
甲苯与氯气反应是一种重要的有机合成反应,通过该反应可以合成氯代甲苯和氯化氢。
这个反应的机理涉及亲电取代反应,甲苯中的氢原子被氯气中的氯原子取代。
甲苯与氯气反应在化学工业中具有广泛的应用,可以用于制备各种卤代甲苯化合物。

一、氯化1、定义氯化是指以氯原子取代有机化合物中氢原子的反应,根据氯化反应条件的不同,有热氯化、光氯化、催化氯化等,在不同条件下,可得不同产品。
广泛应用的氯化剂有:液态氯、气态氯、气态氯化氢、各种浓度的盐酸、磷酰氯、硫酰氯、三氯化磷等。
2、应用氯化反应广泛应用于制造溶剂、各种杀虫剂、医药、农药、精细化工原料及中间体。
3、氯化反应的危险性分析(1)氯化反应的各种原料、中间产物及部分产品都是有不同程度的火灾危险性。
如烷烃、芳烃等。
(2)氯化剂具有极大的危险性,氯气为强氧化剂,能与可燃气体形成爆炸性气体混合物,能与可燃烃类、醇类、羧酸和氯化烃等形成二元混合物,极易发生爆炸。
氯气与烯烃形成的混合物,在受热时可自燃;与乙炔的反应更为激烈,有氧气存在时,甚至在-78℃的低温也可发生爆炸。
(3)氯化反应是放热反应,有些温度高达500℃,甚至更高,如反应失控,可造成超压爆炸。
某些氯化反应可自行加速,导致爆炸危险。
(4)液氯气化时高热使液氯剧烈气化,可造成内压过高而爆炸。
工艺操作不当使反应物倒灌至液氯钢瓶,则可能与氯发生激烈反应引起爆炸。
(5)氯化氢吸收装置如发生故障,不能完全被吸收,大量氯化氢逸出会造成中毒事故及腐蚀事故的发生。
(6)氯气缓冲罐若不定期排放三氯化氮,可能因三氯化氮积聚造成爆炸事故的发生。
4、氯化反应的安全技术要点(1)车间厂房设计应符合国家爆炸危险场所安全规定。
应严格控制各种点火源,车间内电气设备要防爆,通风良好。
易燃易爆设备和部位应安装可燃气体监测报警仪,本岗位采用自动控制、自动报警、自动泄压等方法以提高安全度,并设置完善的消防设施。
(2)最常用的氯化剂是氯气。
在化工生产中,氯气通常液化储存和运输,常用的容器有储罐、气瓶和槽车等。
储罐中的液氯进入氯化器之前必须先进入蒸发器使其汽化。
在一般情况下不能把储存氯气的气瓶或槽车当储罐使用,否则有可能使被氯化的有机物质倒流进气瓶或槽车,引起爆炸。
一般情况下,氯化器应装设氯气缓冲罐,以防止氯气断流或压力减小时形成倒流。

2022-2023学年安徽省安庆市九校联盟九年级下学期第一次月考化学试题1.美丽昆明要靠我们共同创造和维护。
下列做法不合理的是A.垃圾分类处理B.乘坐公共交通工具出行C.大量使用一次性餐具D.积极植树造林2.下列食物中富含蛋白质的是A.冰糖B.食用油C.青菜D.鸡蛋3.火把节是彝族、白族等民族的传统节日,下列准备篝火的过程中涉及化学变化的是A.砍伐枯木B.枯树劈柴C.架空木柴D.点燃木柴4.化学实验操作要注重规范性和安全性,这是实验成功的关键。
下列操作正确的是A.闻药品气味B.取用少量液体C.点燃酒精灯D.倾倒液体5.如图是元素周期表中硫元素信息示意图和硫原子结构示意图,对图中信息理解错误的是A.硫元素是非金属元素B.硫元素的元素符号为 SC.硫原子的核外共有三个电子层D.硫原子的最外层已达到了稳定结构6.磷酸氯(C18H32ClN3O8P2),用于治疗对氨敏感的恶性疟,间日疟等疟疾,也可用于治疗肠外阿米巴病,还有抗风湿作用等。
下列有关磷酸氯的说法正确的是A.磷酸氨属于无机物B.磷酸氯峰中氢元素的质量分数最大C.磷酸氯喹中碳、氢元素的质量比为27:4D.磷酸氯是由碳、氢、氯、氮、氧、磷六种原子构成的7.“中国高铁,世界第一”。
高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理之一是:。
下列说法正确的是A.含镍不锈钢的硬度小于纯铁B.含镍不锈钢的抗腐蚀性能比纯铁差C.含镍不锈钢属于一种铁合金D.含镍不锈钢的熔点高于纯铁8.下列化学符号中的数字“”表示的意义不正确的是A.:“ ”表示两个钠元素B.:“ ”表示一个二氧化氮分子含有两个氧原子C.:“ ”表示两个氢氧根离子D.:“ ”表示镁元素的化合价为价9.类比、迁移和推理是化学学习常用的思维方法。
下列有关说法正确的是A.溶液是由两种或两种以上的物质组成的,则溶液一定是混合物B.原子不显电性,则不显电性的微粒一定是原子C.CO和CO 2的组成元素相同,则它们的化学性质相同D.中和反应生成盐和水,则生成盐和水的反应一定是中和反应10.2023年3月《中国科学院刊》报道了我国生物乙醇重整制氢技术的重大进展。

TDI 流程简介1默认分类 2006-04-03 20:16:44 阅读52 评论0字号:大中小订阅生产流程简述A. 4.1.4.1 主要反应方程式B. 4.1.4.1.1 氢化反应(1)主反应CH3(C6H3)(NO2)2 + 6H2 CH3(C6H3)(NH2)2 + 4H2O二硝基甲苯(DNT) 甲苯二胺(TDA)氢化反应不能改变异构体比例,TDA异构体比例大致为:间位邻位对位2,4 2,6 2,3 3,4 2,5 (位)76 19.7 1.2 2.5 0.6 (%)(2)副反应脱氨基CH3(C6H3)(NH2)2 + H2−−−−→ CH3(C6H4)NH2 + NH3TDA 甲苯胺氨环还原CH3(C6H3)(NH2)2 + 3H2−−−−→ CH3(C6H9)NH2TDA 甲基环已二胺不完全还原CH3(C6H3)(NO2)2 + 3H2−−−−→ CH3(C6H3) NH2NO2 + 2H2ODNT 硝基甲苯胺2CH3(C6H3)(NO2)2+9H2 −−→CH3(C6H3)NH2N=NONH2(C6H3)CH3 + 7H2O DNT 氧化偶氮化合物2CH3(C6H3)(NO2)2 + 4H2 −→ CH3(C6H3)(NO2)N=N(NO2)(C6H3)CH3 +7H2O DNT 偶氮化合物杂质氢化副反应DNT中夹带的杂质,如一硝基甲苯(MNT)、三硝基甲苯(TNT)、硝基甲酚等,加氢还原成相应的胺。
C. 4.1.4.1.2 光气合成(1)主反应CO + Cl2 COCl2一氧化碳氯光气(2)杂质反应CO + Cl2 + H2O −−−−→2HCl + CO2水氯化氢二氧化碳H2O + C −−−−→ CO + H2碳氢H2 + Cl2−−−−→ 2 HClCH4 + 4 Cl2−−−−→CCl4 + 4HCl甲烷四氯化碳水和碳反应生成CO和H2将引起催化剂损失。
D. 4.1.4.1.3 光气化(1)主反应生成TDI的主反应有两个:①MTD与光气生成TDI氨基甲酰氯,TDI氨基甲酰氯分解生成TDI。

甲苯发生氯代反应的反应式甲苯的氯代反应式甲苯(C6H5CH3)是一种芳香烃,它是由苯环和一个甲基基团组成。
氯代反应是有机化学中常见的反应之一,可以将氯原子引入有机分子中,从而改变其性质和用途。
下面我们将探讨甲苯发生氯代反应的反应式及其相关内容。
甲苯发生氯代反应的反应式如下:C6H5CH3 + Cl2 → C6H5CH2Cl + HCl在这个反应中,甲苯与氯气反应生成甲基氯(C6H5CH2Cl)和盐酸(HCl)。
氯气中的两个氯原子分别取代了甲苯分子中的一个氢原子,形成了甲基氯。
这个反应是一个氧化反应,同时也是芳香族取代反应的一种。
甲苯发生氯代反应的机理可以通过自由基取代反应来解释。
首先,氯气会发生光解,产生氯自由基(Cl•)。
然后,氯自由基会与甲苯分子中的一个氢原子反应,形成甲基自由基(C6H5CH2•)。
最后,甲基自由基会与氯自由基结合,生成甲基氯和氯化氢。
甲苯的氯代反应可以在不同的条件下进行。
常见的条件包括使用氯气作为氯化剂,并加热反应混合物。
此外,还可以使用其他氯化剂,如氯化亚铁(FeCl2)或氯化铝(AlCl3)。
这些氯化剂可以促进氯代反应的进行,并提高反应的效率和选择性。
甲苯的氯代反应可以得到甲基氯作为产物。
甲基氯是一种重要的有机化合物,广泛应用于化学工业中。
它可以用作溶剂、反应试剂和有机合成中的重要中间体。
甲基氯还可以通过进一步的反应转化为其他有机化合物,如甲基醚、甲基酮和甲基胺等。
总结一下,甲苯的氯代反应是一种重要的有机化学反应,可以将氯原子引入甲苯分子中,形成甲基氯。
这个反应可以通过氯气或其他氯化剂进行,并在适当的条件下进行。
甲基氯作为反应产物具有广泛的应用价值,可以用于溶剂、反应试剂和有机合成中的中间体。
通过研究甲苯的氯代反应,我们可以进一步了解有机化学的原理和应用,促进有机合成的发展和创新。

苯酚苯酚(Phenol,C6H5OH)[1] 是一种具有特殊气味的无色针状晶体,[2] 有毒,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
也可用于消毒外科器械和排泄物的处理[3] 皮肤杀菌、止痒及中耳炎。
熔点43℃,常温下微溶于水,易溶于有机溶剂;当温度高于65℃时,能跟水以任意比例互溶。
苯酚有腐蚀性,接触后会使局部蛋白质变性,其溶液沾到皮肤上可用酒精洗涤。
[4] 小部分苯酚暴露在空气中被氧气氧化为醌而呈粉红色。
遇三价铁离子变紫,通常用此方法来检验苯酚。
中文名苯酚英文名Phenol别称石炭酸、酚、羟基苯化学式C6H5OH分子量94.11熔点40-42℃沸点181.9℃水溶性微溶于冷水,在65℃与水混溶。
可混溶于乙醇、醚、氯仿、甘油密度1.071g/mL(25℃)外观无色或白色晶体,有特殊气味。
在空气中及光线下变为粉红色闪点:185℉/85℃应用:化工合成、油田工业、电镀、溶剂,医学安全性描述:S26,S28,S45,S24/S25,S36/S37/S39危险性符号:F(易燃),T(有毒),C(腐蚀性)危险性描述:R34,R68,R23/24/25,R48/20/21/22危险品运输编号:UN 2821 6.1/PG 2化学性质弱酸性,高毒类,突变原,还原性稳定性稳定禁配物强氧化剂、强酸、强碱储存方法阴凉通风,低温避光,注意泄漏物PSA20.23000 LogP1.39220 折射率n20/D 1.5418分子结构苯酚分子由一个羟基直接连在苯环上构成。
由于苯环的稳定性,这样的结构几乎不会转化为酮式结构[5]。
苯酚共振结构如右上图。
酚羟基的氧原子采用sp2杂化,提供一对孤电子与苯环的6个碳原子共同形成离域键。
大π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
苯酚盐负离子则有如右下图共振结构:摩尔折射率:28.13摩尔体积(m3/mol):87.8等张比容(90.2K):222.2表面张力(dyne/cm):40.9极化率:11.15[5]苯酚物理性质相对蒸气密度(空气=1):3.24折射率1.5418饱和蒸气压(kPa):0.13(40.1℃)燃烧热(kJ/mol):3050.6临界温度(℃):419.2临界压力(MPa):6.13辛醇/水分配系数的对数值:1.46 爆炸上限%(V/V):8.6引燃温度(℃):715爆炸下限%(V/V):1.7溶解性:可混溶于醚、氯仿、甘油、二硫化碳、凡士林、挥发油、强碱水溶液。
Studies in Synthetic Chemistry 合成化学研究, 2019, 7(3), 23-29Published Online September 2019 in Hans. /journal/sschttps:///10.12677/ssc.2019.73005Research on the Oxidative Chlorination ofToluene to Benzyl Chloride by Chloride IonYan Bai1,2, Xitao Cheng1,2, Along Zheng1,2, Hanxi Shen1,21Shaanxi Key Laboratory of Petroleum Fine Chemicals, Xi’an Shaanxi2Shaanxi Research Design Institute of Petroleum and Chemical Industry, Xi’an ShaanxiReceived: Aug. 14th, 2019; accepted: Aug. 30th, 2019; published: Sep. 6th, 2019AbstractUnder the excitation of LED blue light, benzyl chloride was prepared through the oxidative chlorina-tion while chlorine ion was served as chlorine source, toluene as substrate and hydrogen peroxide as oxidant. Factors influencing the reaction were studied, including the light source and power, the ratio of reactant, reaction temperature and reaction time. Under the optimum conditions, the yield of benzyl chloride was 40%. The structure of the product was characterized by IR and 1HNMR. The purity of the product was determined by GC.KeywordsChloride ion, Oxidative Chlorination, Benzyl Chloride光催化氯离子氧化氯化甲苯制氯化苄的反应研究白燕1,2,成西涛1,2,郑阿龙1,2,沈寒晰1,21陕西省石油精细化学品重点实验室,陕西西安2陕西省石油化工研究设计院,陕西西安收稿日期:2019年8月14日;录用日期:2019年8月30日;发布日期:2019年9月6日摘要在LED蓝光激发下,以氯离子为氯源,甲苯为底物,双氧水为氧化剂,采用氧化氯化法制备氯化苄。
甲苯和氯气反应方程式
甲苯和氯气反应是一种重要的有机合成反应,该反应可以制备许多重要的化合物,如对氯甲苯。
对氯甲苯是一种广泛应用于化工领域的化合物,具有重要的工业用途。
甲苯是一种常用的有机溶剂,也是许多化工产品的重要原料。
而氯气则是一种常用的氯化剂,在有机合成中具有重要的作用。
当甲苯和氯气发生反应时,会得到对氯甲苯,反应方程式如下:
C6H5CH3 + Cl2 → C6H4ClCH3 + HCl
在这个反应中,甲苯与氯气发生加成反应,氯气中的氯原子会取代甲苯中的氢原子,生成对氯甲苯。
这个反应是一个典型的取代反应,产物对氯甲苯是一种重要的有机化合物,可以用于制备其他有机化合物。
对氯甲苯具有许多重要的应用,例如在染料、医药、橡胶和农药等领域都有广泛的用途。
它可以作为有机合成中间体,用于制备各种有机化合物。
另外,对氯甲苯还可以用作溶剂、萃取剂等。
甲苯和氯气反应是一种重要的化学反应,通过这种反应可以制备许多重要的化合物,对于化工领域具有重要的意义。
这种反应不仅可以带来经济效益,还可以为人类社会的发展做出贡献。
总的来说,甲苯和氯气反应是一种重要的有机合成反应,可以制备
许多重要的化合物,对化工领域具有重要的意义。
对此反应的研究和应用将有助于推动化工行业的发展,促进人类社会的进步。
甲苯发生氯代反应的反应式引言甲苯是一种常见的有机化合物,具有许多重要的应用。
在化学反应中,甲苯可以发生氯代反应,即将氯原子引入甲苯分子中的反应。
本文将探讨甲苯发生氯代反应的反应式以及相关的反应机理和应用。
甲苯发生氯代反应的反应式甲苯发生氯代反应的反应式如下:C6H5CH3 + Cl2 -> C6H5CH2Cl + HCl反应机理甲苯发生氯代反应的机理主要分为自由基取代机理和亲电取代机理两种。
自由基取代机理在自由基取代机理中,甲苯首先与氯气发生光解反应,生成氯自由基和甲苯自由基。
随后,氯自由基与甲苯自由基发生反应,生成氯代甲苯和氯化氢。
亲电取代机理在亲电取代机理中,甲苯首先与氯化亚铁等亲电试剂发生反应,生成甲苯的正离子。
随后,甲苯的正离子与氯离子发生亲电取代反应,生成氯代甲苯。
应用甲苯发生氯代反应的反应式在有机合成中有广泛的应用。
制备氯代甲苯甲苯发生氯代反应的主要应用之一是制备氯代甲苯。
氯代甲苯是一种重要的有机合成中间体,可以用于制备其他有机化合物,如草甘膦等。
制备草甘膦草甘膦是一种广泛使用的除草剂,其合成中间体之一就是氯代甲苯。
通过甲苯发生氯代反应,可以制备氯代甲苯,再经过一系列的反应转化为草甘膦。
其他应用甲苯发生氯代反应的反应式还可以应用于制备其他有机化合物,如染料、药物等。
通过调整反应条件和反应物的选择,可以合成出具有不同功能和性质的有机化合物。
结论甲苯发生氯代反应的反应式为C6H5CH3 + Cl2 -> C6H5CH2Cl + HCl。
反应机理主要有自由基取代机理和亲电取代机理两种。
该反应式在有机合成中有广泛的应用,可以用于制备氯代甲苯、草甘膦等有机化合物。
此外,还可以通过调整反应条件和反应物的选择,合成其他具有不同功能和性质的有机化合物。
参考文献•Smith, J. (2005). Organic chemistry. McGraw-Hill Education.•Morrison, R. T., & Boyd, R. N. (2007). Organic chemistry. Pearson Education.。
氯化反应原理
氯化反应是一类常见的化学反应,其中氯化剂与反应物之间发生置换反应,生成相应的氯化产物。
这类反应通常是通过氯化剂提供氯离子给予反应物,并且在反应中至少一个原子或离子中的氯发生取代反应。
氯化反应可以分为无机氯化反应和有机氯化反应两大类。
无机氯化反应通常涉及到氯和金属之间的反应,例如铁的氯化反应可以通过铁放入含有氯的气体或溶液中进行。
有机氯化反应则涉及到含有碳氢键和氯原子的有机化合物反应,例如环己烷与氯气的反应可以得到环己烯氯化物。
氯化反应的原理是基于氯离子的高亲电性。
氯离子能够与其他离子或分子中的原子发生化学键形成新的化合物。
在反应中,氯离子取代了原来化合物中的其他原子,从而形成氯化产物。
氯化反应可以是单替换反应,也可以是双替换反应,具体取决于反应物和反应条件。
需要注意的是,氯化反应在某些情况下可能会伴随着副反应或竞争反应的发生。
某些反应物或条件下,氯化反应可能会出现氧化或还原的过程,导致反应产物的变化。
因此,在设计和实施氯化反应时,需要考虑反应条件和反应物的选择,以获得期望的产物。
一、氯化1、定义氯化是指以氯原子取代有机化合物中氢原子的反应,根据氯化反应条件的不同,有热氯化、光氯化、催化氯化等,在不同条件下,可得不同产品。
广泛应用的氯化剂有:液态氯、气态氯、气态氯化氢、各种浓度的盐酸、磷酰氯、硫酰氯、三氯化磷等。
2、应用氯化反应广泛应用于制造溶剂、各种杀虫剂、医药、农药、精细化工原料及中间体。
3、氯化反应的危险性分析(1)氯化反应的各种原料、中间产物及部分产品都是有不同程度的火灾危险性。
如烷烃、芳烃等。
(2)氯化剂具有极大的危险性,氯气为强氧化剂,能与可燃气体形成爆炸性气体混合物,能与可燃烃类、醇类、羧酸和氯化烃等形成二元混合物,极易发生爆炸。
氯气与烯烃形成的混合物,在受热时可自燃;与乙炔的反应更为激烈,有氧气存在时,甚至在-78℃的低温也可发生爆炸。
(3)氯化反应是放热反应,有些温度高达500℃,甚至更高,如反应失控,可造成超压爆炸。
某些氯化反应可自行加速,导致爆炸危险。
(4)液氯气化时高热使液氯剧烈气化,可造成内压过高而爆炸。
工艺操作不当使反应物倒灌至液氯钢瓶,则可能与氯发生激烈反应引起爆炸。
(5)氯化氢吸收装置如发生故障,不能完全被吸收,大量氯化氢逸出会造成中毒事故及腐蚀事故的发生。
(6)氯气缓冲罐若不定期排放三氯化氮,可能因三氯化氮积聚造成爆炸事故的发生。
4、氯化反应的安全技术要点(1)车间厂房设计应符合国家爆炸危险场所安全规定。
应严格控制各种点火源,车间内电气设备要防爆,通风良好。
易燃易爆设备和部位应安装可燃气体监测报警仪,本岗位采用自动控制、自动报警、自动泄压等方法以提高安全度,并设置完善的消防设施。
(2)最常用的氯化剂是氯气。
在化工生产中,氯气通常液化储存和运输,常用的容器有储罐、气瓶和槽车等。
储罐中的液氯进入氯化器之前必须先进入蒸发器使其汽化。
在一般情况下不能把储存氯气的气瓶或槽车当储罐使用,否则有可能使被氯化的有机物质倒流进气瓶或槽车,引起爆炸。
一般情况下,氯化器应装设氯气缓冲罐,以防止氯气断流或压力减小时形成倒流。