过程装备腐蚀与防护-第三章-final
- 格式:ppt
- 大小:1.23 MB
- 文档页数:35

第一章腐蚀电化学基础一、概念及简答1.双电层金属浸入电解质溶液内,其表面的原子与溶液中的极性水分子、电解质离子、氧等相互作用,使界面的金属和溶液侧分别形成带有异性电荷的结构——双电层。
2.电极电位电极反应使电极和溶液界面上建立的双电层电位跃。
3.极化、极化曲线及极化图电池工作过程中,由于电流流动而引起电极电位偏离初始值的现象。
用来表示极化电位与极化电流或极化电流密度之间关系的曲线。
将构成腐蚀电池的阴极和阳极极化曲线绘在同一E-I坐标上得到的图线,简称极化图。
4.超电压腐蚀电池工作时,由于极化作用使阴极电位下降,阳极电位升高。
这个值与各极的平衡电位差值的绝对值称为超电压或过电位。
以η表示。
5.钝化金属表面从活性溶解状态变成非常耐蚀的状态的突变现象称为钝化。
6.去极化反应:发生在阴极上的吸收电子的还原反应。
析氢腐蚀其发生的条件析氢腐蚀定义:指溶液中的氢离子作为去极剂,在阴极上进行阴极反应,使金属持续溶解而被腐蚀。
条件:腐蚀电池中的阳极电位必须低于阴极的析氢电极电位。
7. 耗氧腐蚀其发生的条件腐蚀电池上的阴极反应由溶液内氧分子参与完成,称为吸氧或耗氧反应。
耗氧腐蚀的条件为:腐蚀电池中的阳极初始电位EºM必须低于该溶液中氧的平衡电位Ee,O28.金属腐蚀的热力学条件金属溶解的氧化反应若进行,则金属的实际电位必更正于金属的平衡电极电位。
E>Ee,M 去极化反应若进行,则有金属电极电位必更负于去极剂的氧化还原反应电位。
E<Ee,k 上述条件需同时满足。
9.腐蚀速度的工程表示方法重量法和深度法10.耐蚀性评定及其适用范围第二章局部腐蚀一、概念及简答1、应力腐蚀:在固定拉应力和特定介质的共同作用下所引起的破裂。
应力腐蚀产生的条件(特定材料+)固定拉应力+ 特定腐蚀性介质2、腐蚀疲劳:金属材料在循环应力或脉动应力和腐蚀介质的联合作用下,所引起的腐蚀。
(注意与疲劳断裂的区别)条件:变应力+腐蚀性介质3、磨损腐蚀:腐蚀性流体与金属以较高速度做相对运动而引起金属的腐蚀损坏,简称磨蚀。

过程装备腐蚀与防护Process equipment corrosion and protection【学分】2 【学时】32 【性质】专业基础【实验】0(一)授课对象四年制本科过程装备与控制工程等专业。
(二)课程的性质和地位过程装备腐蚀与防护是一门综合性技术科学,无论是过程装备与控制工程还是油气储运工程、材料科学、能源科学、环境科学等领域,都与腐蚀与防护科学紧密相关。
过程装备腐蚀与防护是过程装备与控制工程专业的一门专业必修课。
本课程安排在工程化学、工程材料、工程热力学课程后进行,通过该课程的学习,使学生掌握腐蚀与防护的基础理论并融会贯通,对促进新技术的发展、节省钢材、延长设备使用寿命、节省大量资金、保证安全生产、减少环境污染有着重大意义。
(三)课程的教学目标本课程教学目标是讲授金属腐蚀的基本原理、防护方法、选材原则和监测技术,了解局部腐蚀的特点和相关的正确设计思路,了解非金属材料的耐蚀性及其结构设计特点,了解金属腐蚀防护使用的现代监测技术和原理,掌握各种工程材料腐蚀和防腐的异同点。
应用基本电化学腐蚀理论,分析常见的化工腐蚀现象并提出防腐途径,为培养本科毕业生提供必要的金属防腐蚀和监测的基本理论和应用知识。
(四)课程相关能力培养1.能够将该课程对应的专业知识用于解决复杂工程问题(G1);2.能够设计针对复杂工程问题的解决方案,设计满足特定需求的系统、单元(部件)或工艺流程,并能够在设计环节中体现创新意识,考虑社会、健康、安全、法律、文化以及环境等因素(G3);3.能够基于科学原理并采用科学方法对复杂工程问题进行研究,包括设计实验、分析与解释数据、并通过信息综合得到合理有效的结论(G4)。
(五)教学内容1.绪论(G1,G3)2.金属电化学腐蚀原理(G1)电化学腐蚀原理,腐蚀速度,析氢和耗氧腐蚀,金属的钝化。
重点:电化学腐蚀原理,金属的钝化。
难点:腐蚀速度。
3.影响腐蚀的结构因素(G1,G2,G4)力学因素(SCC、腐蚀疲劳、磨损腐蚀),表面和几何因素(孔蚀、缝隙腐蚀),异种金属组合因素(电偶腐蚀)。

《过程装备腐蚀与防护》课程教学大纲课程性质:选修课总学时:32课程类型:专业课学分:2课程编号:适用专业:过程装备与控制工程开课教研室:过程装备与控制工程教研室教学大纲说明一、本课程的地位、作用和任务二、本课程的教学基本要求通过本门课程的学习,要求学生能合理地运用所学到的有关腐蚀与护护的知识,解决实际中的问题。
对金属腐蚀理论、基本概念及重要的作用机理要有较清楚的理解,对一般的腐蚀现象能进行初步的分析。
初步掌握化工机械制造中的主要金属材料和非金属材料的耐腐蚀性能、主要的物理、机械性能及应用范围。
在防止腐蚀方面,要求学生了解基本原理、主要应用场合及条件。
三、新大纲改革说明1.学时数为32学时。
2.为了突出本专业的特点,增加了一些典型化工生产装置的腐蚀与防护分析的章节。
教学内容一、本课程的理论教学内容1 绪论1.1了解过程装备防腐蚀的意义及学习本课程的目的1.2熟悉腐蚀的定义和分类2 金属电化学腐蚀基本原理2.1金属电化学腐蚀的原理2.2双电层的形成过程2.3金属电极电位的概念2.4宏观腐蚀电池和微电池的作用原理2.5极化的概念及应用2.6腐蚀速度的评定方法和计算2.7析氢腐蚀和耗氧腐蚀2.8金属的钝化现象及应用3 影响腐蚀的结构因素3.1外力作用下形成的应力腐蚀、腐蚀疲劳和磨损腐蚀 3.2表面状况因素形成的小孔腐蚀、缝隙腐蚀3.3异种金属组合形成的电偶腐蚀3.4焊缝晶间腐蚀4 常用金属材料的耐蚀性4.1金属在某些环境中的腐蚀特点4.2金属耐蚀合金化原理及合金元素对耐蚀性的影响4.3不锈钢、碳钢、铸铁和有色金属的耐蚀原理和耐蚀性5 常用非金属材料的耐蚀性5.1高分子材料的耐蚀性5.2无机非金属材料的耐蚀性5.3不透性石墨的耐蚀性6 防腐蚀方法6.1电化学保护6.2衬里防护6.3防腐结构的设计6.4 一些其他的防腐方法7 典型石化装置的腐蚀与防护分析和应用8 设备的腐蚀监控二、本课程的实践教学内容本课程没有安排实践教学内容。

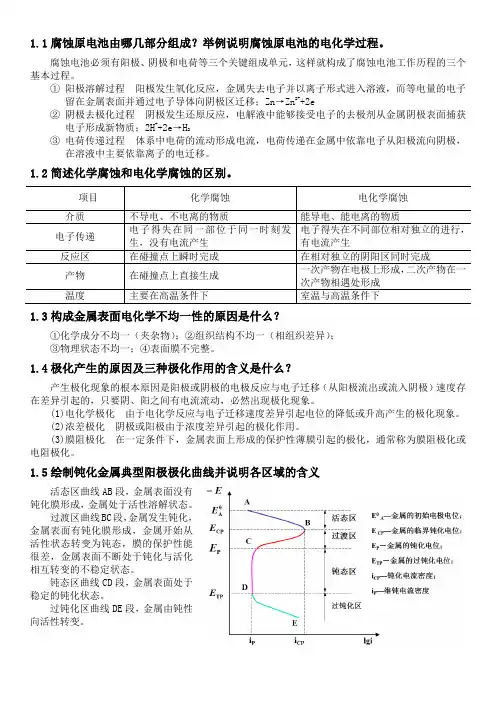

为什么说“材料的腐蚀是自发产生的”?自然界中物质最稳定的存在状态是以金属化合物的形态存在。
如:Fe2O3、FeS、Al2O3等等。
由于它们的强度、硬度、刚度等性能不能满足工业结构材料的要求,用冶金方法外加能量将它们还原成金属元素及其合金,它们比其化合物具有更高的自由能,根据热力学第二定律,金属元素必然自发地转回到热力学上更稳定的化合物状态。
这就是金属的腐蚀过程。
有机非金属材料是由有机小分子材料经聚合成为大分子材料而具有一定的强度、刚度和硬度,具备满足工业结构材料性能的。
在聚合过程中加入的能量,使其比小分子具有更高的自由能。
在介质中材料发生一些化学或物理作用,使其从高能的聚合态向低能而稳定的小分子状态转变,使材料的原子或分子间的结合键破坏。
也是服从热力学第二定律的。
无机非金属材料有天然的和人工的。
两者均是由在自然界较稳定的化合物状态的分子或元素,在天然或人工外部作用下,结合成具有一定形状、强度、刚度和硬度的材料。
这些材料在形成过程中受到的外部作用,使其内能增加,具有比它们的化合物状态的分子或元素高的能态,同样由热力学第二定律,它们在腐蚀性介质环境下,发生化学或物理作用,使材料的原子或分子间的结合键断裂破坏。
也服从热力学第二定律。
材料腐蚀危害性 a.涉及范围广泛:因腐蚀是自发产生的,腐蚀现象就涉及到所有使用材料的一切领域;b.造成的经济损失巨大;间接损失:由于腐蚀引起停产、更新设备、产品和原料流失、能源浪费。
一般间接损失比直接损失大很多。
污染环境、造成中毒、火灾、爆炸等重大事故。
c.阻碍新技术、新工艺的发展。
直接损失:由于腐蚀造成的材料自身的损失,使材料变成废物。
间接损失:由于腐蚀引起停产、更新设备、产品和原料流失、能源浪费。
一般间接损失比直接损失大很多。
污染环境、造成中毒、火灾、爆炸等重大事故。
控制腐蚀重要意义研究材料的腐蚀规律,弄清腐蚀发生的原因及采取有效的防腐蚀措施,可以延长设备寿命、降低成本、提高劳动生产率。



过程装备腐蚀与防护课程设计
一、课程概述
本课程旨在介绍过程装备的腐蚀问题及其防护措施,内容主要包括以下几个方面:
•过程装备的腐蚀分类和机理
•各种材料的耐腐蚀性能及应用
•腐蚀监测和评估方法
•腐蚀防护技术和措施
•腐蚀事故案例分析和预防措施
本课程适合化工、冶金、能源等相关专业本科及研究生学生、工程师等参与学习。
二、课程大纲
章节主要内容学时
第一章过程装备腐蚀的分类及机理 2
第二章材料的耐腐蚀性及应用 4
第三章腐蚀监测与评估 2
第四章腐蚀防护技术和措施 4
第五章腐蚀事故案例分析及预防措施 2
第一章:过程装备腐蚀的分类及机理
学习目标: - 了解过程装备腐蚀的分类和机理 - 理解腐蚀对装备的危害
1。


第一章金属电化学腐蚀基本原理1.腐蚀控制通常有两种措施,一是补救性控制,即腐蚀发生后再消除它;二是预防性控制,即事先采取防止腐蚀的措施,避免或延缓腐蚀,尽量减少可能引起的其他有害影响。
2.腐蚀的定义与分类腐蚀是金属与其周围介质发生化学或电化学作用而产生的破坏”。
腐蚀有不同的分类方法。
按照腐蚀机理可以将金属腐蚀分为化学腐蚀与电化学腐蚀两大类。
按照金属破坏的特征,可分为全面腐蚀和局部腐蚀两类。
(1)全面腐蚀是指腐蚀作用发生在整个金属表面,它可能是均匀的,也可能是不均匀。
(2)局部腐蚀是指腐蚀集中在金属的局部区域,而其他部分几乎没有腐蚀或腐蚀很轻微。
局部腐蚀有以下几种:①应力腐蚀破裂SSC在拉应力和腐蚀介质联合作用下,以显著的速率发生和扩展的一种开裂破坏。
②腐蚀疲劳金属在腐蚀介质和交变应力或脉动应力作用下产生的腐蚀。
③磨损腐蚀金属在高数流动的或含固体颗粒的腐蚀介质中,以及摩擦副在腐蚀性质中发生的腐蚀损坏。
④小孔腐蚀腐蚀破坏主要集中在某些活性点上,蚀孔的直径等于或小于蚀孔的深度,严重时可导致设备穿孔。
⑤晶间腐蚀腐蚀沿晶间进行,使晶粒间失去结合力,金属机械强度急剧降低。
破坏前金属外观往往无明显变化。
⑥缝隙腐蚀发生在铆接、螺纹接头、密封垫片等缝隙处的幅度hi。
⑦电偶腐蚀在电解质溶液中,异种金属接触时,电位较正的金属促使电位铰负的金属加速腐蚀的类型。
⑧其他如氢脆、选择性腐蚀、空泡腐蚀、丝状腐蚀等都属于局部腐蚀。
3.电极电位通常把由电极反应使电极和溶液界面上建立起的双电层电位跃称为电极电位(也称为电极电势,electrode potential.简称电位),是一个矢量,其数值由电极本身、电解液浓度、温度等因素决定,包括平衡电极电位和非平衡电极电位。
4.平衡电极电位当电极反应正逆过程的电荷和物质都处于平衡状态时的电极电位称为平衡电极电位或可逆电位,用E0表示。
以规定为零的标准氢电极电位为分界线,电位比氢的标准电极电位负(低)的金属称为负电性金属,电位比氢的标准电极电位正(高)的金属称为正电性金属。
主要试题题型:一、简答题(约30分)二、填空题(约20分)三、选择题(约10分)四、腐蚀事例分析(3- 4小题,共40分)第一章 腐蚀电化学基础1、金属与溶液的界面特性——双电层金属浸入电解质溶液内,其表面的原子与溶液中的极性水分子、电解质离子、氧等相互作用,使界面的金属和溶液侧分别形成带有异性电荷的双电层。
2.电极电位电极电位:电极反应使电极和溶液界面上建立的双电层电位跃。
3.金属电化学腐蚀的热力学条件(1). 金属溶解的氧化反应若进行,则金属的实际电位必更正于金属的平衡电极电位。
E>Ee,M(2)去极化反应若进行,则有金属电极电位必更负于去极剂的氧化还原反应电位。
E<Ek0上述条件需同时满足。
4、极化极化现象:电池工作过程中,由于电流流动而引起电极电位偏离初始值的现象。
极化现象的根本原因:电极反应与电子迁移的速度差。
极化曲线定义:用来表示极化电位与极化电流或极化电流密度之间关系的曲线。
作用:判断电极材料的极化特性。
腐蚀极化图定义:将构成腐蚀电池的阴极和阳极极化曲线绘在同一E -I 坐标上得到的图线,简称极化图。
对给定的腐蚀电池,工作稳定时的腐蚀电流为Icorr ,则初始电动势问题:如增加最有效的阴极的面积,或添加去极剂,搅拌等,将使Ex -S 水平线向正方向移动(为什么?)5、超电压(过电位)腐蚀电池工作时,由于极化作用使阴极电位变负,阳极电位变正。
这个值与各极的初始电位差值的绝对值称为超电压或过电位。
以η表示。
超电压量化的反映了极化的程度,对研究腐蚀速度非常重要。
6.金属的耐蚀性能评定(针对全面腐蚀 为什么?)金属耐蚀性也叫化学稳定性,即金属抵抗介质作用的能力。
对全面腐蚀,通常以腐蚀速度评定。
对受均匀腐蚀的金属,常以年腐蚀深度来评定耐腐蚀的等级7、腐蚀速度的工程表示方法重量法:以金属腐蚀前后金属质量的变化来表示,分失重法和增重法。
常为实验室采用。
失重法适用于腐蚀产物能很好地除去而不损伤主体。