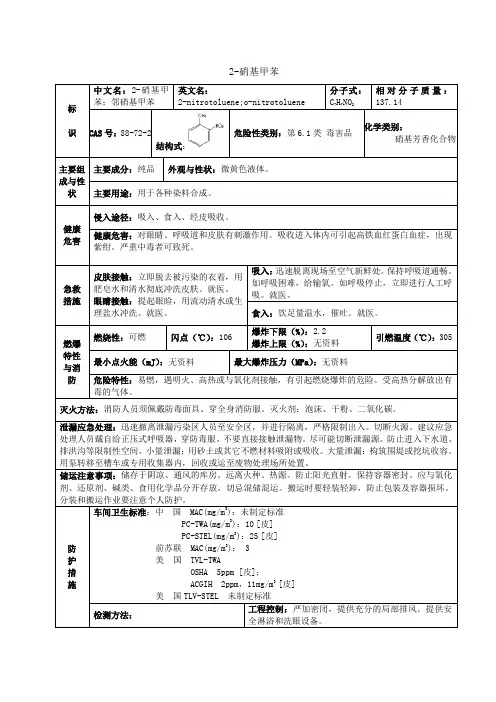
邻硝基甲苯
- 格式:doc
- 大小:71.50 KB
- 文档页数:3
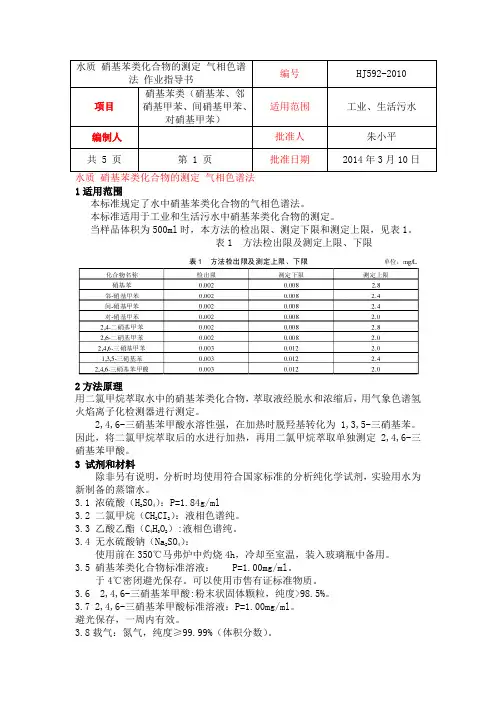
水质 硝基苯类化合物的测定 气相色谱法 1适用范围本标准规定了水中硝基苯类化合物的气相色谱法。
本标准适用于工业和生活污水中硝基苯类化合物的测定。
当样品体积为500ml 时,本方法的检出限、测定下限和测定上限,见表1。
表1 方法检出限及测定上限、下限2方法原理用二氯甲烷萃取水中的硝基苯类化合物,萃取液经脱水和浓缩后,用气象色谱氢火焰离子化检测器进行测定。
2,4,6-三硝基苯甲酸水溶性强,在加热时脱羟基转化为1,3,5-三硝基苯。
因此,将二氯甲烷萃取后的水进行加热,再用二氯甲烷萃取单独测定2,4,6-三硝基苯甲酸。
3 试剂和材料除非另有说明,分析时均使用符合国家标准的分析纯化学试剂,实验用水为新制备的蒸馏水。
3.1 浓硫酸(H 2SO 4):P=1.84g/ml 3.2 二氯甲烷(CH 2CI 2):液相色谱纯。
3.3 乙酸乙酯(C 4H 8O 2):液相色谱纯。
3.4 无水硫酸钠(Na 2SO 4):使用前在350℃马弗炉中灼烧4h ,冷却至室温,装入玻璃瓶中备用。
3.5 硝基苯类化合物标准溶液: P=1.00mg/ml 。
于4℃密闭避光保存。
可以使用市售有证标准物质。
3.6 2,4,6-三硝基苯甲酸:粉末状固体颗粒,纯度>98.5%。
3.7 2,4,6-三硝基苯甲酸标准溶液:P=1.00mg/ml 。
避光保存,一周内有效。
3.8载气:氮气,纯度≥99.99%(体积分数)。
法 作业指导书项目 硝基苯类(硝基苯、邻硝基甲苯、间硝基甲苯、对硝基甲苯)适用范围 工业、生活污水编制人 批准人 朱小平 共 5 页第 1 页批准日期2014年3月10日3.9 燃烧气:氢气,纯度≥99.99%(体积分数)。
3.10 助燃气:空气。
4 仪器和设备4.1 气象色谱仪:聚氢火焰离子化检测器。
4.2 色谱柱:石英毛细管色谱柱,30m ×0.32mm (内径)×0.25um (膜厚),固定相为5%苯基-95%甲基聚硅氧烷。

College of Chemistry and Molecular Science,Wuhan UniversityReport of Organic Chemistry ExperimentDesigned Experiment:Synthesis of 2-Aminobenzoic Acidfrom 2-NitrotolueneTutor: Ying XiongStudent’s Name: Wenxin LuMajor: Chemistry Class of Hongyi SchoolStudent ID: 2012301040179Date: Apr. 24th to May 29th, 2014(5 weeks in total, once a week)Ⅰ. Purpose of the Experiment1. Initiate the progress of the syntheses with the raw material, 2-nitrotoluene, to prepare the important organic synthetic raw material, 2-aminobenzoic acid, by the oxidation of potassium permanganate and the reduction of Fe/HCl.2. Learn to use IR and 1HNMR to analysis and represent the intermediate and product, determine the purity and the structure of them.3. Review some operations in fundamental organic chemistry experiment, such as reflux, simple distillation and recrystallization.4. Know the common oxidation and reduction methods in organic synthesis, to strengthen the basis of theoretical study.5. By comparing different synthesis methods, determine a simple one which has a characteristic of high yield and less pollution, to understand the idea of “Green Chemistry”.Ⅱ. Principle of the Experiment2-Aminobenzoic acid is an indispensable organic synthetic raw material and intermediate. In the aspect of dye, it is used to prepare anthraquinone dyes, azo dyes and indigoiddyes, in the aspect of medicine, it is used to make pontal, pyrozoline, benzydamine, tardan, etc. 2-Aminobenzoic acid is also used in organic synthesis, for example, to prepare compound like 3-hydroxyindole and methyl anthranilate. As a chemistry reagent, it is used to test cerium, cadmium, cobalt, copper, lead, magnesium, mercury, nickel, nitrite, palladium, zinc, silver and uranium.Step 1: Oxidation of 2-Nitrotoluene2-nitrotoluene is a derivative of arene, which has an nitryl and an adjacent methyl on benzene ring. There are some α-H atoms on the C atom directly attached to benzene ring, which can be oxidized to a carboxyl group by many kinds of oxidation.There are various methods of preparing 2-nitrobenzoic acid from 2-nitrotoluene, and several of them are widely applied [1]:(1)Potassium permanganate method. The advantages of this methodare that the yield is as high as 80%, the oxidizing progress is fast, and the operation is easy, whereas, it has weaknesses of low selectivity, high cost and much waste. (2)Sodium dichromate method. 2-nitrobenzoic acid can be prepared by mixing 2-nitrotoluene, sodium dichromate and sulfuric acid in water and keep them slightly boiling for half an hour. The cost of this method is lower than (1), but its yield is inferior to that, moreover, the chromium(Ⅲ) ion produced is severely harmful to environment. So this method is gradually abandoned. (3)Nitric acid oxidizing method. The reduzate of nitric acid is gas and easy to separated, meanwhile, no heavy mental ion is generated. But the using of nitric acid will make picric acid mixed in the product which amount cannot be ignored, regardless of the concentration of nitric acid. Also, nitric acid is corrosive to the facility, so this method can hardly be popularized now. (4)Sodium hypochlorite method. Expensive ruthenium tetroxide will be used in this method, restricted by the condition of the experiment, this method can’t be used. (5)The method of air liquid phase oxidation. This is the most potential and attractive method nowadays, restricted by the condition of the experiment, this method can’t be used.Comprehensively considering the condition of this experience, the author will adopt the potassium permanganate method to prepare 2-nitrobenzoic acid from 2-nitrotoluene:Step 2: Reduction of 2-Nitrobenzoic Acid2-Nitrobenzoic acid is a kind of aromatic nitro compound, which nitryl on the benzene ring can be reduced to amino by reductant.There are also many ways to reduct aromatic nitro compound to arylamine[2]: (1)Catalytic hydrogenation by using Pd-C catalysis. NaBH4 is a substitute. The reaction is easy to proceed and to be controlled due to its gently extent, and its yield is considerable. But the Pd-C catalysis is not available on the condition of this experiment. (2)Hydrazine reduction. Mix 2-nitrobenzoic acid, methyl alcohol, solution of sodium hydroxide and Raney-Ni, heat to reflux, then drop hydrazine into the system, continue to reflux, high-yield 2-aminobenzoic acid will be gained. (3)Zn-NH4Cl method. In this method, barium 2-aminobenzoate is reacted initially with zinc and ammonium chloride, then with alcohol solution of potassium hydroxide, 2-aminobenzoic acid will be gained.(4)Electrolysis reduction. Use lead, tin or zinc amalgam to electrolyze 2-nitrobenzoic acid, then high yield of 2-aminobenzoic acid will be generated even without catalysis. (5)[3]Fe/HCl or Fe/HOAc reduction. If hydrochloric acid and iron powder are used as reductant, 2-nitrobenzoic acid can be reduced to 2-aminobenzoic acid within 3 hours. Besides, tin chloride (specificity reductant) and lithium aluminum hydride (strong reductant) can be used, but tin salts are toxic and lithium aluminum hydride is inflammable in wet air, so they are both abandoned.The synthesis methods above are mostly aimed to 4-nitro compound, while the report of synthesis of 2-aminobenzoic acid is relatively less. Considering the similarity between 2-nitrotoluene and 4-nitrotoluene, the author will use the synthesis method of 4-aminobenzoic acid for reference to synthesize 2-aminobenzoic acid. Fe/HCl reduction is adopted in this experiment to reduce 2-nitrobenzoic acid to 2-aminobenzoic acid:Recrystallization重结晶是提纯物质的一种实验方法,有两种方式:单一溶剂法和混合溶剂法。


零价铁还原土壤中邻硝基甲苯的研究摘要:在常温常压下,利用零价铁(ZVI,Fe0)还原技术修复被邻硝基甲苯(ONT)污染的土壤,研究不同反应时间零价铁对ONT 的去除率。
实验结果表明,随着反应时间的延长土壤中ONT的含量逐渐降低,到达一定的时间后就达到平衡状态。
当土壤中的ONT的初始浓度约为750μg/g,零价铁加入量是0.5g,土壤含水量为75%,土壤初始pH值6.8,于25℃反应9h,ONT的还原率可达67%。
关键词:零价铁还原邻硝基甲苯ONT在染料合成,农药生产以及塑料,油漆,涂料,医药等领域有着广泛的应用。
硝基苯类化合物结构稳定,不易被生物分解,在环境中难以降解且大多具有较强毒性,能通过皮肤和呼吸被人体吸收,造成中毒甚至引起死亡[1-2]。
目前,随着我国城市规划与布局的调整,许多化工厂、制药厂等排污企业外迁,遗留了大量硝基苯类污染场地,严重影响了土地的二次开发利用[3]。
对于受邻硝基苯污染的土壤处理方法有利用分子吸附技术或者将其作为原料制取有其它化学物质。
但是用以上方法去除土壤中的ONT效果不明显,所需成本高。
零价铁具有低毒、廉价、易操作、对环境不会产生二次污染, 而且还能够去除多种有毒有害污染物的优点,被认为是最有应用前景的污染物治理技术之一[4]。
因此,本次研究采用零价铁修复ONT的模拟污染土样,研究反应时间对零价铁还原ONT的效果,以此为依据为硝基苯类化合物的土壤污染修复应用提供参考。
1 材料与方法1.1 试剂与仪器试剂:还原性铁粉,邻硝基甲苯,甲醇,环己烷:分析纯仪器:高效液相质谱仪LC-20A,电子天平,恒温生化培养箱LRH-150T,低速台式大容量离心机RJ-TDL-40B-II;电热恒温干燥箱DHG-9077A型;台式恒温振荡器THZ-D,120R。
1.2 土壤样品土壤采用嘉兴学院的校园土样(表层土0~30cm)。
将采集的土壤倒在白色搪瓷内,摊成2cm厚的薄层于阴凉处自然风干,过60目筛后密封,于电热恒温干燥箱保存备用。

硝基甲苯、邻硝基甲苯、间硝基甲苯是三种结构相似但熔点不同的有机化合物。
它们都是苯环上带有硝基基团的衍生物,但它们的分子结构中的硝基基团所处的位置不同,这导致它们在熔点上有明显的差异。
下面将从分子结构角度、分子间作用力角度和晶体结构角度分别探讨硝基甲苯、邻硝基甲苯、间硝基甲苯熔点不同的原因。
一、分子结构角度的影响硝基甲苯、邻硝基甲苯、间硝基甲苯的分子结构中含有硝基基团,硝基基团的位置不同会影响分子整体的空间构型。
硝基甲苯的硝基基团位于苯环上,分子中只有一个硝基基团,其分子结构较为简单,分子间作用力相对较弱。
邻硝基甲苯的硝基基团位于邻位,分子结构呈现对称性,分子间作用力较硝基甲苯要强。
而间硝基甲苯的硝基基团位于间位,分子结构不对称,分子间作用力最强。
由于分子结构的不同导致了分子间作用力的差异,从而影响了其熔点的高低。
二、分子间作用力的影响硝基甲苯、邻硝基甲苯、间硝基甲苯分子间作用力主要包括范德华力、氢键等。
硝基甲苯的分子结构较为简单,分子间作用力相对较弱,因此熔点较低。
而邻硝基甲苯和间硝基甲苯由于分子结构不对称,分子间作用力较硝基甲苯要强,因此熔点较高。
三、晶体结构角度的影响硝基甲苯、邻硝基甲苯、间硝基甲苯在固态下以晶体形式存在,晶体结构的不同也导致了其熔点的不同。
硝基甲苯的晶体结构较为松散,熔点较低。
邻硝基甲苯和间硝基甲苯的晶体结构较为致密,熔点较高。
硝基甲苯、邻硝基甲苯、间硝基甲苯的熔点不同主要是由于分子结构的不同、分子间作用力的差异和晶体结构的异同所致。
这些因素共同作用,导致了它们的物理性质上的明显差异。
对于有机化学研究者来说,深入探究这些差异的原因,对于有机化合物的性质和应用具有一定的指导意义。
硝基甲苯、邻硝基甲苯和间硝基甲苯的熔点差异不仅仅是理论领域的研究课题,更是在实际生产和应用中具有重要意义的物性指标。
这三种化合物在医药、染料、爆炸物、农药等领域都有着广泛的应用,因此理解其性质之间的微妙差异对于正确应用和开发新的应用具有重要意义。

光催化反应合成邻硝基苯甲醛王丽梅;李建发【摘要】本文设计以邻硝基甲苯为原料,经过溴化反应和水解反应,两步反应得到目标产物邻硝基苯甲醛.其中溴化反应采用溴化钠为溴化剂,通氯气的条件下制备中间体邻硝基二溴苄,本文针对溴化反应的应条件进行了优化.优化后的工艺条件为n(邻硝基甲苯)∶n(NaBr)∶n(H2O)∶n(CCl4)=0.1∶0.2∶0.27∶1,40℃反应t2h,中间体邻硝基二溴苄产率高达84.8%,邻硝基苯甲醛的总收率为81.3%,该工艺成本低,产率高,易于工业化.%In this paper,o-nitrobenzaldehyde is synthesized through bromination reaction and hydrolysis reaction by using o-nitrotoluene as raw material.In bromination reaction,using sodium bromide as brominating agent,the intermediate of 1-(dibromomethyl)-2-nitrobenzene is obtained through the introduction of chlorine.The conditions of the bromination reaction are optimized.The optimum conditions:n(2-nitrotoluene) ∶ n(NaBr) ∶ n(H2O) ∶ n(CCl4) =0.1 ∶ 0.2 ∶ 0.27 ∶1,40 ℃,reacting for 12 h.The yield of 1-(dibromomethyl)-2-nitrobenzene is 84.8%,and the yield of o-nitrobenzaldehyde is 81.3%.This synthetic method has low cost,high yield and is easily industrialized.【期刊名称】《天津理工大学学报》【年(卷),期】2017(033)005【总页数】4页(P40-43)【关键词】邻硝基甲苯;溴化钠;氯气;邻硝基苯甲醛【作者】王丽梅;李建发【作者单位】天津理工大学化学化工学院,天津300384;天津理工大学化学化工学院,天津300384【正文语种】中文【中图分类】O625.4笔者参考相关文献设计了相对简单的合成工艺,以邻硝基甲苯为初始原料,以溴化钠为溴化剂,光照下通氯气,得到邻硝基二溴苄,再经水解得邻硝基苯甲醛,其中溴化反应是本合成工艺的关键步骤,主要针对此反应进行了条件优化.该方法避免了使用毒性较大、污染环境的溴素,增加了操作的安全性,同时也降低了原料的成本.操作简单,产率较高.材料:溴化钠;氯气;邻硝基甲苯;四氯化碳;偶氮二异丁腈;过氧化苯甲酰;氢氧化钠;碳酸氢钠.设备及仪器:高压钠灯;Cl2钢瓶;气相色谱仪;核磁共振仪;磁力搅拌控温加热套;旋转蒸发仪;循环水式真空泵.1.2.1 反应方程式1)主反应.2)副反应.1.2.2 溴化反应于250mL的四口瓶内依次加入150 g CCl4,65 g H2O,21.6 g NaBr,13.7 g 邻硝基甲苯,0.1 g偶氮二异丁腈,待加热至40℃打开高压钠灯(500 W)并缓慢通入Cl2,反应12 h,冷却至室温,分离有机相.用5%NaHCO3溶液100mL分两次洗涤有机相,再用蒸馏水洗涤一次,无水MgSO4干燥过夜.滤去干燥剂,减压蒸馏回收CCl4,得深色液体,用无水乙醇重结晶,得白色晶体,经气相色谱分析其为混合物.于50mL三口瓶内加入10 g上述产物进行蒸馏,169℃得一馏分,经核磁分析为邻硝基一溴苄,186℃得另一馏分,经核磁分析为邻硝基二溴苄.邻硝基二溴苄 1H NMR(400 MHz,CH3Cl),δ:7.36(s,1H),7.55~7,97(m,4H).邻硝基一溴苄 1H NMR(400 MHz,CH3Cl),δ:4.56(s,2H),7.55~7.97(m,4H).1.2.3 水解反应于100mL三口瓶内加入75mL40%NaOH溶液,上述产物 8 g,在75~80℃下反应 12 h,0℃析晶得粗品邻硝基苯甲醛,产率81.3%.该粗品再经水蒸气提纯得纯品,收率92.4%,纯度97.8%.1H NMR(400 MHz,CH3Cl),δ:7.61~8.33(m,4H),10.35(s,1H).回流温度下(73℃),改变光照条件,其余条件与1.2.2一致,反应6 h,考察光照对溴化反应的影响,其气相测试结果如表1所示.由表1可知,光照是该反应的关键制约因素.常态下氯气以稳定的分子形式存在,而光照时可迅速均裂为氯自由基,该自由基化学性质活泼,进攻NaBr分子,生成键能更高的NaCl和选择性更高的溴自由基(链引发步骤完成),该过程瞬间发生,产生大量溴自由基(部分结合成溴单质),与邻硝基甲苯碰撞形成邻硝基苄基自由基,该自由基与溴碰撞并夺取溴原子生成邻硝基一溴苄.邻硝基一溴苄也进行相同反应,生成邻硝基二溴苄,这两步反应是溴化反应的重要阶段,称为链增长阶段,但链增长不会无限进行下去,因为生成的氢自由基会消耗溴自由,使反应终止.综上所述,光照是引发溴化反应和控制反应速率的关键因素.其机理如下[13-15].回流温度下,改变引发剂种类,其余条件与1.2.2一致反应6 h,考察引发剂(原料摩尔量的10%)对溴化反应的影响,其气相测试结果如表2所示.由表2可知,加入引发剂可明显提高二溴化物的产率.由溴化反应机理可知,链引发是该反应的关键,而引发剂具有引发反应的作用,其原因是引发剂在加热条件下自发裂解为自由基,可降低Cl2裂解所需的活化能,加速反应速率[16].自发类引发剂主要分为偶氮类与过氧化物类,因实验所用溶剂为CCl4(沸点76.8℃),所以选择了中温引发剂偶氮二异丁腈与过氧化苯甲酰,由实验结果可知,两者引发效果相当,因此,选择了碰撞时不会爆炸,分解速度受溶剂影响小的偶氮二异丁腈作为引发剂.溶剂效应对自由基反应的影响认识已久,不同溶剂可能影响同一反应的速率,甚至会改变反应机理,得到相左的产物.实验中发现,本自由基反应对溶剂的变化不是很敏感,因此,为了保证反应的顺利进行,在反应体系中加入了蒸馏水,使NaBr 溶解于蒸馏水中,以离子的形式存在,有利于反应的进行,但是水分子之间会形成氢键,研究发现氢键键合会降低极性键上自由基取代的反应速率[17],所以加入的水量不宜太大.改变水量,其余条件与1.2.2一致,考察水对溴化反应的影响,其结果如表3所示.从反应结果看,水量小于65 g时都有盐析出,导致溴化剂不能完全参与反应,所以水量以65 g为佳,既能保证溴化剂参与反应,又可使自由基处于相对稳定的溶剂环境中.回流温度下,其余条件与1.2.2一致,考察反应时间对溴化反应的影响,其气相测试结果如图1所示.由图1可知,随着时间延长,邻硝基二溴苄的产率先增加后减少,而邻硝基一溴苄的产率不断增加.其原因可能是:①反应生成的HBr降低了介质的PH值,该条件下邻硝基二溴苄很不稳定,发生C—Br键断裂,生成更稳定的邻硝基一溴苄,因而邻硝基二溴苄产率降低;②C—Br键平均键能为284.6 kJ/mol,C—H键平均键能为414.4 kJ/mol,所以C—Br键断裂形成C—H键需更高的能量,因此可以推断出,反应条件未改变的情况下,邻硝基一溴苄转变为邻硝基二溴苄的反应为可逆反应.由实验可知6 h时反应达到平衡状态,而此时Cl2的裂解仍在继续,促使反应逆向进行,所以邻硝基二溴苄含量降低,而邻硝基一溴苄含量增加,直到再次达到平衡.改变反应温度,其余条件与1.2.2一致,考察温度(选择了偶氮二异丁腈最佳引发温度段)对溴化反应的影响,其气相测试结果如表4所示.由表4可知,温度为40℃时,邻硝基二溴苄的收率达最大为84.8%,然后随着温度的升高,邻硝基二溴苄的含量不断降低,而邻硝基一溴苄的含量不断增加,其原因主要是随着温度的升高,Br·热运动加剧,稳定性降低,更易结合形成Br2单质,降低了Br·与邻硝基甲苯反应的机会,从而降低了二溴化物的产率.其次,自由基选择性随温度的升高而降低,所以当温度升高时,邻硝基一溴苄被Br·夺取氢形成邻硝基溴苄自由基的概率降低,因而二溴化物的产率降低,实验中发现,40℃时产率佳,因此,选择40℃作为本实验的反应温度.本文以邻硝基甲苯为原料,经溴化和水解两步合成邻硝基苯甲醛.经实验发现,溴化反应必须由光照引发,最佳反应温度为40℃,物料摩尔比为n(邻硝基甲苯)∶n(NaBr)∶n(H2O)∶n(CCl4)=0.1 ∶0.2 ∶0.27∶1;同时需要加入引发剂偶氮二异丁腈,反应收率84.8%.得到的邻硝基二溴苄经水解后得邻硝基苯甲醛,总产率为81.3%.溴化反应以溴化钠为溴化剂,避免使用传统溴化剂溴素,克服了其污染环境、成本较高的弊病,此反应操作简单、产率高,利于工业化生产.【相关文献】[1]李彤,张军良,郭燕文,等.邻硝基苯甲醛合成方法概述[J].化学试剂,2004,26(3):153-156.[2]Caluwe P T.Convenient synthesis of 2-Amino-l-naphthyridines[J].The Journal of Organic Chemistry,1980,36:23-59.[3]杨定乔.邻硝基苯甲醛的合成[J].江苏化工,1991,22(1):16-18.[4]Conminellis C,Plattner E,Javet P.The oxidation o-nitrotoluene to o-nitrobenzaldehyde with electrogenerated eobaltic sulPhate[J].Journal of Applied Electrochemistry,1979(9): 753-755.[5]Lozar J J,Savall A J.Oxidation of o-nitrotoluene by cerium methanesulfonate [J].Industrial and Engineering Chemistry Rresearch,1995,34:3149-3153.[6]魏运洋,刘裕立.配位催化氧化合成邻硝基苯甲醛的工艺研究[J].化学反应工程与工艺,2001,17(2): 124-127.[7]田澎,魏运洋.邻硝基苯甲醛合成工艺研究[J].精细化工中间,2001,10(5): 16-17. [8]蔡敏敏,魏运洋,蔡春,等.氧气液相氧化制备邻硝基苯甲醛[J].化学反应工程与工艺,2002,18(1): 23-25.[9]蔡敏敏,魏运洋,吕春绪.氧气液相氧化邻硝基甲苯制备邻硝基苯甲醛[J].南京理工大学学报,2002,26(2):197-202.[10]张惠良,李宗昌,傅献彩.甲苯选择性氧化制苯甲醛-焙烧对铁铝系催化剂性质和催化性能的影响[J].催化学报,1988,9(4): 333-343.[11] Zhu J,Andersson S,Lars T.Reaction network and kineties for the eatalytic oxidation of towline over V2O5[J].Journal of Catalysis,1990,126(1): 92-100. [12] Zhu J,Ersson S,Lars T.Influence of potassiumon the eatalytie properties ofV2O5-Ti02for tolvene[J].Journal of Chemical Socity,1989,185(11): 3629-3631. [13] Lowry T H,Richardson H S.Mechanism and theory in organic chemistry[J].Harpev and Row Lab,1981,34: 132-139.[14] Citterio A,Fochi M,Marion A.Synthesis of naphtha-2,3-bindolizine-6,11-dionederivatives by iodione oxidation of 2-alkyl-1,4-naphthoquidones in the presence of substituted pyridine[J].Heterocycles,1998,48(10): 1993-2002.[15]蒋锡夔,张毓凰,汪大萃,等.单电子转移反应[J].化学学报,1983,41: 765-768. [16]矫阳,赵华,王锡臣.自由基聚合引发体系的最新进展[J].北京轻工业学院学报,1998,16(1): 55-61.[17]文耀智.论自由基反应及其影响因素[J].昭阳师范高等专科学校学报,2001,23(2):42-48.。

邻硝基甲苯标准邻硝基甲苯(o-nitrotoluene),分子式为C7H7NO2,是一种有机化合物,具有重要的工业用途和环境污染问题。
邻硝基甲苯主要用于制造染料、颜料、塑料添加剂、药物等,同时也可用于生产炸药和农药。
然而,邻硝基甲苯对人体和环境具有一定的毒性,其排放和污染问题引起了广泛关注。
一、邻硝基甲苯的性质邻硝基甲苯是一种无色或微黄色的油状液体,具有特殊的芳香气味。
其沸点为216°C,熔点为5°C,密度为1.14 g/cm³。
邻硝基甲苯不溶于水,易溶于有机溶剂如醇、醚等。
邻硝基甲苯具有较高的化学稳定性,但在高温、高压条件下,可发生分解、硝化等反应。
其分解产物包括甲苯、氮气、一氧化氮等。
在酸性条件下,邻硝基甲苯可发生硝化反应,生成邻硝基甲苯的二硝化物、三硝化物等。
二、邻硝基甲苯的工业应用邻硝基甲苯在工业上具有广泛的应用,主要用途包括:1. 染料和颜料生产:邻硝基甲苯是合成染料和颜料的重要原料,如偶氮染料、硫化染料等。
2. 塑料添加剂:邻硝基甲苯可用于生产塑料稳定剂,提高塑料的耐热性、耐光性等。
3. 药物生产:邻硝基甲苯可用于合成多种药物,如抗生素、解热镇痛药等。
4. 炸药和农药生产:邻硝基甲苯是生产TNT(三硝基甲苯)和其他炸药的重要原料。
此外,邻硝基甲苯还可用于生产某些农药。
三、邻硝基甲苯的环境污染问题邻硝基甲苯在生产、使用和处理过程中,可能对环境造成污染。
其主要环境污染问题包括:1. 土壤污染:邻硝基甲苯及其代谢产物可渗透土壤,导致土壤污染。
这会影响土壤的肥力和微生物活性,进而影响植物生长和生态系统的稳定。
2. 水体污染:邻硝基甲苯可通过废水排放、事故泄漏等方式进入水体,导致水体污染。
这会对水生生物造成毒性影响,破坏水生态系统。
3. 大气污染:邻硝基甲苯在生产、使用过程中,可能发生泄漏、排放,进入大气。
其挥发性较强,对人体呼吸系统造成危害。
四、邻硝基甲苯的毒性邻硝基甲苯具有一定的毒性,对人类和环境生物产生影响。



一硝基甲苯生产与应用一、一硝基甲苯生产概况一硝基甲苯(邻硝基甲苯、对硝基甲苯、间硝基甲苯)是由甲苯经硝、硫混酸硝化,再分离、中和、水洗、碱洗、水洗后,再经干燥、脱重、分馏得邻、间、对硝基甲苯(邻:问:对=60:4:36)三种同分异构体,均为重要的化工原料。
国内一硝基甲苯的主要生产企业有:江苏淮河化工有限公司(国营9395厂)、国营375厂、四川红光化工厂(国营565厂)、湖北东方化工厂(国营525 厂)、吉化公司染料厂、湘潭有机化工厂、广东茂名有机化工厂等,总生产能力超过20万吨。
一硝基甲苯作为医药、农药、容纳了、香料等的中间体应用非常广泛。
在国际市场上,我国一硝基甲苯及衍生物的价格比欧洲同类产品平均低30%,具有机枪的竞争力。
目前,我国一硝基甲苯及其衍生物产品产量,足以左右欧洲市场的行情,导致欧洲一些历史悠久的中间体生产企业日趋萎缩。
据统计,近十年中,西欧被迫关闭2家硝基甲苯生产厂,最近日本的一家硝基甲苯企业也不再生产该产品;5年前,2.6 二氯甲苯还有1~2家企业在生产,现在已不再生产,间氯甲苯从5年前4家厂生产减少到只有2家;二氯苯、N-乙基苯胺也减少了多家生产厂。
美国一些大公司如联合公司、氰胺公司先后退出中间体生产舞台,美国市场上的铜酞菁、2B酸等70%来自中国及东南亚国家,本国几乎不生产。
由一硝基甲苯出发,可以得到很多的化工产品。
以染料、医药、农药等为主的精细化工产品不断被开发,使得一硝基甲苯的用途得到进一步的开发和发展。
随着西欧中间体生产企业相继停产,中间体的生产重心逐渐移至亚洲(主要是中国和印度,这为我国一硝基甲苯及其衍生物的开发、生产、售提供了空良好的发展机遇。
二、一硝基甲苯应用情况1.邻硝基甲苯邻硝基甲苯可以通过还原、氯化、缩合等反应得到一系列衍生产品,作为染料、医药、农药合成中间体,应用广泛。
1.1邻甲苯胺邻硝基甲苯经还原可得到重要的染料、医药、农药中间体邻甲苯胺。
早期的邻甲苯胺是以邻硝基甲苯为原料,在氯化铵介质或稀酸中用铁粉还原, 由于该工艺劳动强度大,污染严重,目前国内大多数已采用在铜触媒存在下加氢还原的工艺。
邻硝基甲苯规格
《邻硝基甲苯规格》
一、邻硝基甲苯概述
邻硝基甲苯( ortho-Nitrotoluene,简称o-NT)是一种化学稳定性较强的工业原料,采用六环吡啶的按平衡吡啶芳烃新技术得到的,具有芳香气味,无毒无害,是一种重要的有机合成中间体,主要用于制造磺胺类、烟碱类、多种酸性酯类、酰胺类和聚酰胺类等产品。
二、邻硝基甲苯特性
1、无色或淡黄色液体,具有芳香气味;
2、沸点:117.4℃;
3、密度:0.944~0.948g/cm3;
4、熔点:-20℃;
5、物理状态:液体;
6、稳定性:化学稳定性较强,易挥发,不溶于水;
7、商品性质:无毒、无害;
8、具有高度有机合成需求,是一种重要的有机合成中间体;
9、可用于制造磺胺类、烟碱类、多种酸性酯类、酰胺类和聚酰胺类等产品;
10、由于其有害物质含量低,可以用于食品工业、医药行业中;
11、具有优良的抗氧化性和光稳定性,可用于染料生产。
三、邻硝基甲苯规格
邻硝基甲苯规格通常是按其中无机离子含量,杂质含量,水分含
量,芳香烃总量,无毒挥发物含量等来确定的,具体如下:
1、无机离子含量≤1.0%;
2、杂质含量≤1.0%;
3、水分含量≤0.1%;
4、芳香烃总量≤0.1%;
5、无毒挥发物含量≤0.05%。
邻硝基苯甲酸范文邻硝基苯甲酸具有多种化学性质与应用。
首先,它是一种强酸。
其羧基使它可以失去一个氢离子,生成邻硝基苯甲酸根离子(ONBA-)。
这使邻硝基苯甲酸具有一定的腐蚀性,可以与金属发生反应。
其次,邻硝基苯甲酸的邻位和羧基上的硝基也使它具有氧化性。
它与邻苯二胺反应可以生成可溶于水的深色化合物。
此外,邻硝基苯甲酸还可作为染料中间体和有机合成的起始物质。
邻硝基苯甲酸的制备方法有多种。
一种常用的方法是通过硝化反应合成。
以亚硝酸钠为硝化剂,将亚硝酸钠溶解于含有邻硝基甲苯的硫酸中,通入冷却搅拌的反应器中,在低温下反应,即可得到邻硝基苯甲酸。
制备过程中需要注意控制反应温度,以避免副反应和产物的分解。
邻硝基苯甲酸在染料工业中有广泛应用。
它是染料中间体的重要原料之一、通过对邻硝基苯甲酸的进一步官能团修饰,可以合成出多种不同颜色的染料。
邻硝基苯甲酸还可以作为染料配方的酸性调节剂,以调整染料的酸碱度和溶解性。
此外,邻硝基苯甲酸还可以用于合成荧光染料、涂料和颜料等。
邻硝基苯甲酸也可以用于有机合成中。
它可以作为芳香酮衍生物的中间体,通过还原反应可以合成具有重要药理活性的化合物。
例如,邻硝基苯甲酸可以与氨基甲酸酯反应生成二甲基炭酸酯,在酸性条件下,二甲基炭酸酯会失去一个甲酸酯基,生成相应的胺。
这种反应在药物合成中具有重要意义。
综上所述,邻硝基苯甲酸是一种重要的有机化合物,具有多种化学性质和应用。
它在染料工业中被广泛应用,并且在有机合成领域也有重要地位。
不过,由于其具有一定的腐蚀性和毒性,使用过程中需要注意安全操作,并合理处理废弃物。
邻硝基苯甲醛分子量1. 介绍邻硝基苯甲醛是一种有机化合物,化学式为C7H5NO3,分子量为151.12 g/mol。
它是一种黄色固体,在室温下具有刺激性气味。
邻硝基苯甲醛主要用于制备染料、药物和农药等化学品。
2. 分子式和结构邻硝基苯甲醛的分子式为C7H5NO3,其分子结构如下:NO2|H-C=O|C6H43. 物理性质邻硝基苯甲醛是黄色固体,可以溶解于有机溶剂如乙醇、醚类和氯化物,但难溶于水。
它具有刺激性气味,熔点为58-60℃,沸点为279℃。
邻硝基苯甲醛具有较好的稳定性,能在常温下长时间保存。
4. 化学性质4.1 氧化反应邻硝基苯甲醛可以被强氧化剂氧化为邻硝基苯甲酸,反应如下:C7H5NO3 + 3[O] → C7H5NO44.2 还原反应邻硝基苯甲醛可以被还原剂还原为邻氨基苯甲醛,反应如下:C7H5NO3 + 4[H] → C7H7NO4.3 亲核取代反应由于邻硝基苯甲醛分子中醛基的极性,它可以发生亲核取代反应。
例如,它可以和胺发生缩合反应,生成邻硝基苯甲醛胺。
5. 合成方法邻硝基苯甲醛可以通过对硝基苯甲酸的邻位进行氧化反应制得。
具体的合成路线如下:1.将硝基苯甲酸和浓硫酸在低温下反应,得到硝基苯甲酸的硝酰化物;2.将硝基苯甲酸的硝酰化物与氯化锑反应,生成硝基苯甲酸的锑酸酯;3.将硝基苯甲酸的锑酸酯用氯化硼还原,得到邻硝基苯甲醛。
6. 应用领域6.1 染料邻硝基苯甲醛可以被用作染料的中间体。
通过对邻硝基苯甲醛进行进一步的化学反应,可以制备出不同种类的有机染料。
6.2 药物邻硝基苯甲醛可以用于合成某些药物分子的中间体。
在药物研发过程中,邻硝基苯甲醛可以通过一系列反应步骤,将其转化为目标化合物。
6.3 农药邻硝基苯甲醛也可以用于制备农药。
农药作为植物保护剂,在农业生产中起到防治害虫和病害的作用。
通过对邻硝基苯甲醛进行化学修饰,可以制备出具有杀虫作用的化合物。
7. 安全性邻硝基苯甲醛具有一定的刺激性和毒性,应当避免直接接触皮肤和吸入其蒸汽。
MATERIAL SAFETY DATA SHEETM ANUFACTURERContact Information:ALL-IN-LINE CHEMICALS ENTERPRISE CO.,LTD.NO.16,Chung Zhen St.,Lu Chu County, Taoyuan Hsien, Taiwan,R.O.C.Telephone: 03-3543066 FAX: 03-35423871. IDENTIFICATIONProduct name: 2-NitrotolueneProduct use: For laboratory research purposes.Restrictions on use: Not for drug or household use.2. HAZARD(S) IDENTIFICATIONOSHA Haz Com: CFR 1910.1200: Acute Toxicity - Oral [Category 4]Acute Toxicity - Inhalation [Category 3]Toxic to Reproduction [Category 2]Specific Target Organ Toxicity (Single Exposure) [Category 1]Specific Target Organ Toxicity (Single Exposure) [Category 3]Specific Target Organ Toxicity (Repeated Exposure) [Category 1]Specific Target Organ Toxicity (Repeated Exposure) [Category 2]Aquatic Hazard (Acute) [Category 2]Aquatic Hazard (Long-Term) [Category 2]Signal word: Danger!Hazard Statement(s): Harmful if swallowedSuspected of damaging fertility or the unborn childToxic if inhaledToxic to aquatic lifeToxic to aquatic life with long lasting effectsCauses damage to: BloodMay cause drowsiness or dizziness.Causes damage to organs: Blood through prolonged or repeated exposure.May cause damage to organs: Liver through prolonged or repeated exposure.Pictogram(s) or Symbol(s):Precautionary Statement(s):[Prevention] Do not eat, drink or smoke when using this product. Wash hands and face thoroughly after handling. Do not breathe fume, mist, vapors or spray. Use only outdoors or in a well-ventilated area. Obtainspecial instructions before use. Do not handle until all safety precautions have been read and understood. Wear protective gloves, protective clothing, eye protection and face protection. Avoid breathing fume, mist, vapors or spray.[Response] If swallowed: Immediately call a poison center or doctor. Rinse mouth. If inhaled: Remove person to fresh air and keep comfortable for breathing. Call a poison center or doctor. If exposed: Call a poison center or doctor. Call a poison center or doctor if you feel unwell. Get medical advice or attention if you feel unwell.[Storage] Store in a well-ventilated place. Keep container tightly closed. Store locked up.SAFETY DATA SHEETTransportation Emergencies:2. HAZARD(S) IDENTIFICATION[Disposal] Dispose of contents and container in accordance with US EPA guidelines for the classification and determination of hazardous waste listed in 40 CFR 261.3. (See Section 13)3. COMPOSITION/INFORMATION ON INGREDIENTSSubstance/Mixture: SubstanceChemical Formula: C7H7NO24. FIRST-AID MEASURESInhalation: Immediately call a poison center or doctor. Effects of exposure (inhalation) to substance may be delayed.Inhalation of vapors or contact with substance will result in contamination and potential harmful effects. Move victim to fresh air. Give artificial respiration if victim is not breathing. Administer oxygen if breathing is difficult. Keep victim warm and quiet. Treat symptomatically and supportively. Ensure that medical personnel are aware of the material(s) involved and take precautions to protect themselves.Skin contact: Immediately call a poison center or doctor. Effects of exposure (skin contact) to substance may be delayed. Remove and wash contaminated clothing before re-use. Remove and isolate contaminated clothing and shoes. In case of contact with substance, immediately flush skin with running water for at least 20 minutes. Treat symptomatically and supportively. Ensure that medical personnel are aware of the material(s) involved and take precautions to protect themselves.Eye contact: If this chemical contacts the eyes, immediately wash (irrigate) the eyes with large amounts of water, occasionally lifting the lower and upper eyelids. If eye irritation persists get medical advice/attention. Move victim to fresh air. Check for and remove any contact lenses. Keep victim warm and quiet. Treat symptomatically and supportively. Effects of exposure to substance may be delayed. Ensure that medical personnel are aware of the material(s) involved and take precautions to protect themselves.Ingestion: Harmful if swallowed. Effects of exposure (ingestion) to substance may be delayed. Call a physician or Poison Control Center immediately. Do not use mouth-to-mouth method if victim ingested the substance; give artificial respiration with the aid of a pocket mask equipped with a one-way valve or other proper respiratory medical device. Loosen tight clothing such as a collar, tie, belt or waistband. If a person vomits place them in the recovery position so that vomit will not reenter the mouth and throat. Rinse mouth. Keep victim warm and quiet. Treat symptomatically and supportively. Ensure that medical personnel areaware of the material(s) involved and take precautions to protect themselves.Symptoms/effects:Acute: Dizziness. Drowsiness.Delayed: No data availableImmediate medical attention: WARNING: It might be dangerous to the person providing aid to give mouth-to-mouth respiration, becausethe inhaled material is toxic. CAUTION: Victim may be a source of contamination. If breathing has stopped, perform artificial respiration. Use first aid treatment according to the nature of the injury. Ensure that medical personnel are aware of the material(s) involved and take precautions to protect themselves.5. FIRE-FIGHTING MEASURESSuitable extinguishing media: Dry chemical, CO2 or water spray. Consult with local fire authorities before attempting large scale fire fighting operations.Specific hazards arising from the chemicalHazardous combustion products: These products include: Carbon oxides Nitrogen oxidesOther specific hazards: Closed containers may explode from heat of a fire.Special precautions for fire-fighters:Use water spray or fog; do not use straight streams. Dike fire-control water for later disposal; do not scatter the material. Containers may explode whenheated. Move containers from fire area if you can do it without risk.Special protective equipment for fire-fighters:Wear positive pressure self-contained breathing apparatus (SCBA). Structural fire fighters' protective clothing provides limited protection in fire situationsONLY; it may not be effective in spill situations. Wear chemical protective clothing which is specifically recommended by the manufacturer. It mayprovide little or no thermal protection.Molecular Weight: 137.14Components: 2-NitrotoluenePercent: >99.0%(GC)CAS Number: 88-72-26. ACCIDENTAL RELEASE MEASURESPersonal precautions: Avoid contact with skin, eyes, and clothing. Keep people away from and upwind of spill/leak. Do not touch damaged containers or spilled material unless wearing appropriate protective clothing (Section 8). Warn unnecessary personnel to move away. Stop leak if you can do it without risk. Ensure adequate ventilation.Isolate the hazard area and deny entry to unnecessary and unprotected personnel.Personal protective equipment: Splash goggles. Wear protective clothing (chemical resistant suit and chemical resistant boots). Vapor respirator. Be sure to use a MSHA/NIOSH approved respirator or equivalent. Wear protective gloves (nitrile).Emergency procedures: Do not clean-up or dispose except under supervision of a specialist. In case of a spill and/or a leak, always shut off any sources of ignition, ventilate the area, and excercise caution. Do nottouch damaged containers or spilled material unless wearing appropriate protective clothing. Warn personnel to move away. Prevent entry into sewers, basements or confined areas; dike if needed.Methods and materials for containment and cleaning up:ELIMINATE all ignition sources (no smoking, flares, sparks, or flames in immediate area). Stop leak if without risk. Absorb with an inert material and put the spilled material in an appropriate waste disposal container. Use clean non-sparking tools to collect absorbed material. Dike far ahead of spill; use drysand to contain the flow of material. Ventilate the area.Environmental precautions:Keep away from living quarters. Environmental hazard. Do not let product enter drains. Prevent further leakage or spillage if safe to do so. Water runoff can cause environmental damage. Prevent entry into sewers, basements or confined areas; dike if needed.7. HANDLING AND STORAGEPrecautions for safe handling: Do NOT breath gas, fumes, vapor, or spray. Manipulate under an adequate fume hood. Do not ingest.Avoid contact with skin and eyes. Avoid contact - obtain special instructions before use. Avoid prolongedor repeated exposure. Normal measures for preventive fire protection. Use process enclosures, local exhaust ventilation, or other engineering controls to keep airborne levels below recommended exposure limits. Keep container dry. Handle and open container with care. Wear suitable protective clothing, gloves and eye/face protection. When using do not eat, drink, or smoke. Keep away from sources of ignition. Conditions for safe storage: Store locked up. Keep containers tightly closed in a cool, well-ventilated place. Keep away from incompatibles. Containers which are opened must be carefully resealed and kept upright to prevent leakage. Avoid prolonged storage periods.Storage incompatibilities: Store away from oxidizing agents8. EXPOSURE CONTROLS / PERSONAL PROTECTIONExposure limits:ACGIH TLV (TWA): 2 ppm (skin)OSHA PEL (TWA): 5 ppm (skin)Appropriate engineering controls:Handle only in a fully enclosed system and equipment. Use process enclosures, local exhaust ventilation, or other engineering controls to keep airborne levels below recommended exposure limits. Ventilation is normally required when handling or using this product. Eyewash fountains should be providedin areas where there is any possibility that workers could be exposed to the substance. Follow safe industrial engineering/laboratory practices when handling any chemical.Personal protective equipmentRespiratory protection: Vapor respirator. Be sure to use a MSHA/NIOSH approved respirator or equivalent.Hand protection: Wear protective gloves.Eye protection: Splash goggles.Skin and body protection: Wear protective clothing (chemical resistant suit and chemical resistant boots).9. PHYSICAL AND CHEMICAL PROPERTIESPhysical state (20°C): LiquidForm: ClearColor: Pale yellow - YellowOdor: Weakly AromaticOdor threshold: No data availableMelting point/freezing point: No data availableBoiling point/range: 222°C (432°F)Decomposition temperature: No data availableRelative density: 1.17Kinematic viscosity: No data availablePartition coefficient: 2.3n-octanol/water (log Pow)Flash point: 106°C (223°F)Flammability (solid, gas): No data availablepH: No data availableVapor pressure: 0.02kPa/20°CVapor density: 4.73Dynamic Viscosity: No data availableEvaporation rate: No data available(Butyl Acetate = 1)Autoignition temperature: 305°C (581°F)Flammability or explosive limits:Lower: 2.2%Upper: .?%Solubility(ies):Water: Insoluble (0.044g/100mL, 20°C)Miscible: EtherSoluble: Alcohols, Benzene, Acetone, Chloroform, Petroleum ether, Petroleum benzine, Sulfur dioxide Slightly soluble: Ammonia10. STABILITY AND REACTIVITYReactivity: Not Available.Chemical Stability: Stable under recommended storage conditions. (See Section 7)Possibility of Hazardous Reactions: No hazardous reactivity has been reported.Conditions to avoid: Avoid excessive heat and light.Incompatible materials: Oxidizing agentsHazardous Decomposition Products: No data available11. TOXICOLOGICAL INFORMATIONRTECS Number: XT3150000Acute Toxicity:ihl-mus LC50:328 mg/m3ihl-rat LC50:790 mg/m3orl-mus LD50:970 mg/kgorl-rat LD50:891 mg/kgSkin corrosion/irritation:No data availableSerious eye damage/irritation:No data availableRespiratory or skin sensitization:No data availableGerm cell mutagenicity:dna-rat-orl 150 mg/kg dns-rat-lvr 500 ug/Ldns-rat-orl 200 mg/kgCarcinogenicity: orl-rat TDLo:10.1 g/kg/12W-CIARC: Group 3 (Not classifiable ascarcinogenic to humans).NTP: No data availableOSHA: No data availableReproductive toxicity:orl-mus TDLo:140 g/kg(13W male) orl-rat TDLo:32123 mg/kg(13W male)Routes of Exposure: Inhalation, Eye contact, Ingestion, Skin contact.Symptoms related to exposure:Overexposure may result in serious illness or death. Inhalation causes irritation of the lungs and respiratory system.Potential Health Effects:Inhalation causes irritation of the lungs and respiratory system.Target organ(s):Causes damage to: BloodMay cause drowsiness or dizziness.Causes damage to organs: Blood through prolonged or repeated exposure.May cause damage to organs: Liver through prolonged or repeated exposure.12. ECOLOGICAL INFORMATIONEcotoxicityFish: 48h LC50:88 ppm (Oryzias latipes)Crustacea: No data availableAlgae: No data availablePersistence and degradability: 0.5% (by BOD), 2.3% (by UV-VIS), 0.8% (by GC) Bioaccumulative potential (BCF): 12.5 - 29.9 (conc. 0.1 ppm), 6.6 - 29.7 (conc. 0.01 ppm) Mobillity in soil: No data availablePartition coefficient: 2.3 n-octanol/water (log P ow)n-octanol/water (log Pow)Soil adsorption (Koc): No data availableHenry's Law: 5.7constant (PaM3/mol)13. DISPOSAL CONSIDERATIONSDisposal of product: Recycle to process if possible. It is the generator's responsibility to comply with Federal, State and Local rules and regulations. You may be able to dissolve or mix material with a combustible solvent and burn in a chemical incinerator equipped with an afterburner and scrubber system. This section is intended to provide assistance but does not replace these laws, nor does compliance in accordance with this section ensure regulatory compliance according to the law. US EPA guidelines for Identification and Listing of HazardousWaste are listed in 40 CFR Parts 261. The product should not be allowed to enter the environment, drains, water ways, or the soil.Disposal of container: Dispose of as unused product. Do not re-use empty containers.Other considerations: Observe all federal, state and local regulations when disposing of the substance.14. TRANSPORT INFORMATIONDOT (US)IATAIMDGEmS number: F-A, S-AReportable Quantitiy: 1000 Pounds (454 Kilograms)UN.NO.:1664Dangerous Goods Code: 6105815. REGULATORY INFORMATIONToxic Substance Control Act (TSCA 8b.):This product is ON the EPA Toxic Substances Control Act (TSCA) inventory.US Federal RegulationsCERCLA Hazardous substance and Reportable Quantity:SARA 313: Not ListedSARA 302: Not ListedState RegulationsState Right-to-KnowMassachusetts Not ListedPacking Group:IIUN number:UN1664Proper Shipping Name:Nitrotoluenes, liquidClass or Division:6.1 Toxic material.UN number:UN1664Packing Group:IIUN number:UN1664Proper Shipping Name:Nitrotoluenes, liquidProper Shipping Name:Nitrotoluenes, liquidClass or Division:6.1 Toxic material.Packing Group:IIClass or Division:6.1 Toxic material..15. REGULATORY INFORMATIONNew Jersey ListedPennsylvania Not ListedCalifornia Proposition 65: ListedOther InformationInternational InventoriesWHMIS hazard class: D1B: Materials causing immediate and serious toxic effects. (Toxic) D2A: Materials causing other toxic effects. (Very Toxic)D2B: Materials causing other toxic effects. (Toxic)Canada: DSL On DSLEC-No: 201-853-3Notice Through Official Gazettes Reference Number: (Japan)ENCS: (3)-43716. OTHER INFORMATIONRevision date: 11/20/2013HMIS Classification:2-NitrotolueneHealth: 3Health: 3Flammability: 1 Flammability: 1NFPA Rating:Instability: 0 Physical: 0。