化学反应工程第一章,第二章
- 格式:ppt
- 大小:1.43 MB
- 文档页数:9

第一章绪论习题1.1 解题思路:(1)可直接由式(1.7)求得其反应的选择性(2)设进入反应器的原料量为100 ,并利用进入原料气比例,求出反应器的进料组成(甲醇、空气、水),如下表:组分摩尔分率摩尔数根据式(1.3)和式(1.5)可得反应器出口甲醇、甲醛和二氧化碳的摩尔数、和。
并根据反应的化学计量式求出水、氧及氮的摩尔数,即可计算出反应器出口气体的组成。
习题答案:(1) 反应选择性(2) 反应器出口气体组成:第二章反应动力学基础习题2.1 解题思路:利用反应时间与组分的浓度变化数据,先作出的关系曲线,用镜面法求得反应时间下的切线,即为水解速率,切线的斜率α。
再由求得水解速率。
习题答案:水解速率习题2.3 解题思路利用式(2.10)及式(2.27)可求得问题的解。
注意题中所给比表面的单位应换算成。
利用下列各式即可求得反应速率常数值。
习题答案:(1)反应体积为基准(2)反应相界面积为基准(3)分压表示物系组成(4)摩尔浓度表示物系组成习题2.9 解题思路:是个平行反应,反应物A的消耗速率为两反应速率之和,即利用式(2.6)积分就可求出反应时间。
习题答案:反应时间习题2.11 解题思路:(1)恒容过程,将反应式简化为:用下式描述其反应速率方程:设为理想气体,首先求出反应物A的初始浓度,然后再计算反应物A的消耗速率亚硝酸乙酯的分解速率即是反应物A的消耗速率,利用化学计量式即可求得乙醇的生成速率。
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由式(2.49)可求得总摩尔数的变化。
这里反应物是纯A,故有:由式(2.52)可求得反应物A的瞬时浓度,进一步可求得反应物的消耗速率由化学计量关系求出乙醇的生成速率。
习题答案:(1)亚硝酸乙酯的分解速率乙醇的生成速率(2)乙醇的生成速率第三章釜式反应器习题3.1 解题思路:(1)首先要确定1级反应的速率方程式,然后利用式(3.8)即可求得反应时间。
(2)理解间歇反应器的反应时间取决于反应状态,即反应物初始浓度、反应温度和转化率,与反应器的体积大小无关习题答案:(1)反应时间t=169.6min.(2)因间歇反应器的反应时间与反应器的体积无关,故反应时间仍为169.6min.习题3.5 解题思路:(1)因为B过量,与速率常数k 合并成,故速率式变为对于恒容过程,反应物A和产物C的速率式可用式(2.6)的形式表示。
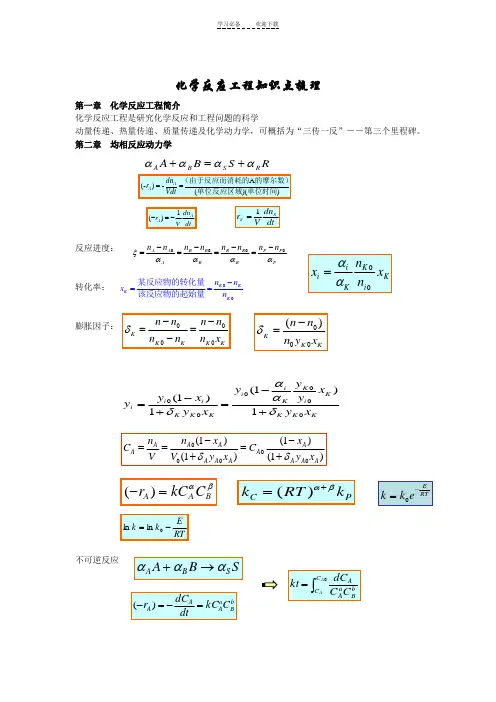
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。



第一章气-固相催化反应本征动力学概论化工生产中大多数反应是过程,气-固相催化反应是重要反应之一。
本章讨论:1,2,连续过程中化学反应速率的有关问题;气-固相催化反应的化学动力学,即本征动力学。
第一节化学计量学1-1化学计量式化学计量学是研究化学反应系统中反应物和产物组成相互关系变化的数学表达式。
化学计量式是化学计量的基础。
化学计量式表示参加反应的各组分的娄量关系,等式左边的组分为反应物,等式右边的组分为产物,化学计量式的通式为:或或一般将反应物的化学计量取负值,产物的化学计量取正值。
如果反应系统中有m 个反应,则第j个反应的化学计量式的通式为或也可用矩阵表示为......1-2 反应程度、转化率及化学膨胀因子一.反应程度对于间歇反应中的单反应进行物料衡算按化学计量关系有R上式中的ξ称为化学反应程度。
注意上述表达式中各项的正负号。
(1-7)式也可表达为:为i组分已反应的量,所以,知道反应程度即可计算出所有反应物及产物已经反应(或生成)的量。
二、转化率反应物A的反应量与其初如量之比称为A的转化率:nA0nA0nA0工业反应过程中的原料中各组分之间往往不符合化学计量关系,通常选择不过量的反应物计算转化率,这样的组分称为关键组分。
三、化学膨胀因子在恒温恒压的连续系统中发生反应对于液相反应,反应前后物料的体积流量变化不大,一般作为恒容过程。
对于气相反应,反应前后物料的体积流量变化较大。
定义每转化1mol的A时反应混合物增加或减少的量为化学膨胀因子,即:则有:由此,组分A的瞬时浓度可表示为:对于连续,则式中,大写字母表示摩尔流量,小写字母表示物质的量。
例1-1 计算下列反应的化学膨胀因子1. A+B→P+S2. A→P+S3. A+3B→2P解:1. δA=[(1+1)-(1+1)] / 1=02. δA=[(1+1)-1)] / 1=13. δA=[2-(1+3)] / 1=-21-4 多重反应的收率及选择率1,单一反应和多重反应单(一)反应:一组物定的反应物反应生成一组特定的产物。

化学反应工程第四版教学设计写在前面化学反应工程是化学工程领域的一门基础课程,主要涉及到化学反应的基本原理、动力学、热力学、平衡等方面的知识,并通过实例和案例介绍化工生产中的反应器设计、反应机理研究以及相关工业过程的优化设计等内容,是化工专业大学生必须要掌握的一种课程。
针对该课程,我们进行了第四版的教学设计,在教学方法、实践环节等方面进行了更加科学、可操作性更强的设计和优化,以期能够帮助学生更好地掌握和应用化学反应工程知识。
教学大纲第一章化学反应基本原理•化学反应动力学学习•化学反应的热力学基础•化学平衡原理的基本概念和应用第二章反应器设计•单相反应器的设计•多相反应器的设计•反应机理的研究方法第三章工业反应工程实例•生产乙酸工艺流程介绍•生产苯乙烯工艺流程介绍•硝化甘油工艺流程介绍教学方法理论教学理论教学主要采用模块化授课法和案例教学法相结合的方式进行。
教师按照章节内容安排课程内容,可将部分理论知识应用到实际工业生产过程中进行案例分析。
如生产乙酸中所使用的醋酸加氧脱氢反应、硝化甘油的氧化反应等。
实验教学实验教学主要采用小组合作的方式进行。
以单相反应器的设计实验为例,学生将被分成四人小组,在实验室同一时间完成反应器的设计与搭建实验,通过实验的方式让学生更好地掌握反应器设计的基本原理和操作技巧。
课外实践针对本课程,我们还将开展相关课外实践活动,包括拜访企业、参加工业实践项目等方式,通过实践方式让学生在实际生产环境中体验学习到的知识。
例如参观乙酸生产厂家进行实地考察、参与部分工业过程实践项目等。
评价方式评价方式采用多维度评价方式进行,分为理论考试、实验报告评价、实验操作表现评价等多个方面进行考核,以期全面评价学生的学习情况。
结语化学反应工程第四版的教学设计旨在通过科学、实用的教学方法以及相关的课外实践,让学生更好地掌握化学反应工程的知识和技能,并更好地应用到相关的工业生产环境中,为相关领域的发展做出贡献。

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。



第一章绪论1.1 化学反应工程学的范畴和任务1.1.1化学反应工程发展简述自然界的物质的运动或变化过程由物理或化学的两类,物理过程不牵涉化学反应,但化学过程却总是与物理因素有着紧密联系。
所以化学反应过程是物理与化学两类因素综合体。
远溯古代,陶瓷制作、酿酒等工艺,但直到本世纪五十年代一直还未形成一门专门研究的独立学科,到1957年举行的第一次欧洲反应工程会议上确立了这一学科的名称。
1.1.2 化学反应工程的范畴和任务化学反应工程学:是一门研究化学反应的工程问题的科学,既以化学反应作为研究对象,又以工程问题为研究对象,把二者结合起来的学科体系。
一、研究的范畴1.化工热力学:确定物系的各种物性常数(热容、研所引资、反应热等),看化学反应是否能进行及其反应程度。
2.反应动力学:专门阐明学反应速率与各项物理因素(如温度、压力、催化剂等)之间的定量关系。
为实现某一反应,要选定合易的条件及反应器的结构型式、尺寸和处理能力等,这些都依赖于对反应动力学特性的认识。
3.催化剂4.设备型式、操作方法和流程有小试到扩是出现放大效应,因此工业装置的反映条件必须结合工程上的考虑才能合理的确定。
反应器型式:管式、釜式、塔式、固定床或流化床等。
操作方式:分批式、连续式或半连续式。
反应器的型式与特性表型式适用反应优缺点搅拌槽液相、液—液、液—固相适用性大,操作弹性大,温度、浓度易控制,产品质量均一管式气相、液相返混小,反应器容积小,比传热面大空塔或搅拌塔液相、液—液相结构简单,返混程度与高/径比及搅拌有关,轴向温差大鼓泡塔或挡板鼓泡塔气—液相,气—液—固相气相返混小,液相返混大,温度较易调节,气体压降大,流速有限制填料塔液相、气—液相结构简单,返混小,压降小,有温差,填料装卸麻烦板式塔气—液相逆流接触,气液返混均小,流速有限制,如需传热,常另加传热面喷雾塔气—液相快速反应结构简单,液体表面积大,停留时间受塔高限制,气流速度有限制固定床气—固相返混小,催化剂用量少,不易磨损,装卸麻烦,传热控温不易流化床气—固相,特别是催化剂失活很快的反应传热好,温度均匀,易控制,催化剂有效系数大,磨损大,返混大,对转化率不利,操作条件限制大移动床同上固体返混小,固气比可变性大,床内温差大,调节困难滴流床气—液—固相催化剂带出少,分离易,气液分不要均匀,温度调节困难蓄热床气相,以固相为热载体结构简单,调节范围较广,切换频繁,温度波动大,收率低喷嘴式气相,高速反应的液相传热、传质速度快,流体混合好,反应物急冷易分批式(或间歇)操作:是指一批反应物料投入反应器内后,让它经过一定的反应,然后再取出的操作方法。
化学反应工程1-2章答案(华东理工大学张濂版课后习题)第一章1-1 乙苯循环量:46kg/h 补充的新鲜乙苯:100-46=54 kg/h单程转化率=(100-46)/100×100%=54%选择率=(48/105)/(54/107)×100%=90.6%单程摩尔收率=(48/105)/(100/107)×100%=48.9% 单程质量收率=48/100×100%=48% 总摩尔收率=(48/105)/(54/107)×100%=90.6% 总质量收率=48/54×100%=88.9%单耗(摩尔)=1/90.6%=1.104 单耗(质量)=1/88.9%=1.1241-2以100kg进口气体为基准,设甲醛转化量为xkg则:进口出口100kg 100kg甲醛:10kg 1.6kg丁炔二醇:0kg 7.65kg转化率=(10-1.6)/10×100%=84%选择率=(7.65/86)/((10-1.6)/30)×100%=31.76%单程质量收率=7.65/100×100%=7.65%总质量收率=7.65/(10-1.6)×100%=91.07%1-3得到的顺丁烯二酸酐:20.27×34.5%=6.99t质量收率:6.99/7.21×100%=96.9%摩尔收率:(6.99/98)/(7.21/78)×100%=72.7%第二章2-1 化学计量方程式不影响速率表达式,因此以反应物B和产物P表示的反应速率表达式为:(-r B)=k B C B2C p22-2k C=(-r A)/C A n k P=(-r A)/P A nn=0 (-r A)=k C=k P mol/m3﹒hn=1 k C =(-r A)/C A=( mol/m3﹒h)/(mol/L)=(103h)-1k P=(-r A)/P A=( mol/m3﹒h)/Mpa=mol/m3﹒h﹒Mpan=2 k C=(-r A)/C A2=( mol/m3﹒h)/ (mol/L)2=(106h﹒mol)-1k P=(-r A)/P A2=( mol/m3﹒h)/(Mpa)2= mol/m3﹒h﹒Mpa2 2-3 t1=8d=11520min T1=20℃=293Kt2=10min T2=120℃=393Kln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln(11520/10)=E/8.314(1/293-1/393)E=67751J/mol2-4 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)1)r2/r1=2 T1=473K E1=156.9kJ/molln2=156.9×103 /8.314(1/473-1/T2)T2=482.3K=209.3℃△T=9.3℃2)同1),ln2=104.6×103 /8.314(1/473-1/T2)T2=489K=216℃△T=16℃2-5 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln2=E1/8.314(1/300-1/310) E1=57616J/mol同理:ln2=E2/8.314(1/400-1/410) E2=94607J/mol ln2=E3/8.314(1/500-1/510) E3=144040J/molln2=E4/8.314(1/600-1/610) E4=208332J/mol。
第一章1. Fogler 《化学反应工程》(英文版)Page 31,P1-11B.解:摩尔衡算:0Vj j j j dN F F r dV dt-+=⎰C :the corn steep liquor ;R :RNA ;P :penicillin.假设细胞为全混釜反应器,C 完全反应,R 不排出反应器,P 全部排出反应器 在非稳态操作条件的摩尔平衡:(质量平衡类似,将各量表示成以质量为基准就行)0C F =,0CdN dt=,00C C F r V += 00R F =,0R F =,R R dN r V dt=0P F =,0CdN dt=,0P P F r V -+=2. Fogler 《化学反应工程》(英文版)Page 33,P1-15B.解:由题目给出的条件可知,对于A B →的反应F A0=5 mol/h ,v 0=10 L/h ,C A0=0.5 mol/L对于CSTR : 摩尔衡算:0A AAF F V r -=- 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:00000A A A AA AC v C v C C V v r r --==--当消耗99%的组分A 时,00.01A A C C =,代入上式可得:000000.010.99A A A A AC C C V v v r r -==--代入动力学: (1)00000.990.99A A A C C V v v r k==- 代入数据得到:V=99 L (2)000000000.990.990.9999(0.01)A A A A A A C C C v V v v v r kC k C k====- 代入数据得到:V=2750 L (3)000000022000.990.990.999900(0.01)A A A A A A A C C C v V v v v r kC k C kC ====- 代入数据得到:V=66000 L对于PFR : 摩尔衡算:AA dF r dV= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:0()A A d C v r dV= 0AAdC dV v r = 00AA C AC AdC V v r =⎰代入动力学: (1)000000000000.99()(0.01)AA A A C C A AA A A A A C C A v v v dC dC V v v C C C C C r k k k k ===-=-=-⎰⎰ 代入数据得到:V=99 L (2)00000000ln ln ln1000.01AA C A A AC A A A v C v C v dC V v kC k C k C k ====-⎰代入数据得到:V=127.9 L (3)000020001111()()0.01AA C A C AA A A A v v dC V v kC k C C k C C ==-=--⎰ 代入数据得到:V=660 L 对于BR : 摩尔衡算:AA dN r V dt= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=浓度为变量的摩尔衡算方程:AA C A A C dC dt r =⎰代入动力学: (1)000.001A A C C t k-=代入数据得到:t=9.99h (2)001ln0.001A A C t k C =代入数据得到:t=19.2h (3)00111()0.001A A t k C C =- 代入数据得到:t=666h3. Fogler 《化学反应工程》(中文版)Page 23,P1-12C.解:由题目条件可知,反应A B C →+,在恒体积、等温、完全混合的间歇釜中进行,且V=20 L ,N A0=20 mol ,C A0=N A0/V=1 mol/L (1) 摩尔衡算:AA dN r V dt= 动力学:A A r kC -=物质量与浓度的关系:A A N C V =浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:001ln AA C A A C A A C dC t kC k C ==-⎰代入数据得:t=7.99 min(2) 摩尔衡算:AA dN r V dt= 动力学:2A A r kC -=物质量与浓度的关系:A A N C V = 浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:020111()AA C A C AA A dC t kC k C C ==--⎰ 代入数据得:t=9.5 min(3)假设反应气体为理想气体: 状态方程:PV NRT =00208.31440033256000.02N RT P Pa Pa V ⨯⨯=== 408.31440066512000.02t t N RT P Pa Pa V ⨯⨯===第二章1. 在一个恒体积的间歇反应器中进行液相等温不可逆反应:A B →若反应为二级、一级、零级均相反应,分别求出转化率由0至0.9所需时间与转化率由0.9至0.99所需时间之比。
化学反应⼯程基本概念第⼀章1. 化学反应⼯程是⼀门研究 (化学反应个⼯程问题)的科学。
2. 所谓数学模型是指 (⽤数学⽅法表达各变量间的关系)。
3. 化学反应器的数学模型包括(动⼒学⽅程式、物料横算式⼦、热量衡算式、动量衡算式和参数计算式)4. 所谓控制体积是指(能把反应速率视作定值的最⼤空间范围)。
5. 模型参数随空间⽽变化的数学模型称为(分布参数模型)。
6. 模型参数随时间⽽变化的数学模型称为(⾮定态模型)。
7. 建⽴物料、热量和动量衡算⽅程的⼀般式为 (累积量=输⼊量-输出量)。
第⼆章1. 均相反应是指 (在均⼀的液相或⽓相中进⾏的反应)。
2. 对于反应aA + bB → pP + sS ,则r P =( p/a )r A 。
3.着眼反应物A 的转化率的定义式为(转化率Xa=转化了的物料A 的量/反应开始的物料A 的量)。
4. 产物P 的收率ΦP 与得率ХP 和转化率x A 间的关系为( Xp/Xa )。
5. 化学反应速率式为r A =k C C A αC B β,⽤浓度表⽰的速率常数为k C ,假定符合理想⽓体状态⽅程,如⽤压⼒表⽰的速率常数k P ,则k C =[ (RT)的a+B 次⽅]k P 。
6.对反应aA + bB → pP + sS 的膨胀因⼦的定义式为(P+S )-(A+B))/A 。
7.膨胀率的物理意义为 (反应物A 全部转化后系统的体积变化率)。
8. 活化能的⼤⼩直接反映了 (反应速率) 对温度变化的敏感程度。
9. 反应级数的⼤⼩直接反映了(反应速率) 对浓度变化的敏感程度。
10.对复合反应,⽣成主产物的反应称为 (主反应),其它的均为(副反应)。
11. 平⾏反应A → P 、A → S 均为⼀级不可逆反应,若E 1>E 2,选择性S p 与 (A 的浓度)⽆关,仅是 (A 的浓度) 的函数。
12. 如果平⾏反应A → P 、A → S 均为⼀级不可逆反应,若E 1>E 2,提⾼选择性S P 应(提到温度)。