关键过程确认记录Word 文档
- 格式:doc
- 大小:84.50 KB
- 文档页数:4
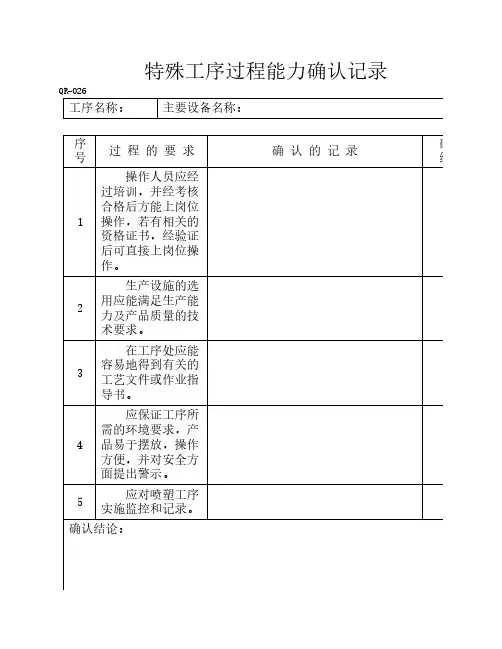
特殊工序过程能力确认记录QR-026
工序名称:主要设备名称:
序号过 程 的 要 求确 认 的 记 录
确 认
结 果
1
操作人员应经过培训,并经考核合格后方能上岗位操作,若有相关的资格证书,经验证后可直接上岗位操作。
2
生产设施的选用应能满足生产能力及产品质量的技术要求。
3
在工序处应能容易地得到有关的工艺文件或作业指导书。
4
应保证工序所需的环境要求,产品易于摆放,操作方便,并对安全方面提出警示。
5
应对喷塑工序实施监控和记录。
确认结论:
参加确认人员: 日 期:。


设计变更记录(模板)word版本设计变更记录(模板)1.引言本文档记录了设计变更的详细信息,旨在记录设计变更的背景、目的、过程以及对相关设计文档的影响。
设计变更是为了满足项目需求变更或优化设计而进行的调整。
通过记录设计变更的过程,可以追溯设计变更的具体原因和影响,并保证团队成员之间的沟通和协作的准确性。
2.设计变更概述设计变更的概述是对本次变更的简要描述。
包括变更的名称、变更的背景、以及变更的目的和意义。
2.1 变更名称设计变更的名称是对本次变更的简要描述,方便团队成员快速了解本次变更的内容。
2.2 变更背景设计变更的背景是对本次变更的原因进行说明,包括需求变更、问题发现或优化设计等情况。
通过清楚地阐述变更的背景,可以使团队成员更好地理解设计变更的动机。
2.3 变更目的和意义设计变更的目的和意义是对本次变更所带来的好处进行分析和说明。
明确设计变更的目的,并解释为何进行此变更对项目的重要性,有助于团队成员理解变更的价值和意义。
3.设计变更过程设计变更的过程是对本次变更的具体步骤进行记录,包括设计变更的起因、跟踪、实施以及验证等阶段。
3.1 变更起因设计变更的起因是对变更的触发条件进行描述,如需求变更、缺陷报告或技术调研等。
详细记录变更起因有助于回顾变更的根源,并为后续的变更决策提供依据。
3.2 变更跟踪设计变更的跟踪是对变更过程中的关键环节进行跟踪和记录。
包括变更提案、变更评审、变更实施计划编制等。
通过记录变更的跟踪过程,可以确保变更过程的规范性和可追溯性。
3.3 变更实施设计变更的实施是实际进行变更的过程。
在设计变更的实施阶段,应详细记录变更的实施步骤、工作量估算、风险评估等信息,以确保变更能够按计划顺利进行。
3.4 变更验证设计变更的验证是对变更后的设计进行验证和确认。
通过详细记录变更验证的方法、结果以及验证人员的反馈,可以评估变更的效果,并及时进行问题修复和改进。
4.设计变更影响分析设计变更的影响分析是对变更对项目其他设计文档和工作的影响进行评估和分析。


WORD 整理版密级:B 版次:B 修改码:1管理体系指导性文件文件编号:YG/MS0302—0 02 关键工序与特殊过程管理制度1、目的为强化工序质量控制,使关键工序和特殊过程的产品质量处于稳定状态并强化工序质量管理。
2、适用范围适用于公司产品生产过程中关键工序和特殊过程的质量控制。
3、术语3.1关键工序是组织根据产品的生产特性而确定的加工工序,并采用一定的控制手段提高该工序的稳定性。
3.2特殊过程特殊过程是指:对形成的产品是否合格不易或不能经济地进行检验或试验来验证的过程及其致使问题在产品投入使用后或服务已交付后才显现的过程。
3.3工序能力工序能力是指处于稳定状态下的实际加工能力。
4、职责4.1技术部负责监督和检查关键工序和特殊过程的受控情况。
负责组织对公司关键工序、特殊过程的工序能力进行确认,并填写相应的“工序能力确认表” 。
4.2制造部负责关键工序和特殊过程的日常管理,负责按《基础设施、设备和工作环境控制程序》规定组织建立关键工序、特殊过程中的设备管理台帐并对其实施有效管理。
4.3质保部负责《监视和测量设备控制程序》对关键工序、特殊过程所用各类仪器、仪表定期进行计量校准。
4.4公司办负责按《人力资源控制程序》对关键工序、特殊过程的操作人员和检验人员实施WORD 整理版资格和岗位培训。
5 关键工序的控制5.1关键工序的设置原则1)对成品的质量、性能、功能、寿命、可靠性及成本等有直接影响的工序;2)产品重要质量特性形成的工序;3)工艺复杂,质量容易波动,对工人技艺要求高或总是发生问题较多的工序。
工艺人员依据关键工序设置原则在工艺文件中确定关键工序并负责编制“关键工序汇总表”,经技术部部长批准后,发放相关部门。
5.2关键工序的过程能力确认关键工序的确认以‘三定'和记录为准则:5.2.1三定:定工序、定人员、定设备1)工序控制工艺流程图及生产现场工艺文件中对关键工序必须有明确标示。
2)人员控制a.关键工序人员均应接受专业培训,管理教育,并经考核合格,持证上岗。
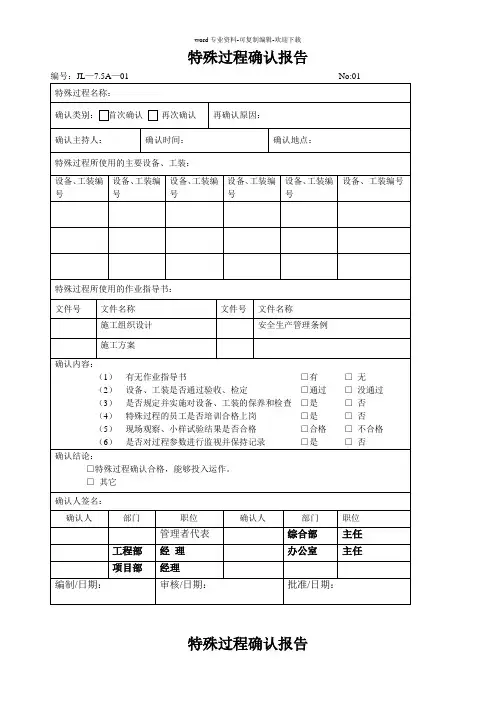

GHRF/SG3/N99-10:2004 (第2版)最终文件标题:质量管理体系——过程确认指南编写:GHTF 第3研究组签署:全球协调任务组织日期:2004年1月第2版Taisuke Hojo, GHTF主席本文件由全球协调任务组织制作,该组织是一个志愿团体,由医疗器械管理机构和管理行业的代表组成。
本文件着重为管理机构提供关于医疗器械法规使用方面的非约束性指导,其撰写是经过多方面征求意见的。
本文件的印制、发售或使用是不受限制的。
但是,将本文件部分或全部引用到其它文件,或将它翻译成英语以外的其它语言,均不代表全球协调任务组织认同。
GHTF第3研究组—质量管理体系过程确认指南— 2004年1月第2页过程确认指南目录0前言 (3)1 目的和范围 (5)1.1目的 (5)1.2 范围 (5)2 定义 (5)3 质量管理体系范围内的过程确认 (5)3.1 过程确认的判定 (6)3.2 举例 (7)4 过程确认的统计方法和工具 (8)5 确认的实施 (8)5.1 准备阶段 (8)5.2 方案编制 (9)5.3 安装鉴定(IQ) (10)5.4 操作鉴定(OQ) (10)5.5 性能鉴定(PQ) (11)5.6 最终报告 (12)6 确认状态的保持 (12)6.1 监视和控制 (12)6.2 过程和(或)产品的改变 (12)6.3 连续的控制状态 (12)6.4 再确认原因举例 (12)7 过程确认中历史数据的使用 (13)8 活动小结 (13)附录A 过程确认的统计方法和工具 (15)B 确认的举例 (25)GHTF第3研究组—质量管理体系过程确认指南— 2004年1月第3页0前言由于在ISO 13485:2003中内容有变化,修改后的“质量管理体系——过程确认指南”(原发表于1999年)重新发表名为“GHTF/SG3/N99-10:2004(第2版本)”的文件,它被使用于一些管理体系里。
过程确认指南从0到3.4部分、图一到附录B都进行了修改。

GHRF/SG3/N99-10:2004 (第2版)最终文件标题:质量管理体系——过程确认指南编写:GHTF 第3研究组签署:全球协调任务组织日期:2004年1月第2版Taisuke Hojo, GHTF主席本文件由全球协调任务组织制作,该组织是一个志愿团体,由医疗器械管理机构和管理行业的代表组成。
本文件着重为管理机构提供关于医疗器械法规使用方面的非约束性指导,其撰写是经过多方面征求意见的。
本文件的印制、发售或使用是不受限制的。
但是,将本文件部分或全部引用到其它文件,或将它翻译成英语以外的其它语言,均不代表全球协调任务组织认同。
GHTF第3研究组—质量管理体系过程确认指南— 2004年1月第2页过程确认指南目录0前言 (3)1 目的和范围 (5)1.1目的 (5)1.2 范围 (5)2 定义 (5)3 质量管理体系范围内的过程确认 (5)3.1 过程确认的判定 (6)3.2 举例 (7)4 过程确认的统计方法和工具 (8)5 确认的实施 (8)5.1 准备阶段 (8)5.2 方案编制 (9)5.3 安装鉴定(IQ) (10)5.4 操作鉴定(OQ) (10)5.5 性能鉴定(PQ) (11)5.6 最终报告 (12)6 确认状态的保持 (12)6.1 监视和控制 (12)6.2 过程和(或)产品的改变 (12)6.3 连续的控制状态 (12)6.4 再确认原因举例 (12)7 过程确认中历史数据的使用 (13)8 活动小结 (13)附录A 过程确认的统计方法和工具 (15)B 确认的举例 (25)GHTF第3研究组—质量管理体系过程确认指南— 2004年1月第3页0前言由于在ISO 13485:2003中内容有变化,修改后的“质量管理体系——过程确认指南”(原发表于1999年)重新发表名为“GHTF/SG3/N99-10:2004(第2版本)”的文件,它被使用于一些管理体系里。
过程确认指南从0到3.4部分、图一到附录B都进行了修改。

特定关键环节验证和确认记录
1. 引言
本文档旨在记录和确认项目执行过程中的特定关键环节验证情况。
通过对这些关键环节的验证和确认,可以确保项目的顺利进行,并最大程度地降低风险。
2. 验证和确认记录
2.1 环节一验证情况
- 验证人员:[填写验证人员名称]
- 验证日期:[填写验证日期]
- 验证结果:[填写验证结果,如验证通过、未通过等]
2.2 环节二验证情况
- 验证人员:[填写验证人员名称]
- 验证日期:[填写验证日期]
- 验证结果:[填写验证结果,如验证通过、未通过等]
2.3 环节三验证情况
- 验证人员:[填写验证人员名称]
- 验证日期:[填写验证日期]
- 验证结果:[填写验证结果,如验证通过、未通过等]
2.4 环节四验证情况
- 验证人员:[填写验证人员名称]
- 验证日期:[填写验证日期]
- 验证结果:[填写验证结果,如验证通过、未通过等]
3. 验证和确认结果总结
本次验证和确认过程中,所有特定关键环节均通过验证并获得确认。
根据这些验证结果,我们可以确认项目在关键环节上的合规性和可行性。
4. 签名
- 项目负责人:[填写项目负责人名称] - 日期:[填写日期]。