[医学]免疫学课件——第十一章 中和试验
- 格式:ppt
- 大小:145.50 KB
- 文档页数:9

中和试验中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。
所属分类:免疫学概述动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。
中和试验(Neutralization Test)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。
两种试验方法介绍中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。
(一) 定血清-稀释病毒法(病毒中和试验)1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
(1) LD50的测定(以流行性乙型脑炎病毒为例)。
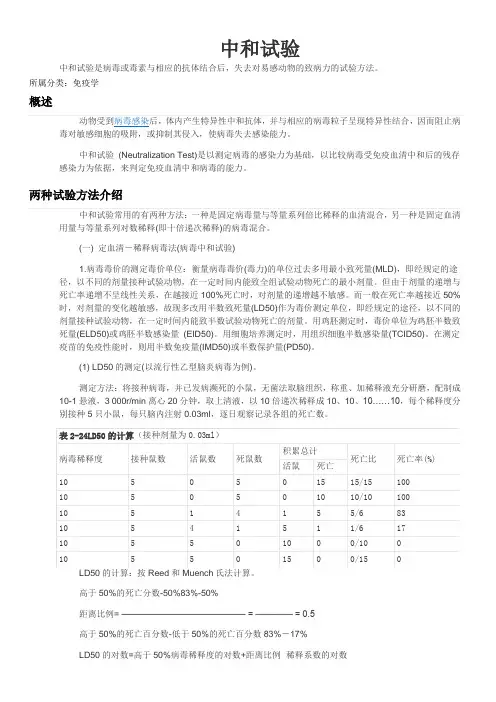
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
本例高于50%病毒稀释度的对数-6,距离比例为0.5,称释系数的对数为-1。


RSV 特异性中和抗体滴度检测一、实验原理:抗体与相应的病毒粒子特异地结合,使后者失去对易感动物或细胞的致病力。
(该试验方法以测定抗病毒血清的中和价,将待检血清2 倍递增稀释,加等量已知毒价的病毒液。
)二、实验分类:1. 固定血清--稀释病毒中和试验2. 固定病毒—稀释血清中和试验3. 简单定性中和试验4. 空斑减少法三、实验步骤:1. 提前设定56 C水浴锅,将分装好的待测血清于56 C灭活(降低补体对实验结果的影响)30min 。
2. 将加过双抗的培养基DMEM/F-12 (用于Hep-2 细胞;Vero 细胞常用DMEM培养基)和BI血清进行37C预热30min,与此同时灭好实验台(该准备3599细胞培养板灭过菌枪头以及15ml和50ml摇菌管)为后续实验做准备。
3•实验台灭菌30min,灭好台子后进行实验,首先取1.5mlEP管,用DMEM/F-12培养基8倍稀释待测血清(每管中加培养基210卩」再加相应的血清30^)1,拆开96孔培养板后在盖子进行设计(实验设计参考图1),最后向每孔中加入75卩的培养基,按照实验设计加入相应的稀释血清75门用排枪以两倍梯度稀释血清。
(注意:最终到256倍时吸出的多余的75卩血清并弃掉。
)4•实验孔以及阳性对照孔分别每孔加入25卩1(注意:加毒时应从血清低浓度到高浓度)的104TCID50病毒混匀,4C孵育2 h。
5. 在实验剩余半小时左右进行消化细胞,镜检细胞汇合度为90%左右即可用,弃掉培养液后,用2-3 ml 无血清培养吹洗几遍细胞(意图为去除死细胞或活性不好的细胞),加入 2 ml 胰酶后开始计时,将细胞培养板置于37C的CO2无菌培养箱培养消化2-3min,在镜检细胞间有间隙或细胞收缩为单个状态为好,加入等体积的无血清培养基终止,小心吸掉液体,加入有血清的培养基2-3ml 轻轻地吹下皿底部的细胞,轻微用枪吹吸几次使其成为均匀的单细胞悬液后转移到新的15ml 离心管中等待细胞计数。


中和试验步骤1、测定病毒TCID100µl50/2、制备细胞悬液,使细胞浓度约为1×105个/mL,加到96孔细胞培养板中,每孔100µl。
置37℃CO2培养箱中,直至细胞长至单层。
3、血清灭活:将待检测的血清放到56℃水浴30min(此时血清中的病原菌都已被灭活)。
4、100TCID50/50µl病毒液或者200TCID50/25µl病毒液的制备,这两者是等价的。
100TCID50/50µl病毒液制备方法:计算已测定了TCID50/100µl 的病毒原液稀释至100TCID50/50µl的稀释倍数:lg100TCID50/50µl=-log100-log(100/50)=-2.30103得100TCID50/50µl=10-2.30103,假设病毒TCID50/100µl=10-6.3,则稀释倍数=(100TCID50/50µl)÷(TCID50/100µl)=106.3÷102.30103≈9976倍。
5、取一块新的96孔板,1-10列每孔加50µl待检血清原液,再用8道孔排枪加每孔100TCID50/50µl病毒液50µl,稍微吹打使血清与病毒液混均。
11列先每孔加50µl维持液,再于11列的第一孔加50µl 标准阳性血清,将标准阳性血清往下作1:2、1:22至1:28倍稀释。
12列第1孔加标准阴性血清原液50µl,再加100TCID50/50µl病毒液50µl。
用维持液将100TCID50/50µl的病毒液作4次连续10倍稀释,稀释成10TCID50/50µl、1TCID50/50µl、0.1TCID50/50µl,依次加到第12列的3到6孔,每孔加50µl,再每孔加50µl维持液。

中和试验病毒或毒素与相应的抗体结合后,失去对易感动物的致病力,谓之中和试验。
本试验主要用于:①从待检血清中检出抗体,或从病料中检出病毒,从而诊断病毒性传染病;②用抗毒素血清检查材料中的毒素或鉴定细菌的毒素类型;③测定抗病毒血清或抗毒素效价;④新分离病毒的鉴定和分型,中和试验不仅可在易感的实验动物体内进行,亦可在细胞培养上或鸡胚上进行。
试验方法主要有简单定性试验、固定血清稀释病毒法、固定病毒稀释血清法、空斑减少法等。
(一)简单定性中和试验本法主要用于检出病料中的病毒,亦可进行初步鉴定或定型。
先根据病毒易感性选定试验动物(或鸡胚、细胞培养)及接种途径。
将病料研磨,并稀释成一定浓度(约100 LD50~1 000LD50或TCID50)。
污染的病料需加抗生素(青霉素、链霉素各200~1 000单位),或用细菌滤器过滤,与已知的抗血清(适当稀释或不稀释)等量混合,并用正常血清加稀释病料作对照。
混合后置37℃1h,分别接种实验动物,每组至少3只。
分别隔离饲喂,观察发病和死亡情况。
对照动物死亡,而中和组动物不死,即证实该病料中含有与该抗血清相应的病毒。
本法亦可用于毒素(如肉毒毒素)的鉴定和分型。
(二)固定血清稀释病毒法本法多将病毒作10倍递增稀释,分置2列试管,第一列加正常血清(对照组),第二列加待检血清(试验组)。
混合后,置37℃作用1h,将各管混合液分别接种选定的试验动物,每一稀释度用3~5只动物。
接种后,逐日观察,并记录其死亡数,观察结束后,计算LD50和中和指数(表7-1、表7-2),本法适用于大量检样的检测。
表7-1 固定血清稀释病毒法术式表7-2固定血清稀释病毒法中和试验(例一)注:[1]分母为接种数,分子为死亡数;[2]LD50计算见实例。
中和指数=中和组LD50/对照组LD50=10-2.2/10-5.5=103.3查3.3反对数是1.995,故中和指数103.3=1.995。
也就是说该待检血清中和病毒的能力为正常血清的1.995倍。


第十一章血清学试验第五节中和试验根据抗体能否中和病毒的感染性而建立的免疫学试验,称中和试验(Neutralization test)。
中和试验极为特异和敏感,既能定性又能定量,主要用于病毒感染的血清学诊断、病毒分离株的鉴定、病毒抗原性的分析、疫苗免疫原性的评价、血清抗体效价的检测等。
中和试验可在体内进行也可在体外进行。
体内中和试验也称保护试验,试验时先对实验动物接种疫苗或抗血清,间隔一定时间后,再用一定量病毒攻击,最后根据动物是否得到保护来判定结果。
常用于疫苗免疫原性的评价和抗血清的质量评价。
体外中和试验是将抗血清与病毒混合,在适当条件下作用一定时间后,接种于敏感细胞、鸡胚或动物,以检测混合液中病毒的感染力。
根据保护效果的差异,判断该病毒是否已被中和,并可计算中和指数,即中和抗体的效价。
根据测定方法不同,中和试验有终点法中和试验和空斑减数法中和试验等方法。
毒素和抗毒素也可进行中和试验。
其方法与病毒的中和试验基本相同。
一、终点法中和试验终点法中和试验(Endpoint neutralization test)是滴定使病毒感染力减少至50%时,血清的中和效价或中和指数。
有固定病毒稀释血清和固定血清稀释病毒两种方法。
(一)固定病毒稀释血清法将已知的病毒量固定,血清作倍比稀释,常用于测定抗血清的中和效价。
1.病毒毒价单位病毒毒价(毒力)的单位过去多用最小致死量(MLD),但由于剂量的递增与死亡率递增的关系不是一条直线,而是呈S形曲线,在越接近100%死亡时,对剂量的递增越不敏感。
而死亡率愈接近50%时,剂量与死亡率呈直线关系,所以现基本上采用半数致死量(LD50)作为毒价单位,而且LD50的计算应用了统计学方法,减少了个体差异的影响,因此比较准确。
以感染发病作为指标的,可用半数感染量(ID50)。
用鸡胚测定时,可用鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50);用细胞培养测定时,可用组织细胞半数感染量(TCID50)。

病毒中和试验1.介绍病毒不同亚型特异的抗体能够结合病毒表面蛋白特定的表位,从而中和病毒的感染能力。
经典的中和作用指抗体结合到病毒表面从而阻止其感染敏感细胞。
病毒中和试验的确切机制还不是很清楚。
中和作用不是简单地抗体包被病毒颗粒,或者是阻断对敏感细胞的吸附。
阻断作用可发生在吸附和侵入之后的任何阶段。
对流感病毒中和试验显示:特定的单克隆抗体阻断作用并不是发生在吸附,侵入,脱壳或者病毒基因进入细胞核的过程,这一现象充分说明了病毒中和所用的复杂性。
1.1抗体中和作用遵循的一些原则最直接检测和定量中和抗体的方法是通过测定病毒对敏感细胞感染力的减少。
感染力的抑制可以粗略的分为“quantal”试验(即全或无,可翻译为定性实验)和定量试验。
quantal实验判断结果为感染是否发生。
相对于测定有感染力的病毒颗粒数目的定量试验,quantal实验的结果是感染力的“全或无”,结果没有定量实验结果准确。
采用终点法有一系列的方法用来衡量病毒感染敏感细胞。
感染的指标可通过以下:CPE,病毒蛋白的免疫印迹和病毒导致细胞死亡的一些非特异的化学方法如[3H]胸腺嘧啶的合并或者四甲基偶氮唑盐导致的颜色改变。
在定性实验中,每个病毒颗粒在敏感细胞中增殖,形成局部灶性病变.可通过培养几天后出现CPE 来观察。
经典的定量试验是空斑形成实验,适当的细胞贴壁后,病毒吸附,软琼脂或琼脂覆盖(使病毒的增殖限制在最初感染的细胞的周围。
)为了使形成的蚀斑更明显易于肉眼观察,单层细胞通常需要染色如中性红,活细胞能够被染色,而蚀斑在红色背景下很明显。
一些疱疹病毒和痘病毒可以在液体环境中的单层细胞中形成蚀斑,因为大部分病毒是在细胞内的,蚀斑的形成是病毒通过细胞间接触感染临近细胞形成的。
这里以介绍HIV——艾滋病的致病原为例介绍中和试验的方法。
这种方法也可适用于其他的病毒。
2.材料,细胞系,和培养基CD4+T细胞,如H9,MT4或者C8166,采用含10%的胎牛血清的RPMI1640。

第五节中和试验抗原与相应抗体在体内和体外均能发生特异性结合,因抗体主要来自血清,因此在体外进行的抗原抗体反应称为血清学反应或免疫血清学技术。
第一节概述免疫血清学技术按抗原抗体反应性质不同可分为:1. 凝聚性反应包括凝集试验和沉淀试验。
2. 标记抗体技术包括荧光抗体、酶标抗体、放射性标记抗体、发光标记抗体技术等。
3. 补体参与的反应补体结合试验、免疫黏附试验等。
4. 中和反应病毒中和试验、毒素中和试验。
一、血清学反应的一般特点1. 特异性与交叉性血清学反应具有高度特异性,如抗猪瘟病毒的抗体只能与猪瘟病毒结合,而不能与口蹄疫病毒结合。
这是血清学试验用于分析各种抗原和进行疾病诊断的基础。
但若两种天然抗原之间含有部分共同抗原时,则发生交叉反应。
交叉反应是区分血清型和亚型的重要依据。
2. 抗原抗体结合机理抗原和抗体的结合为弱能非共价键结合,其结合力决定于抗原决定簇和抗体的抗原结合点之间形成的非共价键的数量、性质和距离。
常规的血清学反应,如凝集反应、沉淀反应、补体结合反应等,只有在抗原与抗体呈适当比例时,结合反应才出现凝集,沉淀等可见反应,在最适比例时,反应最明显。
这种因抗原过多或抗体过多而出现抑制可见反应的现象,称为带现象。
二、血清学反应的影响因素1.电解质特异性的抗原和抗体具有对应的极性基(羧基、氨基等),它们互相吸附后,其电荷和极性被中和因而失去亲水性,变为憎水系统。
易受电解质作用失去电荷而互相凝聚、发生凝集或沉淀反应。
2.温度较高的温度可以增加抗原和抗体接触的机会,从而加速反应的出现。
常用37℃水浴保温。
3.酸碱度血清学反应常用pH为6-8,过高或过低的pH可使抗原抗体复合物重新离解。
第二节凝聚性试验抗原与相应抗体结合形成复合物,在有电解质存在下,复合物相互凝聚形成肉眼可见的凝聚小块或沉淀物,根据此现象来测定相应抗体或抗原,称为凝聚性试验。
分为凝集试验和沉淀试验。
一、凝集试验细菌、红细胞等颗粒性抗原,与相应抗体结合,在有适当电解质存在下,形成肉眼可见的凝集团块,称为凝集试验。
第十一章血清学试验第五节中和试验根据抗体能否中和病毒的感染性而建立的免疫学试验,称中和试验(Neutralization test)。
中和试验极为特异和敏感,既能定性又能定量,主要用于病毒感染的血清学诊断、病毒分离株的鉴定、病毒抗原性的分析、疫苗免疫原性的评价、血清抗体效价的检测等。
中和试验可在体内进行也可在体外进行。
体内中和试验也称保护试验,试验时先对实验动物接种疫苗或抗血清,间隔一定时间后,再用一定量病毒攻击,最后根据动物是否得到保护来判定结果。
常用于疫苗免疫原性的评价和抗血清的质量评价。
体外中和试验是将抗血清与病毒混合,在适当条件下作用一定时间后,接种于敏感细胞、鸡胚或动物,以检测混合液中病毒的感染力。
根据保护效果的差异,判断该病毒是否已被中和,并可计算中和指数,即中和抗体的效价。
根据测定方法不同,中和试验有终点法中和试验和空斑减数法中和试验等方法。
毒素和抗毒素也可进行中和试验。
其方法与病毒的中和试验基本相同。
一、终点法中和试验终点法中和试验(Endpoint neutralization test)是滴定使病毒感染力减少至50%时,血清的中和效价或中和指数。
有固定病毒稀释血清和固定血清稀释病毒两种方法。
(一)固定病毒稀释血清法将已知的病毒量固定,血清作倍比稀释,常用于测定抗血清的中和效价。
1.病毒毒价单位病毒毒价(毒力)的单位过去多用最小致死量(MLD),但由于剂量的递增与死亡率递增的关系不是一条直线,而是呈S形曲线,在越接近100%死亡时,对剂量的递增越不敏感。
而死亡率愈接近50%时,剂量与死亡率呈直线关系,所以现基本上采用半数致死量(LD50)作为毒价单位,而且LD50的计算应用了统计学方法,减少了个体差异的影响,因此比较准确。
以感染发病作为指标的,可用半数感染量(ID50)。
用鸡胚测定时,可用鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50);用细胞培养测定时,可用组织细胞半数感染量(TCID50)。