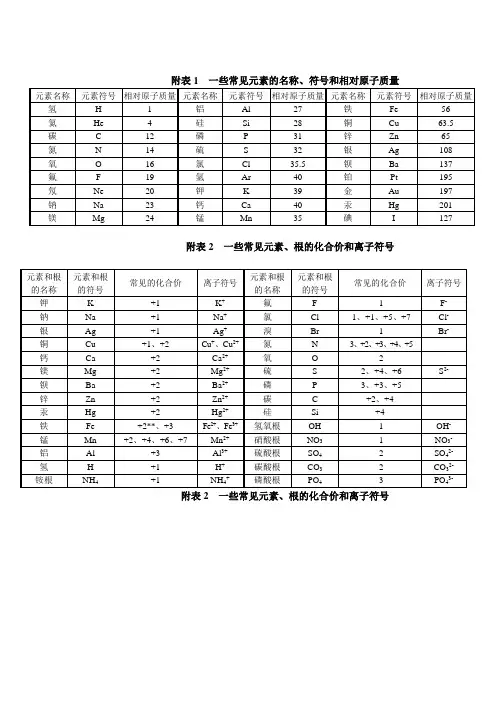
一些常见元素的名种.符号.相对原子质量
- 格式:xlsx
- 大小:12.35 KB
- 文档页数:1
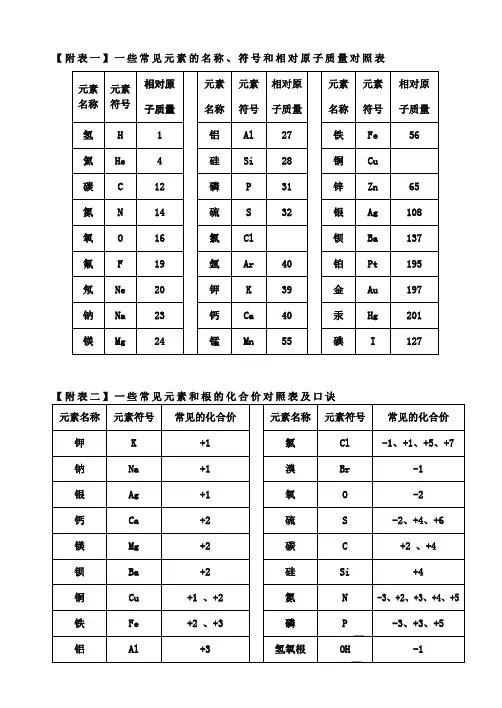
【附表一】一些常见元素的名称、符号和相对原子质量对照表一价氢锂钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷, 定价除氧都显正。
二三铁,二四碳,一五七氯都常见,二四六硫也齐全,铜汞二价最常见,单质可怜全为零。
酸根也有化合价,负一硝酸氢氧根,负二硫酸碳酸根。
还有负三磷酸根,只有正一是铵根。
【附表三】初中常见物质名称、化学式、颜色、状态对照表及物质化学式书写和读法规则(1)书写化学式的规则如下:①化合物的化学式书写规则如下表:(以书写氯化镁的化学式为例)②单质的化学式书写规则如下表:(2)化学式的读法规则如下:(3)初中常见物质颜色或溶液颜色对照表[1] 固体的颜色①红色固体:铜,氧化铁②绿色固体:碱式碳酸铜③蓝色固体:氢氧化铜,硫酸铜晶体④紫黑色固体:高锰酸钾⑤黄色固体:硫磺,金⑥无色固体:冰,干冰,金刚石⑦银白色固体:银,铁,镁,铝,汞等大多数金属单质⑧红褐色固体:氢氧化铁⑨黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)⑩白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,硫酸铜,五氧化二磷,氧化镁[2] 液体的颜色(除上面有颜色的固体外,其他固体基本都为白色固体)①无色液体:水,双氧水,乙醇②无色溶液:氯化钠溶液,氢氧化钙溶液等大多数溶液都是无色③蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液(多数含+2价铜离子化合物溶液是蓝色)④浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液(多数含+2价铁离子化合物溶液为浅绿色)⑤黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液(多数含+3价铁离子化合物溶液是蓝色)⑥紫红色溶液:高锰酸钾溶液⑦紫色溶液:石蕊溶液[3] 气体的颜色①红棕色气体:二氧化氮②黄绿色气体:氯气③无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体[4] 沉淀的颜色①白色沉淀:Fe(OH)2 、CaCO3、Mg(OH)2 、Al(OH)3、AgCl 、BaSO4 、BaCO3 、AgCO3②红褐色沉淀:Fe(OH)3 ③蓝色沉淀:Cu(OH)2 (大多数沉淀都为白色沉淀)【附表四】初中化学常见物质俗名、别名对照表【附表五】金属活动性顺序表金属活动性从左到右逐渐减弱⑴金属活动性顺序表在化学反应中提供的判断依据有如下三条:(置换反应的判断依据)①在金属活动性顺序里,金属的位置越靠前,它的活动性就越强,越活泼,就更容易与其它物质反应;②在金属活动性顺序里,位于氢(H)前面的金属能置换出盐酸、稀硫酸中的氢;③在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
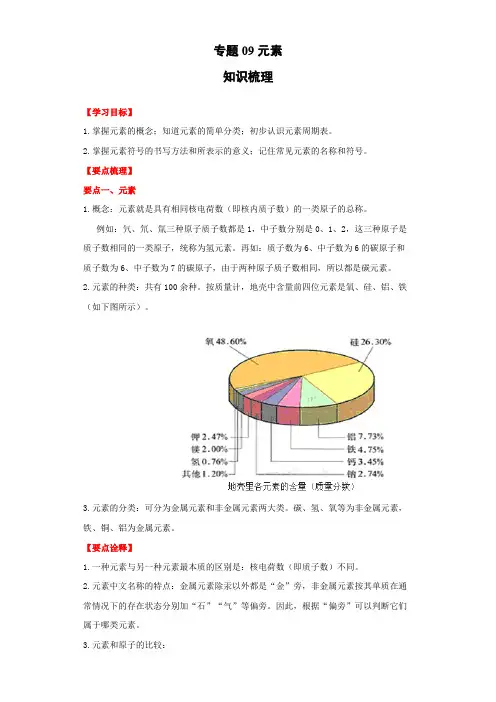
专题09元素知识梳理【学习目标】1.掌握元素的概念;知道元素的简单分类;初步认识元素周期表。
2.掌握元素符号的书写方法和所表示的意义;记住常见元素的名称和符号。
【要点梳理】要点一、元素1.概念:元素就是具有相同核电荷数(即核内质子数)的一类原子的总称。
例如:氕、氘、氚三种原子质子数都是1,中子数分别是0、1、2,这三种原子是质子数相同的一类原子,统称为氢元素。
再如:质子数为6、中子数为6的碳原子和质子数为6、中子数为7的碳原子,由于两种原子质子数相同,所以都是碳元素。
2.元素的种类:共有100余种。
按质量计,地壳中含量前四位元素是氧、硅、铝、铁(如下图所示)。
3.元素的分类:可分为金属元素和非金属元素两大类。
碳、氢、氧等为非金属元素,铁、铜、铝为金属元素。
【要点诠释】1.一种元素与另一种元素最本质的区别是:核电荷数(即质子数)不同。
2.元素中文名称的特点:金属元素除汞以外都是“金”旁,非金属元素按其单质在通常情况下的存在状态分别加“石”“气”等偏旁。
因此,根据“偏旁”可以判断它们属于哪类元素。
3.元素和原子的比较:4.元素是宏观概念,只讲种类,不讲个数。
元素与分子、原子、离子等微观概念的区别和联系(如下图所示):(1)在讨论物质的组成时,一般用“某某物质由什么元素组成”来描述,其中只涉及类别,而没有数量多少的含义。
如:水是由氢元素和氧元素组成的(或水是由氢、氧两种元素组成的);铁是由铁元素组成的。
(2)当讨论物质微观结构时,一般用“某某物质的分子是由多少原子构成的”。
如:每个水分子是由2个氢原子和1个氧原子构成的。
(3)由分子构成的物质,描述为“分子由原子构成”。
如:水分子是由氢原子和氧原子构成的。
(4)“水”、“铁”、“元素”、“组成”等都是宏观概念;“分子”、“原子”、“构成”等都是微观概念。
在描述时,注意宏观概念对应宏观概念,微观概念对应微观概念。
要点二、元素符号1.书写方法:(1)由一个字母表示的元素符号要大写;(2)由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。

27种常见元素名称符号和相对原子质量一览表名称符号相对原子名称符号相对原子质量质量氢H1铝Al27鉄Fe56氦He4硅Si28铜Cu
63.5碳C12磷P31锌Zn65氮N14硫S32钡Ag108氧O16氯Cl
35.5银Ba137氟F19氩Ar40金Pt195氖Ne20钾K39铂Au197钠Na23钙Ca40汞Hg201镁Mg24锰Mn55碘I127元素符号有来由,拉丁名称取字头;第一个字母要大写,附加字母小写后。
对比碳C,铜Cu,N氮、P磷、S硫;Si硅、氧是O,铝A
1、铅Pb;Ba钡、钨W,Ag是银、Zn锌;碘、K钾、Br溴,H是氢、U是铀;Fe铁、Na钠,Mg镁、Ca钙;Hg汞、金Au,Sn锡、Sb锑;氯Cl、钴Co,元素符号要熟记。
化学元素符号歌(二)(外文按英语字母发音读)碳是C,磷是P,铅的符号是Pb。
Cu铜,Ca钙,钨的符号W。
H氢,S硫,硅的符号Si。
金Au,银Ag,镁的符号Mg。
钠Na,氖Ne,汞的符号Hg。
硼是B,钡Ba,铁的符号Fe。
锌Zn,锰Mn,锡的符号Sn。
钾是K,碘是I,氟的符号是F。
氧是O,氮是N,溴的符号是Br。
Al铝,Cl氯,锑的符号Sb。
常见元素符号名称歌(可边写边读)(写)C H O N Cl S P,(读)碳氢氧氮氯硫磷。
(写)K Ca Na Mg Al Fe Zn,(读)钾钙钠镁铝铁锌。
(写)Br I Mn Ba Cu Hg Ag,(读)溴碘锰钡铜汞银。
(写)Sb Si Sn Pb W和Au,(读)锑硅锡铅钨和金。

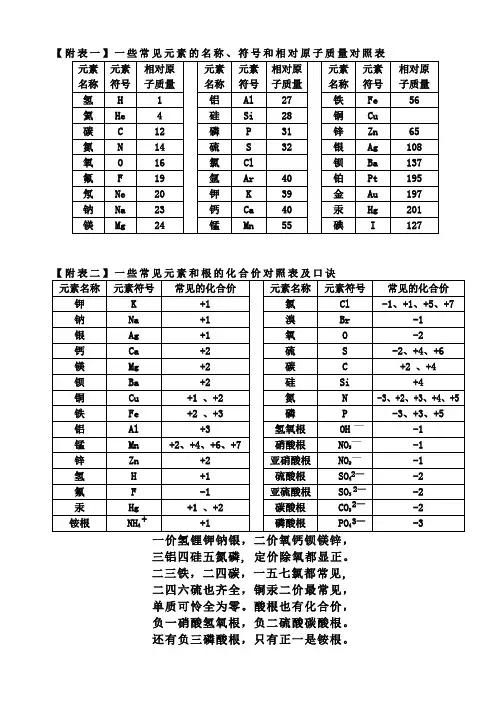
一、前二十号元素名称及符号1氢(H) 2氦(He) 3 锂(Li) 4铍(Be) 5硼(B) 6碳(C) 7氮(N) 8氧(O) 9氟(F) 10氖(Ne) 11钠(Na) 12镁(Mg) 13铝(Al) 14硅(Si) 15磷(P) 16硫(S) 17氯(Cl) 18氩(Ar) 19钾(K) 20钙(Ca) 二、常见元素的主要化合价(可根据化合价口诀记忆) 金属元素: 非金属元素: 钾 K +1 钠 Na +1 氢 H +1银 Ag +1 锌Zn +2 氟 F -1 溴Br -1 钙Ca +2 镁 Mg +2 氧 O -2 硅 Si +4钡Ba +2 铜Cu +2、+1 碳 C +2、+4 磷 P -3、+3、+5 铝Al +3 铁Fe +2、+3 硫S -2、+4、+6锰Mn +2、+4、+6、+7 氯 Cl -1、+1、+5、+7 氮 N -3、+2、+3、+4、+5 注意:①所有单质中,元素化合价都为0;②金属元素都显正价(除在单质中为0价之外);③未知元素的化合价可以由已知的来计算,原则是化合物中正负化合价的代数和为0,如在Al 2O 3中,(+3)×2+(-2)×3=0。
三、常见的化学式 1.单质(只含一种元素) (1)气体单质:H 2(氢气) N 2(氮气) O 2(氧气) F 2(氟气) Cl 2(氯气)规律:一般气体单质的右下角都有下标“2”,但稀有气体,如He(氦气)、Ne(氖气)、Ar(氩气)的单质直接用元素符号表示。
(2)金属单质(除汞外,都带“釒”旁):Na(钠) Mg(镁) Al(铝) K(钾) Ca(钙) Fe(铁) Zn(锌) Cu(铜) Ba(钡) Ag(银) (3)非金属固体单质(带“石”旁): B(硼) P(磷) Si(硅) C(碳) S(硫)2.氧化物(由两种元素组成,其中一种为O ,O 写在右边,读作“氧化某”): (1)非金属氧化物:H 2O(水) CO(一氧化碳) CO 2(二氧化碳) NO(一氧化氮) NO 2(二氧化氮) SO 2(二氧化硫) SO 3(三氧化硫) (2)金属氧化物:Fe 2O 3(三氧化二铁) Fe 3O 4(四氧化三铁) MgO(氧化镁) CaO(氧化钙) MnO 2(二氧化锰) CuO(氧化铜) Al 2O 3(三氧化二铝,或简称氧化铝) 四、常见的离子符号 离子的形成:原子−−−→−失去电子阳离子(如Na −−→−-e1失去Na +)原子−−−→−得到电子阴离子(如S −−→−-2e得到S 2-) (1)阳离子(带正电的离子):Na +(钠离子) K +(钾离子) H +(氢离子) Ag +(银离子) Mg 2+(镁离子) Cu 2+(铜离子) Ca 2+(钙离子) Ba 2+(钡离子) Al 3+(铝离子) Fe 3+(铁离子) Fe 2+(亚铁离子) NH 4+(铵根离子) (2)阴离子(带负电的离子):F -(氟离子) Cl -(氯离子) S 2-(硫离子) O 2-(氧离子)原子团(切记..!): SO 42-(硫酸根) SO 32-(亚硫酸根) HSO 3-(亚硫酸氢根) NO 3-(硝酸根) OH -(氢氧根) CO 32-(碳酸根) HCO 3-(碳酸氢根) CH 3COO -(醋酸根)注意:离子所带电荷数与对应元素(或者原子团)的化合价数值相等,但是所标位.置.不一样,而且顺序..相反。
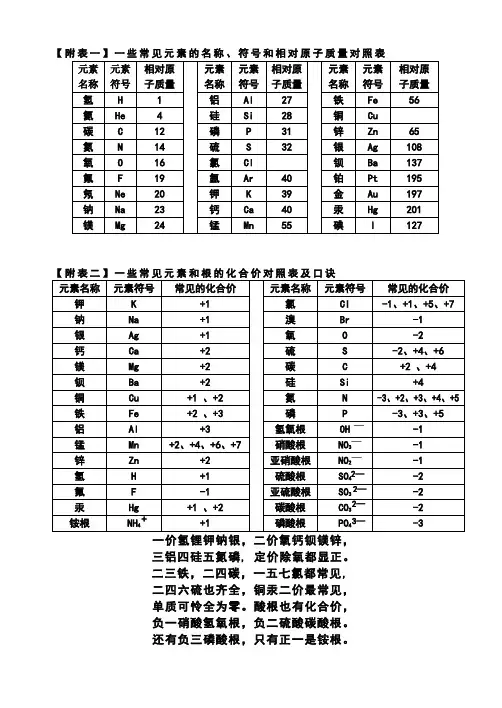
【附表一】一些常见元素的名称、符号和相对原子质量对照表三铝四硅五氮磷, 定价除氧都显正。
二三铁,二四碳,一五七氯都常见,二四六硫也齐全,铜汞二价最常见,单质可怜全为零。
酸根也有化合价,负一硝酸氢氧根,负二硫酸碳酸根。
还有负三磷酸根,只有正一是铵根。
【附表三】初中常见物质名称、化学式、颜色、状态对照表及物质化学式书写和读法规则(1)书写化学式的规则如下:①化合物的化学式书写规则如下表:(以书写氯化镁的化学式为例)(2)化学式的读法规则如下:(3)初中常见物质颜色或溶液颜色对照表[1] 固体的颜色①红色固体:铜,氧化铁②绿色固体:碱式碳酸铜③蓝色固体:氢氧化铜,硫酸铜晶体④紫黑色固体:高锰酸钾⑤黄色固体:硫磺,金⑥无色固体:冰,干冰,金刚石⑦银白色固体:银,铁,镁,铝,汞等大多数金属单质⑧红褐色固体:氢氧化铁⑨黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)⑩白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,硫酸铜,五氧化二磷,氧化镁[2] 液体的颜色(除上面有颜色的固体外,其他固体基本都为白色固体)①无色液体:水,双氧水,乙醇②无色溶液:氯化钠溶液,氢氧化钙溶液等大多数溶液都是无色③蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液(多数含+2价铜离子化合物溶液是蓝色)④浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液(多数含+2价铁离子化合物溶液为浅绿色)⑤黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液(多数含+3价铁离子化合物溶液是蓝色)⑥紫红色溶液:高锰酸钾溶液⑦紫色溶液:石蕊溶液[3] 气体的颜色①红棕色气体:二氧化氮②黄绿色气体:氯气③无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体[4] 沉淀的颜色①白色沉淀:Fe(OH)2 、CaCO3、Mg(OH)2 、Al(OH)3、AgCl 、BaSO4 、BaCO3 、AgCO3②红褐色沉淀:Fe(OH)3 ③蓝色沉淀:Cu(OH)2 (大多数沉淀都为白色沉淀)【附表五】金属活动性顺序表⑴金属活动性顺序表在化学反应中提供的判断依据有如下三条:(置换反应的判断依据) ①在金属活动性顺序里,金属的位置越靠前,它的活动性就越强,越活泼,就更容易与其它物质反应;②在金属活动性顺序里,位于氢(H )前面的金属能置换出盐酸、稀硫酸中的氢; ③在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
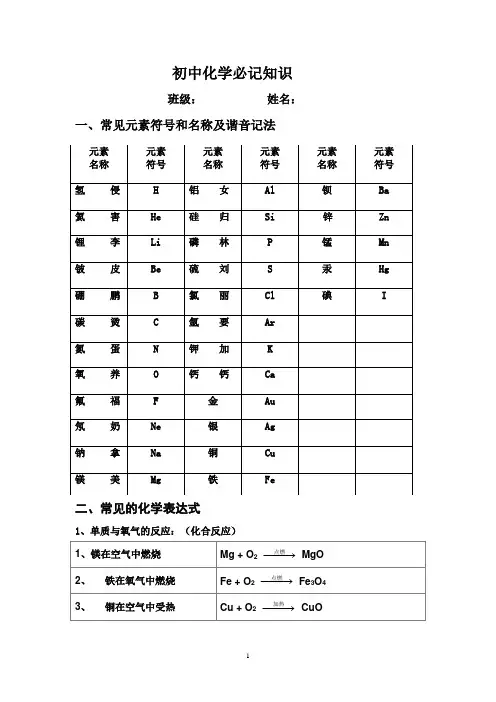
【附表一】一些常见元素的名称、符号和相对原子质量对照表三铝四硅五氮磷, 定价除氧都显正。
二三铁,二四碳,一五七氯都常见,二四六硫也齐全,铜汞二价最常见,单质可怜全为零。
酸根也有化合价,负一硝酸氢氧根,负二硫酸碳酸根。
还有负三磷酸根,只有正一是铵根。
【附表三】初中常见物质名称、化学式、颜色、状态对照表及物质化学式书写和读法规则(1)书写化学式的规则如下:①化合物的化学式书写规则如下表:(以书写氯化镁的化学式为例)(2)化学式的读法规则如下:(3)初中常见物质颜色或溶液颜色对照表[1] 固体的颜色①红色固体:铜,氧化铁②绿色固体:碱式碳酸铜③蓝色固体:氢氧化铜,硫酸铜晶体④紫黑色固体:高锰酸钾⑤黄色固体:硫磺,金⑥无色固体:冰,干冰,金刚石⑦银白色固体:银,铁,镁,铝,汞等大多数金属单质⑧红褐色固体:氢氧化铁⑨黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)⑩白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,硫酸铜,五氧化二磷,氧化镁[2] 液体的颜色(除上面有颜色的固体外,其他固体基本都为白色固体)①无色液体:水,双氧水,乙醇②无色溶液:氯化钠溶液,氢氧化钙溶液等大多数溶液都是无色③蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液(多数含+2价铜离子化合物溶液是蓝色)④浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液(多数含+2价铁离子化合物溶液为浅绿色)⑤黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液(多数含+3价铁离子化合物溶液是蓝色)⑥紫红色溶液:高锰酸钾溶液⑦紫色溶液:石蕊溶液[3] 气体的颜色①红棕色气体:二氧化氮②黄绿色气体:氯气③无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体[4] 沉淀的颜色①白色沉淀:Fe(OH)2 、CaCO3、Mg(OH)2 、Al(OH)3、AgCl 、BaSO4 、BaCO3 、AgCO3②红褐色沉淀:Fe(OH)3 ③蓝色沉淀:Cu(OH)2 (大多数沉淀都为白色沉淀)【附表五】金属活动性顺序表⑴金属活动性顺序表在化学反应中提供的判断依据有如下三条:(置换反应的判断依据) ①在金属活动性顺序里,金属的位置越靠前,它的活动性就越强,越活泼,就更容易与其它物质反应;②在金属活动性顺序里,位于氢(H )前面的金属能置换出盐酸、稀硫酸中的氢; ③在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
