实验八硫代硫酸钠含量的测定PPT精选文档
- 格式:ppt
- 大小:46.00 KB
- 文档页数:5


硫代硫酸钠标准溶液滴定
硫代硫酸钠标准溶液滴定是化学分析实验中常见的一种定量分析方法,通过滴定硫代硫酸钠标准溶液来确定待测溶液中的某种化合物的含量。
本文将介绍硫代硫酸钠标准溶液滴定的实验步骤、操作要点和注意事项。
实验步骤:
1. 准备硫代硫酸钠标准溶液,称取适量的硫代硫酸钠固体,溶解于一定量的去离子水中,配制成一定浓度的标准溶液。
2. 取一定量的待测溶液,加入适量的指示剂,常用的指示剂有淀粉溶液、甲基橙溶液等,使溶液呈现特定的颜色。
3. 用硫代硫酸钠标准溶液从容量瓶中滴定待测溶液,直至溶液颜色发生明显改变,记录下滴定所需的硫代硫酸钠标准溶液的体积。
4. 重复实验,直至滴定结果相近,取平均值作为最终结果。
操作要点和注意事项:
1. 滴定时要注意滴定管的放置角度,避免溶液滴出时产生误差。
2. 指示剂的选择要根据待测溶液的性质来确定,以保证滴定结果的准确性。
3. 滴定时要慢慢滴加硫代硫酸钠标准溶液,特别是接近滴定终点时,要小心操作,避免过量滴定。
4. 滴定结束后,应及时记录滴定所需的硫代硫酸钠标准溶液的体积,并进行结果计算。
5. 实验结束后,要及时清洗玻璃仪器,保持实验台面的清洁。
硫代硫酸钠标准溶液滴定是一种常用的分析化学实验方法,通过本文介绍的实验步骤和操作要点,相信大家对硫代硫酸钠标准溶液滴定有了更深入的了解。
在进行实验操作时,一定要严格按照操作要点和注意事项进行,以确保实验结果的准确性和可靠性。
希望本文能对大家有所帮助,谢谢阅读。

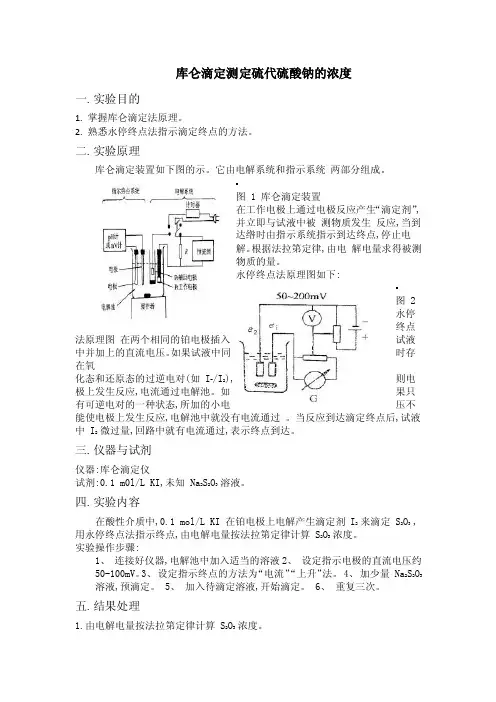
库仑滴定测定硫代硫酸钠的浓度一.实验目的1. 掌握库仑滴定法原理。
2. 熟悉永停终点法指示滴定终点的方法。
二.实验原理库仑滴定装置如下图的示。
它由电解系统和指示系统两部分组成。
图 1 库仑滴定装置在工作电极上通过电极反应产生“滴定剂”,并立即与试液中被测物质发生反应,当到达绺时由指示系统指示到达终点,停止电解。
根据法拉第定律,由电解电量求得被测物质的量。
永停终点法原理图如下:图 2永停终点法原理图在两个相同的铂电极插入试液中并加上的直流电压。
如果试液中同时存在氧化态和还原态的过逆电对(如 I-/I2),则电极上发生反应,电流通过电解池。
如果只有可逆电对的一种状态,所加的小电压不能使电极上发生反应,电解池中就没有电流通过。
当反应到达滴定终点后,试液中 I2 微过量,回路中就有电流通过,表示终点到达。
三.仪器与试剂仪器:库仑滴定仪试剂:0.1 m0l/L KI,未知 Na2S2O3 溶液。
四.实验内容在酸性介质中,0.1 mol/L KI 在铂电极上电解产生滴定剂 I2 来滴定 S2O3 , 用永停终点法指示终点,由电解电量按法拉第定律计算 S2O3 浓度。
实验操作步骤:1、连接好仪器,电解池中加入适当的溶液2、设定指示电极的直流电压约50-100mV。
3、设定指示终点的方法为“电流”“上升”法。
4、加少量 Na2S2O3溶液,预滴定。
5、加入待滴定溶液,开始滴定。
6、重复三次。
五.结果处理1.由电解电量按法拉第定律计算 S2O3 浓度。
t1=125.6s t2=125.3s t3=126.5s v=0.5mL I=1.00mAc1=0.002604M c2=0.002597M c3=0.002622M2.计算结果的标准偏差。
X=0.002602M s= 0.0002160M六.注意事项1. 电极的极性不能接错。
2. 保护管中应放 KI 溶液。
3. 每次所取试液必须准确。
七.思考题1、试说明永停终点法指示终点的原理。

Na2S2O3标准溶液(0.1 mol·L-1)的配制与标定一、实验目的1.掌握Na2S2O3标准溶液的配制方法和注意事项;2.学习使用碘瓶和正确判断淀粉指示剂指示的终点;3.了解置换碘量法的过程、原理,并掌握用基准物K2Cr2O7标定Na2S2O3溶液浓度的方法;4.练习固定重量称量法。
二、实验原理硫代硫酸钠标准溶液通常用Na2S2O3·5H2O配制,由于Na2S2O3遇酸即迅速分解产生S,配制时若水中含CO2较多,则pH偏低,容易使配制的Na2S2O3变混浊。
另外水中若有微生物也能够慢慢分解Na2S2O3。
因此,配制Na2S2O3通常用新煮沸放冷的蒸馏水,并先在水中加入少量Na2CO3,然后再把Na2S2O3溶于其中。
标定Na2S2O3溶液的基准物质有KBrO3、KIO3、K2Cr2O7等,以K2Cr2O7最常用。
标定时采用置换滴定法,使K2Cr2O7先与过量KI作用,再用欲标定浓度的Na2S2O3溶液滴定析出的I2。
第一步反应为:Cr2O72- + 14H+ + 6I- 3I2 + 2Cr3+ + 7H2O在酸度较低时此反应完成较慢,若酸度太强又有使KI被空气氧化成I2的危险,因此必须注意酸度的控制并避光放置10分钟,此反应才能定量完成。
(2KI+O2=K2O+I2K2O+CO2=K2CO3或与水与二氧化碳生成碳酸氢钾。
但是由于反应过程中有碱性物质存在碘单质多少会有一些会消耗产生其他氧化数的物质。
4KI+2H2O+O2=2I2+4KOH2KI+O2=K2O+I2 K2O+H2O=2KOH)C=O的键能比H-O的键能大,K2O与键能小的水先反应。
2KOH+CO2=K2CO3+H2OK2CO3+10H2O=K2CO3·10H2O4KI+2H2O+O2=2I2+4KOH)第二步反应为:2S2O32- + I2 S4O62- + 2I- 第一步反应析出的I2用Na2S2O3溶液滴定,以淀粉作指示剂。



硫代硫酸钠的标定实验报告实验目的:通过对硫代硫酸钠的标定实验,掌握溶液制备、酸碱滴定等实验技能,了解硫代硫酸钠的性质及其化学反应过程。
实验原理:硫代硫酸钠是一种强还原剂,可与含氧的酸性溶液反应,将其中的含氧根离子还原为水。
标定硫代硫酸钠需要先用已知浓度的酸溶液滴定,再用滴定结果反推出硫代硫酸钠的浓度。
实验步骤:1.制备0.02mol/L的盐酸溶液,用分析天平称取0.868g固体盐酸,并加入100mL的去离子水中。
2.取10mL的0.02mol/L硫代硫酸钠溶液,加入100mL锥形瓶中,并加入2滴酚酞指示剂。
3.用0.02mol/L的盐酸溶液滴定硫代硫酸钠,在滴定过程中,转移瓶中溶液时需旋转瓶口,使液面平整,直至出现粉红色的终点。
4.重复实验3次,取平均值记录。
实验结果:第一次滴定:19.76mL、19.80mL、19.79mL第二次滴定:19.80mL、19.78mL、19.76mL第三次滴定:19.79mL、19.77mL、19.81mL平均滴定值为:19.78mL实验计算:1.计算盐酸的摩尔浓度盐酸的分子量为36.46g/mol盐酸溶液的摩尔浓度为:0.02mol/L可得盐酸溶液的质量为:0.868g2.计算硫代硫酸钠的摩尔浓度盐酸和硫代硫酸钠的反应方程式为:Na2S2O3 + 2HCl → 2NaCl + SO2 ↑ + S + H2O由上式可知,每1mol的盐酸可以和1mol的硫代硫酸钠反应,计算可得硫代硫酸钠的摩尔浓度为:0.01mol/L3.计算硫代硫酸钠的质量浓度硫代硫酸钠的分子量为158.11g/mol可得硫代硫酸钠的质量浓度为:1.5811g/L实验结论:通过酸碱滴定实验测得,0.02mol/L的盐酸与硫代硫酸钠反应的平均滴定值为19.78mL,得到硫代硫酸钠的摩尔浓度为0.01mol/L,质量浓度为1.5811g/L。
此次实验结果较为准确,符合理论值。


硫代硫酸钠含量测定硫化染料不溶于水,对纤维无直接性,染色时须在碱性条件下用硫化碱(Na 2S )将其还原,使得硫化染料变成隐色体,能溶于水,才能上染纤维。
因此对硫化钠和烧碱含量的测定是非常必须的。
1.硫化钠含量测定吸取染液100mL ,放入200mL 容量瓶中,加入氯化钡—氯化钠混合液40mL (每1L 中含有氯化钡晶体及氯化钠晶体各100g ),充分摇动后使其生成沉淀,然后加水至刻度,摇匀,过滤,所用的滤纸、漏斗及烧杯必须充分干燥。
其产生的沉淀方程式如下:Na 2CO 3 + Ba(OH)2 = BaCO 3↓+ 2NaOHNa 2SO 3 + Ba(OH)2 = BaSO 3↓+ 2NaOHNa 2SO 4 + Ba(OH)2 = BaSO 4↓+ 2NaOH用移液管吸取滤液50mL ,放入250mL 烧杯中,加入10%氯化铵6~10mL ,调节pH 值,使指示剂酚酞呈微红色即可,然后用浓度为0.064mol/L 的Zn(NH 3)4SO 4溶液进行滴定,其反应方程式如下:Na 2S + Zn(NH 3)4SO 4 = ZnS ↓+ 4NH 3↑+ Na 2SO 4再用30%的亚硝基铁氰化钠[Na 2Fe(CN)5•NO •2H 2O]作外指示剂,直到杯内溶液与亚硝基铁氰化钠溶液滴在滤纸上的渗透圈相遇时,不显红紫色即为终点,记下Zn(NH 3)4SO 4溶液的体积数V 1。
则硫化钠的含量为:硫化钠含量(g/L )=20010050200078] SO )Zn(NH [4431⨯⨯⨯c V ×1000 = 0.1V 1式中:] SO )Zn(NH [443c :Zn(NH 3)4SO 4溶液的浓度,mol/L ;V 1:消耗Zn(NH 3)4SO 4溶液的体积,mL ;78:硫化钠的摩尔质量,g/L 。
Zn(NH 3)4SO 4溶液配制:精确称取结晶硫酸锌9.2032g ,溶于500mL 蒸馏水中,慢慢加入过量氨水,使生成的白色沉淀再行溶解,然后加水冲淡至1000mL 。

硫代硫酸钠的标定实验报告一、实验目的1、掌握硫代硫酸钠溶液的标定方法。
2、熟悉碘量法的基本操作和原理。
3、练习使用分析天平、移液管和容量瓶等仪器。
二、实验原理硫代硫酸钠(Na₂S₂O₃)一般为无色结晶粉末,易溶于水。
在酸性溶液中,它会迅速分解:S₂O₃²⁻+ 2H⁺= SO₂↑ +S↓ + H₂O而在中性或弱碱性溶液中,它能与碘(I₂)发生反应:2Na₂S₂O₃+ I₂= Na₂S₄O₆+ 2NaI本实验以重铬酸钾(K₂Cr₂O₇)为基准物质,与过量的碘化钾(KI)在酸性条件下反应,析出碘(I₂):K₂Cr₂O₇+ 6KI + 14HCl = 2CrCl₃+ 3I₂+ 8KCl + 7H₂O 然后用硫代硫酸钠溶液滴定析出的碘,根据消耗的硫代硫酸钠溶液的体积来计算其浓度。
三、实验仪器与试剂1、仪器分析天平50mL 酸式滴定管250mL 碘量瓶25mL 移液管250mL 容量瓶玻璃棒烧杯滴管2、试剂硫代硫酸钠(Na₂S₂O₃·5H₂O)重铬酸钾(K₂Cr₂O₇):基准试剂,在 120℃干燥至恒重碘化钾(KI)盐酸(HCl):2mol/L淀粉指示剂:5g/L四、实验步骤1、配制 01mol/L 硫代硫酸钠溶液称取约 13g 硫代硫酸钠(Na₂S₂O₃·5H₂O),溶于 500mL 新煮沸并冷却的蒸馏水中,加入约 01g 碳酸钠(Na₂CO₃),搅拌均匀,保存于棕色试剂瓶中,放置两周后进行标定。
2、配制重铬酸钾标准溶液准确称取在 120℃干燥至恒重的基准重铬酸钾 06130g 左右,置于小烧杯中,用少量水溶解后,定量转移至 250mL 容量瓶中,用水稀释至刻度,摇匀。
3、标定硫代硫酸钠溶液用 25mL 移液管准确移取 2500mL 重铬酸钾标准溶液于 250mL 碘量瓶中,加入 5mL 2mol/L 盐酸和 10mL 碘化钾溶液,摇匀,于暗处放置 5 分钟。
加入 100mL 水,用待标定的硫代硫酸钠溶液滴定至溶液呈浅黄色时,加入3mL 淀粉指示剂,继续滴定至溶液蓝色恰好消失,即为终点。
一、预习要点直接碘量法、间接碘量法原理以及方法要点。
一、目的要求熟悉硫代硫酸钠的制备原理和方法学习碘量法的基本原理、掌握碘量瓶的使用方法。
二、实验原理硫代硫酸钠的制备的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ══ Na2S2O3•5H2O反应液经脱色、过滤、浓缩结晶、过滤、干燥即得产品。
Na2S2O3•5H2O于40~45℃熔化,48℃分解,因此,在浓缩过程中要注意不能蒸发过度。
用亚硫酸钠与硫粉在沸腾条件下直接合成,其反应为:Na2SO3 + S=Na2S2O3常温下析晶为Na2S2O3·5H2O三、实验用品台天平,研钵,量筒,电磁加热搅拌器,ф60mm长颈漏斗漏斗架,定性滤纸〔ф7cm、11cm〕,蒸发皿,水浴,抽滤装置,烘箱。
分析天平,棕色瓶.,碘量瓶,碱式滴定管( 50mL,综色) ,酸碱式滴定管( 50mL,综色) 硫粉,乙醇〔95%〕,亚硫酸钠,I2,KI,硫代硫酸钠(Na2S2O3·5H2O或Na2S2O3),Na2CO3〔固〕,K2Cr2O7〔工作基准试剂〕,KI 〔固〕,H2SO4〔20%〕,淀粉指示液(10 g/L),四、实验步骤硫代硫酸钠的制备称取2g硫粉,研碎后置于100mL烧杯中,用1mL乙醇润湿,搅拌均匀,再加入6g Na2SO3,加蒸馏水30mL,放入磁子,置于磁力搅拌器上,加热至沸腾,调好转速,保持微沸40分钟以上,直至少量硫粉漂浮在液面上〔注意,假设体积小于20mL应在反应过程中适当补加些水至20~25mL 〕,趁热过滤〔应将长颈漏斗先用热水预热后过滤〕,将滤液转移至蒸发皿,用水浴加热,蒸至溶液微黄色浑浊为止。
冷却,即有大量晶体析出〔假设放置一段时间仍没有晶体析出,是形成过饱和溶液,可采用磨擦器壁或加一粒硫代硫酸钠晶体引种,破坏过饱和状态〕。
减压抽滤,并用少量乙醇〔5~10mL〕洗涤晶体,抽干,放入40℃烘箱烘40min。
硫代硫酸钠溶液的标定
硫代硫酸钠是一种有机物,在化学实验中常用于测定多种物质的含量,如氯离子、重金属离子等。
硫代硫酸钠的浓度需要通过标定才能确定,然后才能在实验中准确使用。
一、实验原理
硫代硫酸钠在酸性溶液中和锰离子反应,生成二氧化锰和硫酸,而锰离子是滴定剂。
2Mn2+ + S2O3 2- + 10H+ → 2MnO4 - + S + 5H2O
由于硫代硫酸钠溶液的正负离子比值已知,可以进一步计算出溶液的浓度。
二、实验步骤
1.准备10 ml的硫代硫酸钠溶液(浓度不低于0.1mol/L);
2.精确称称约0.2 g的硝酸钾,并加入150 ml蒸馏水中,搅拌均匀溶解;
3.取50 ml的硝酸钾溶液,加入50 ml的二甲苯作为指示剂,然后加入硫代硫酸钠溶液,滴定至溶液颜色变化为淡粉色为止,记录用去的硫代硫酸钠溶液体积,记为V1;
4.重复2-3次该操作,将不同记录处理成均值,得到溶液浓度C1。
三、结果计算
硫代硫酸钠溶液的浓度计算公式为:C = n / V。
其中,n为硫代硫酸钠的质量,V为加入的水溶液体积。
将此公式带入滴定数据计算,可得浓度。
C1 = (0.1 mol/L × V1) / 10 ml
四、注意事项
1.滴定时要进行搅拌,以充分反应;
2.硝酸钾溶液要经常检查PH值保持在酸性范围内;
3.实验过程中要注意安全,防止化学品与皮肤接触,防止误服误食化学品;
4.实验器材应彻底清洗干净,避免污染。
一、预习要点直接碘量法、间接碘量法原理以及方法要点。
一、目的要求熟悉硫代硫酸钠的制备原理和方法学习碘量法的基本原理、掌握碘量瓶的使用方法。
二、实验原理硫代硫酸钠的制备的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ══ Na2S2O3•5H2O反应液经脱色、过滤、浓缩结晶、过滤、干燥即得产品。
Na2S2O3•5H2O于40~45℃熔化,48℃分解,因此,在浓缩过程中要注意不能蒸发过度。
用亚硫酸钠与硫粉在沸腾条件下直接合成,其反应为:Na2SO3 + S=Na2S2O3常温下析晶为Na2S2O3·5H2O三、实验用品台天平,研钵,量筒,电磁加热搅拌器,ф60mm长颈漏斗漏斗架,定性滤纸〔ф7cm、11cm〕,蒸发皿,水浴,抽滤装置,烘箱。
分析天平,棕色瓶.,碘量瓶,碱式滴定管( 50mL,综色) ,酸碱式滴定管( 50mL,综色) 硫粉,乙醇〔95%〕,亚硫酸钠,I2,KI,硫代硫酸钠(Na2S2O3·5H2O或Na2S2O3),Na2CO3〔固〕,K2Cr2O7〔工作基准试剂〕,KI 〔固〕,H2SO4〔20%〕,淀粉指示液(10 g/L),四、实验步骤硫代硫酸钠的制备称取2g硫粉,研碎后置于100mL烧杯中,用1mL乙醇润湿,搅拌均匀,再加入6g Na2SO3,加蒸馏水30mL,放入磁子,置于磁力搅拌器上,加热至沸腾,调好转速,保持微沸40分钟以上,直至少量硫粉漂浮在液面上〔注意,假设体积小于20mL应在反应过程中适当补加些水至20~25mL 〕,趁热过滤〔应将长颈漏斗先用热水预热后过滤〕,将滤液转移至蒸发皿,用水浴加热,蒸至溶液微黄色浑浊为止。
冷却,即有大量晶体析出〔假设放置一段时间仍没有晶体析出,是形成过饱和溶液,可采用磨擦器壁或加一粒硫代硫酸钠晶体引种,破坏过饱和状态〕。
减压抽滤,并用少量乙醇〔5~10mL〕洗涤晶体,抽干,放入40℃烘箱烘40min。
一、预习要点直接碘量法、间接碘量法原理以及方法要点。
一、目的要求熟悉硫代硫酸钠的制备原理和方法学习碘量法的基本原理、掌握碘量瓶的使用方法。
二、实验原理硫代硫酸钠的制备的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ══ Na2S2O3•5H2O反应液经脱色、过滤、浓缩结晶、过滤、干燥即得产品。
Na2S2O3•5H2O于40~45℃熔化,48℃分解,因此,在浓缩过程中要注意不能蒸发过度。
用亚硫酸钠与硫粉在沸腾条件下直接合成,其反应为:Na2SO3 + S=Na2S2O3常温下析晶为Na2S2O3·5H2O三、实验用品台天平,研钵,量筒,电磁加热搅拌器,ф60mm长颈漏斗漏斗架,定性滤纸〔ф7cm、11cm〕,蒸发皿,水浴,抽滤装置,烘箱。
分析天平,棕色瓶.,碘量瓶,碱式滴定管( 50mL,综色) ,酸碱式滴定管( 50mL,综色) 硫粉,乙醇〔95%〕,亚硫酸钠,I2,KI,硫代硫酸钠(Na2S2O3·5H2O或Na2S2O3),Na2CO3〔固〕,K2Cr2O7〔工作基准试剂〕,KI 〔固〕,H2SO4〔20%〕,淀粉指示液(10 g/L),四、实验步骤硫代硫酸钠的制备称取2g硫粉,研碎后置于100mL烧杯中,用1mL乙醇润湿,搅拌均匀,再加入6g Na2SO3,加蒸馏水30mL,放入磁子,置于磁力搅拌器上,加热至沸腾,调好转速,保持微沸40分钟以上,直至少量硫粉漂浮在液面上〔注意,假设体积小于20mL应在反应过程中适当补加些水至20~25mL 〕,趁热过滤〔应将长颈漏斗先用热水预热后过滤〕,将滤液转移至蒸发皿,用水浴加热,蒸至溶液微黄色浑浊为止。
冷却,即有大量晶体析出〔假设放置一段时间仍没有晶体析出,是形成过饱和溶液,可采用磨擦器壁或加一粒硫代硫酸钠晶体引种,破坏过饱和状态〕。
减压抽滤,并用少量乙醇〔5~10mL〕洗涤晶体,抽干,放入40℃烘箱烘40min。