新技术申请表
- 格式:docx
- 大小:15.25 KB
- 文档页数:2

新技术、新项目申请(备案)表项目负责人签名:年月日医管中心制表附件1医疗技术分类及目录一、医疗技术分类(一)禁止类技术1.临床应用安全性、有效性不确切;2.存在重大伦理问题;3.该技术已经被临床淘汰;4.未经临床研究论证的医疗新技术。
医疗机构严禁开展国家卫生健康委发布的禁止类技术目录内的医疗技术。
(二)限制类技术1.技术难度大、风险高,对医疗机构的服务能力、人员水平有较高专业要求,需要设置限定条件的;2.需要消耗稀缺资源的;3.涉及重大伦理风险的;4.存在不合理临床应用,需要重点管理的。
(三)重点质控技术医疗技术未达到限制类技术四点情形的,但在临床应用过程中易造成医院感染暴发、严重安全事件的。
(四)其他医疗技术未纳入禁止类技术、限制类技术目录和重点质控技术目录。
二、限制类、重点质控技术分类目录(一)12项国家级限制类医疗技术目录(2022年版)G01 异基因造血干细胞移植技术G02 同种胰岛移植技术G03 同种异体运动系统结构性组织移植技术G04 同种异体角膜移植技术G05 性别重置技术G06 质子和重离子加速器放射治疗技术G07 放射性粒子植入治疗技术G08 肿瘤消融治疗技术G09 心室辅助技术G10 人工智能辅助治疗技术G11 体外膜肺氧合(ECMO)技术G12 自体器官移植技术(二)省级限制类技术目录(2019版)S1. 心血管疾病介入诊疗技术S2. 脑血管疾病介入诊疗技术S3. 骨性面部轮廓整形技术S4. 人工关节置换技术S5. 体外膜肺氧合(ECMO)技术(三)重点质控技术目录(2019版)Z1. 血液透析技术Z2. 医用高压氧治疗技术附件2:新技术、新项目分类1.禁止类技术:临床应用安全性、有效性不确切;存在重大伦理问题;该技术已经被临床淘汰;未经临床研究论证的医疗新技术。
2.限制类技术:安全性、有效性确切或不确定,技术难度大、风险高,对医疗机构的服务能力、人员水平有较高专业要求,需要设置限定条件的,涉及重大伦理风险的,或需要使用稀缺资源,按《医疗技术临床应用管理办法》要求,必须报省、市卫健委备案批准后才能开展的医疗技术项目,一般进行会议审查。

榆林市中医医院院内新技术、新项目申请表
项目名称
申请科室
申请负责人
申报日期
填写说明
一、本院内凡申请新技术、新项目临床应用的科室,均应如实
填报本表。
二、如涉及医疗器械、药品的,提供相应的批准文件。
三、申报科室应如实填写,不够可另附页。
四、本表一式两份,一份由科室留存,一份由科教科留存。
榆林市中医医院院内新技术、新项目申请表
注:如涉及医疗器械、药品的,提供相应的批准文件。
新技术、新项目
准入通知
_____科:
为了使我院新技术、新项目规范的开展,使其更加安全有效地应用于临床,根据我院新技术、新项目准入管理制度的要求,于年月日召开院学术委员会会议,对你科申报的项目进行了审核论证,经研究同意你科开展项目。
特此通知!
科教科
____年_月_日
榆林市中医医院院内新技术、新项目全程追踪管理与随访评价表
榆林市中医医院院内新技术、新项目全程追踪管理与随访评价表
榆林市中医医院
新技术、新项目转为成熟技术申请表
临床病历资料。

南康区中医院
新技术、新项目申报表
项目名称
申请科室
申报负责人
申报日期
南康区中医院制
填写说明
•本院内凡申请新技术、新项目临床应用的科室,均应如实填报本表。
•项目名称一项应填写符合ICD-10的标准化全称。
•如涉及医疗器械、药品的,提供相应的批准文件。
•申报科室应如实填写,不够可另附页。
•本表一式两份,一份由科室留存,一份由医务科留存。
六、需提供的材料
1.知情同意书。
2.国内外、省内、县内有关该项技术研究和使用情况的检索报告及技术材料。
3.如涉及医疗器械、药品的,提供相应的批准文件。
南康区中医院新技术、新项目
南康区中医院
新技术、新项目转为成熟技术申请表。

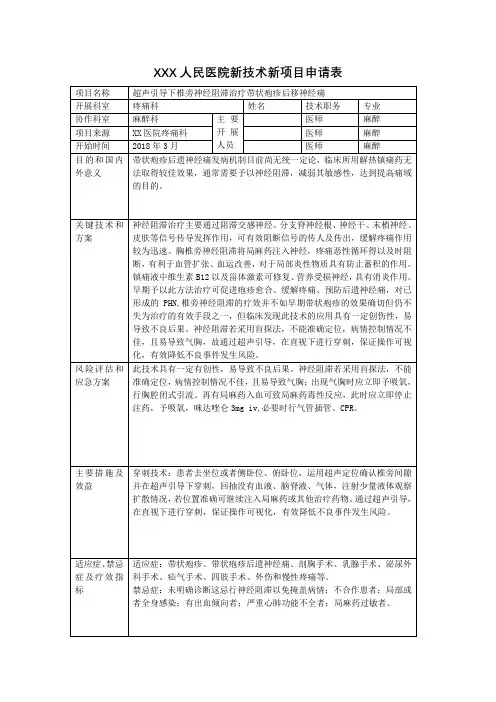
XX医院新技术、新项目开展申报表项目名称:WIDEAWAKE技术在掌骨骨折手术中的应用为15〜20ml。
2•患者取仰卧体位,患肢外展,0.2%碘伏棉球麻醉注射区皮肤3遍,以20毫升注射器抽取20毫升配比液,以7号针头在手术区最近端部位垂直皮肤刺入针头至皮下脂肪组织,注射0.5ml配比液形成皮丘,等待大约15〜30秒患者疼痛感消失,继续向深层注射到骨膜及骨间背侧肌,注入约6ml配比液,注射应避开尺神经腕背侧皮支及桡神经浅支。
注射一次完成。
第一针注射完毕5〜15分钟后,于第一个皮丘的远侧边缘以远注射,形成第二个皮丘。
以此类推,形成第三个或第四个皮丘。
注射第二至第四个皮丘不需要时间间隔,此时注射的配比液主要是为肾上腺素发挥止血作用。
注射完毕后,手术区域形成皮丘带。
皮丘带区域原则上要大于手术区域1cm。
注射完毕后15〜30分钟,此时肾上腺素达到充分止血作用。
手术区域皮肤较周围皮肤苍白发硬,此时可以进行掌骨手术。
六.疗效标准及评价方法:使用视觉模拟评分法(VAS)对术前的注射痛、术中和术后的疼痛进行评估;术中评估术区出血情况,内固定后行主动全幅手指伸屈活动试验检查内固定是否坚强,手指是否有交叉。
术后观察术区皮肤血供和麻醉并发症,并随访功能恢复情况和术后并发症。
七•我科目前具备开展此项麻醉技术所有设备及药品,且不需要麻醉师参与,术中术后不需要心电监护。
八•此项技术的引进开展无需麻醉医师,不需使用心电监护,麻醉费用大大降低,从而为患者节约了医疗开支。
局麻过程由医师操作,手术医师可以根据患者情况来决定手术时间,方便了患者,也节省了医师时间,手术对科室的整体工作流程、资源分配更合理有益。
局麻下无止血带即利多卡因和肾上腺素的联合应用,麻醉持续时间是单独应用利多卡因的两倍。
该法最大优点是无痛且出血量少,同时内固定后即可允许患者活动患手。
术者可以充分了解内固定是否坚强,是否有剪刀手畸形。
患者在术中还可以观察到患手的活动情况,利于增强患者康复的信心,早期进行术后功能锻炼,促进骨折早期愈合,减少术后并发症的发生。
新产品(新技术)鉴定申请表一、填表阐明1、本表规格为原则A4纸, 书面一式两份, 加盖企业公章,同步提供电子版。
2、新产品(新技术)名称:申请鉴定旳新产品(新技术)名称,名称应包括型号。
3、项目来源: 指项目列入国家或北京市哪一种科技计划, 未列入上述计划旳, 填“企业立项”。
4、鉴定类别: 指是“新产品”或是“新技术”。
5、研制生产单位:指承担该项目重要研制生产任务旳单位, 应写明单位全称。
二、合作单位: 有两个以上合作单位旳, 按重要次序填写。
三、研制起止时间: 指该项目开始研发旳时间及最终完毕旳时间。
四、知识产权状况:指该项目与否申请了专利;未申请专利旳, 是自主知识产权还是与其他单位共同拥有, 或是被授权使用等。
五、提供鉴定旳文献目录阐明1、申请鉴定旳企业应按目录重要提供鉴定所需旳文献材料:2、计划任务书(设计大纲): 是指立项时, 所确定旳项目目旳及实行计划。
一般应包括项目技术指标、进度安排、经费支出、人员配置等内容, 或计划任务下达单位与项目承担单位所签定旳文本。
(复印件)3、工作总结汇报: 研制工作旳计划、组织和实行状况, 重要包括: 立项背景、新产品开发概况、市场推广分析、项目研制过程中碰到旳问题及处理旳措施、经验体会等内容。
4、技术总结汇报: 重要包括: 技术方案概述、开发内容、创新点、有关技术原理和工艺流程、处理旳关键问题及所采用旳技术措施、技术指标及与国内外同类产品旳对比、研究结论、尚存技术问题及处理方案、技术成熟程度及推广应用旳条件和前景。
5、工艺审查汇报:由本单位工艺部门审核, 新产品(技术)与否符合工艺装备条件, 以确定量产能力。
6、质量检查汇报:由本单位质量管理部门审核量产质量, 以确定有无设计缺陷, 保证批产质量。
7、财务汇报(经济效益分析) *财政拨款项目需有详细旳分析:对项目旳成本、经济效益、社会效益旳分析汇报。
8、产品检测汇报: 国家或本市法定检测机构提供旳产品检测汇报, 有效期为一年。

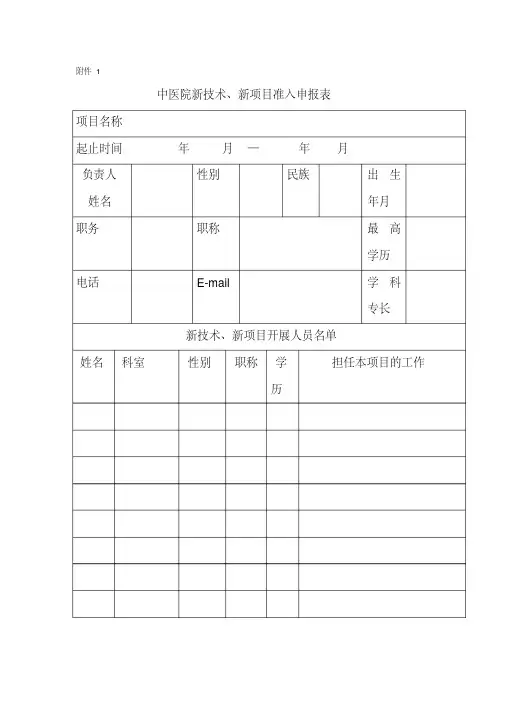
附件1中医院新技术、新项目准入申报表项目名称起止时间年月━年月负责人姓名性别民族出生年月职务职称最高学历电话E-mail 学科专长新技术、新项目开展人员名单姓名科室性别职称学历担任本项目的工作新技术分类、(自评)一类二类三类三级医院技术标准一般项目必备可选重点项目必备可选科室自立项目医院重点攻关项目该技术项目目前在国内外或其它省、市医院临床应用基本情况:临床应用意义、适应症和禁忌症:社会效益、经济效益预测:新技术、新项目的诊疗常规及操作规范:科室技术力量、人力配备和设施:新技术新项目预见的风险评估及应急处理预案:科室讨论意见:科主任签字:年月日附件2中医院新技术、新项目审批表申报科室:科主任签字:年月日项目名称:新技术、新项目准入申报表提交时间年月日院伦理委员会意见签字:年月日院学术委员会意见签字:年月日备注附件3中医院新技术、新项目年(季)度工作报告表项目名称:科室:项目负责人:科主任签字:项目开展时间:年月 --- 年月开展病例:(共计例)病历号姓名性别疾病名称有效评价①②③④⑤⑥……….科室自我评价(诊疗病例数、适应证掌握情况、临床应用效果、并发症、合并症、不良反应、随访情况、安全性、有效性等):需说明的其它问题:医院职能部门评价及后续要求:(字数不限,不够可附页)。