有色冶金概l论——钨冶金
- 格式:ppt
- 大小:828.50 KB
- 文档页数:23



钨冶金复习题钨冶金复习题钨,作为一种重要的金属材料,广泛应用于各个领域。
钨的冶金学知识对于理解其性质和应用具有重要意义。
下面将通过一些复习题,来回顾和巩固我们对钨冶金学的理解。
1. 钨的原子序数是多少?它在元素周期表中的位置是什么?钨的原子序数是74,它位于元素周期表的第6周期第6族,属于过渡金属元素。
2. 钨的晶体结构是什么?钨的晶体结构是面心立方晶体结构。
3. 钨的原子半径和离子半径分别是多少?钨的原子半径是0.137nm,离子半径为W6+是0.068nm。
4. 钨的密度是多少?钨的密度是19.3克/立方厘米。
5. 钨的熔点和沸点分别是多少?钨的熔点是3422摄氏度,沸点是5555摄氏度。
6. 钨的常见化合价是多少?钨的常见化合价是2、4、6。
7. 钨的氧化物有哪些?钨的氧化物有三氧化二钨(WO3)、二氧化钨(WO2)和一氧化钨(WO)。
8. 钨的主要矿石有哪些?钨的主要矿石有白钨矿、黑钨矿和辉钨矿。
9. 钨的提取方法有哪些?钨的提取方法主要有浮选法、重选法和冶炼法。
10. 钨的冶炼方法有哪些?钨的冶炼方法有煅烧还原法、硫酸法和碳还原法。
11. 钨的合金有哪些应用?钨的合金常用于制造切削工具、高温合金、电极材料等。
12. 钨的特殊性质有哪些?钨具有高熔点、高密度、高硬度、高熔化潜热和低蒸气压等特殊性质。
13. 钨的应用领域有哪些?钨的应用领域包括航空航天、电子工业、化工等领域。
14. 钨的氧化态对其性能有何影响?钨的氧化态对其性能有很大影响,如WO2具有导电性,WO3具有催化性能。
15. 钨的高温性能如何?钨具有优异的高温性能,能够在高温下保持较高的强度和稳定性。
通过以上复习题,我们回顾了钨的冶金学知识。
钨作为一种重要的金属材料,在各个领域都有广泛的应用。
了解钨的性质和冶金学知识,有助于我们更好地理解其应用特点和加工工艺。
希望这些复习题对大家的钨冶金学知识的巩固和提升有所帮助。



《有色冶金概论》课程标准课程代码:00531101适用专业:冶金技术学时:32学分:2开课学期:第三学期第一部分前言1.课程性质与地位现代冶金通常把金属分为黑色金属和有色金属,铁、铬、锰三种金属称为黑色金属,其余金属称为有色金属。
按有色金属的比重,化学特性,自然界的分布情况以及习惯称呼,有色金属又分为重金属、轻金属、贵金属、稀有金属和半金属五类。
《有色冶金概论》是高职冶金技术专业的一门专业基础课程。
本课程旨在让冶金技术专业学生全面了解,且并初步掌握现代工农业生产各行业较常用的十五种有色金属的物理、化学性质,矿物组成及冶金提取方法,重点培养学生的专业通识能力,是培养学生专业应用能力和冶金技术职业岗位能力的基础。
学生在学完《冶金基础化学》、《冶金制图》、《金属学及热处理》等课程的基础上,并通过认识实习后学习本课程,是后续课程《铝冶金》、《铝冶金》、《锌冶金》、《贵金属冶金技术》的基础。
2.课程的设计思路《有色冶金概论》课程是鉴于有色金属种类多、冶炼方法各异而开设的一门专业基础课。
本课程标准在设计上本着懂理论,重应用的总体思路,突出体现职业教育的技能型,应用性特色,注重培养学生的理论应用于实践的能力。
紧密结合企业岗位需求并考虑其与后续开设课程的关系进行课程内容的选取与组织。
主要介绍铜冶金、镍冶金、铅冶金、锌冶金、锡冶金、铝冶金、钨冶金、钛冶金及有色冶金中的综合回收。
鉴于我专业后续课程开设铅冶金、锌冶金、锡冶金、铝冶金,本课程重点介绍铜冶金、镍冶金、锡冶金、钨冶金和钛冶金。
在课程内容的设计上按有色冶金的种类设计10个学习单元,每个单元按金属的性质和用途、生产原料、冶炼方法、生产原理、工艺过程进行内容介绍。
本课程紧密结合生产实践,通过案例教学,启发引导教学,既发挥教师的主导作用,又充分体现学生的主体作用,充分调动学生的积极性、主动性,重在培养学生发现问题、提出问题、分析问题、解决问题的能力。
第二部分课程目标1.知识目标(1)掌握典型有色金属的物理化学性质、生产原料和冶炼方法;(2)理解典型有色金属冶炼的原理;(3)掌握典型有色金属冶炼的工艺过程;(4)了解有色冶金中有价金属的回收方法。



有色冶金概论一.目录1.绪论2 .铜冶金3 .铅冶金4 .锌冶金1.绪论1.1金属及其分类金属是可塑性、导电性及导热性良好,具有金属光泽的化学元素。
金属:黑色金属和有色金属黑色金属:铁、铬、锰有色金属:除黑色金属以外的所有金属。
分为:重金属、轻金属:贵金属、稀有金属、半金属。
重金属:铜、铅、锌、镍、钴、锡、锑、汞、镉、铋轻金属:铝、镁、钠、钾、钙、锶、钡贵金属:金、银和铂族元素(铂、铱、锇、钌、铑)稀有金属:锂、钛、锆、钒、钨、钼、镓、铟等。
半金属:硼、硅、砷、砹。
1.2冶金的概念及冶金方法分类冶金是一门研究如何经济地从矿石或其他原料中提起金属或金属化合物,并用各种加工方法制成具有一定性能的科学。
1.3冶金方法:火法冶金、湿法冶金、电冶金。
1.4主要冶金过程:干燥、焙烧、煅烧、烧结和球团、熔炼、精炼、吹炼、蒸馏、浸出、净化、水溶液电解、熔盐电解。
干燥:除去原料中的水分。
焙烧:将矿石原料或精矿置于适当的气氛下,加热至低于他们的熔点温度,发生氧化、还原或其他化学变化的冶金过程。
煅烧:将碳酸盐或氢氧化合物的矿物原料在空气中加热分解,除去二氧化碳或水分的过程。
烧结和球团:将不同粉矿均匀或造球后加热焙烧,固结成多孔块状或球状的物料。
熔炼:将处理好的矿石或其他原料,在高温下通过氧化还原反应,使矿石中的金属和杂质分离为两个液相层即金属液和熔渣过程。
精炼:进一步处理熔炼所得含有少量的粗金属,以提高其纯度。
吹炼:实质是氧化熔炼。
蒸馏:将冶炼的物料在加热的条件下,利用物料的挥发度不同,使物料中某些组分分离。
浸出:将固体物料加到液体溶剂中,使固体物料中的一种或几种有价金属溶解于溶液中。
净化:净化是用于处理浸出溶液或其他含有杂质超标的溶液,以除去溶液中杂质至达标的过程。
水溶液电解:在水溶液电解质中,插入两极,通入直流电,使水溶液电解质发生氧化-还原反应。
电解精炼和电解沉积。
熔盐电解:用熔融盐做为电解质的电解过程。
2.铜冶金铜的冶炼方法:火法炼铜和湿法炼铜火法炼铜是生产铜的主要方法。
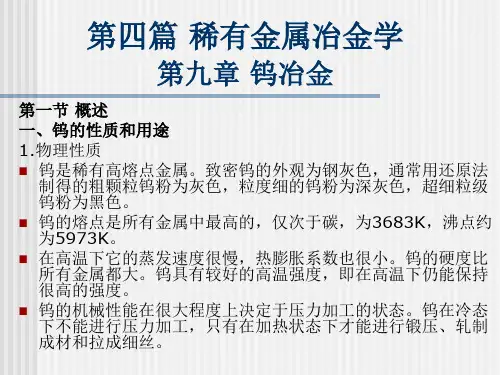

钨冶金的原理及工艺1、钨的概括钨是重要的工业原料,在冶金机械、石油化工、航空航天和国防工程等诸多领域中有着极其重要的用途,被称为战略金属之一。
钨是1781年由瑞典化学家舍勒(C.W.Scheele)在酸分解重石矿(现称白钨矿)时发现的。
从1907年在我国西华山发现钨矿以来,中国钨业已走过了100年的光辉历程,其中钨业的一个重要组成部分——钨冶金也有了近半个世纪的历史。
1958年4月前苏联援建的主张株洲601厂的正式投产,标志着我国钨冶金工业的正式诞生。
近半个世纪以来,钨冶金技术的发展大致可分为两个时期,第一时期大体上是从1958年到1981年西华山会议,这段时间主要是学习,消化,吸收前苏联的已有技术,并在生产上予以稳定和扩大;第二个时期为1981年西华山会议后到现在,西华山会议上,我国领导人发出了―振兴钨业‖的号召,同时国家在资金和政策上予以大量支持,因而全国钨业工作者发奋图强,在工艺流程改革,新技术的开发等方面都取得了长足的进步,使我国钨冶金技术的总体水平已处世界先进水平,许多技术已居世界领先地位。
产品除满足国内需求外,还向国外出口,每年出口创汇3 000多万美元(包括仲钨酸铵、蓝钨、碳化钨和硬质合金),除出口到第三世界外,还出口到美国、欧盟国家和日本等生产先进国家。
进入二十一世纪,钨冶炼更是蓬勃发展,我国钨工业已进入资源整合、战略重组与优化结构、产业升级阶段。
钨品的生产已由初级向深加工迈步,迎合我国可持续发展战略,我国钨冶炼向清洁冶金,绿色冶金方向进步。
2、钨矿物的工艺钨矿物原料主要是黑钨矿、白钨矿及混合矿。
从热力学角度分析,在水溶液中无机酸和碱都能分解钨矿物,碱金属的碳酸盐、氟化物和磷酸盐溶液亦能分解钨矿物,但考虑到动力学条件及工业上的可行性因素,实际中常用方法主要有:氟化法亦呈现出较好的发展前景,但未形成工业规模。
热球磨碱浸法流程短,以获得高的 WO3浸出率,但是,此方法为分批间歇性操作,且由于设备承受能力有限,目前未能进行大规模生产。
此文档下载后即可编辑课程教学大纲课程名称:有色金属冶金概论课程名称:Introduction to Metallurgy of Non-Ferrous Metals课程号:061899课程类型:专业课学时:36学时适用对象:冶金工程专业本科生先修课程:《冶金化工过程与设备》、《冶金热力学及动力学》、《冶金传输原理》。
一、课程的性质、目的与任务本课程是冶金工程专业本科生的专业课,为限选课;目的是使钢铁冶金专业方向的学生扩大专业面,以适应市场经济的需要。
本课程的讲授完成如下任务:了解常用有色金属的性质和用途;掌握常用有色金属冶金的主要原理、主要生产工艺。
二、课程的内容及学时分配:第一部分:绪论(建议学时数:2学时)本部分的学习目的和要求:本部分首先从课程的性质引入,讲解有色金属的分类及各种金属的所属类别,介绍有色金属提取过程的特点,对有色金属的提取方法进行归纳性总结。
通过本部分的学习,应了解各种有色金属所属的类型,熟悉有色金属的分类依据,掌握有色金属提取过程的特点。
本部分的教学内容:有色金属提取过程的特点;有色金属的提取方法。
本部分的重点和难点:有色金属提取过程的特点。
第二部分:铜冶金(建议学时数:10学时,其中包括讨论课2学时)本部分的学习目的和要求:通过对本部分的学习,学生应了解湿法炼铜的工艺;熟悉连续炼铜的工艺、基本原理;对比钢铁冶金流程,掌握火法炼铜的工艺流程及各主要单元过程的基本原理。
本部分的教学内容:本部分从铜及其主要化合物的性质、用途入手,讲授炼铜的原料,火法炼铜、湿法炼铜工艺流程、基本原理。
在火法炼铜部分,主要讲授硫化铜精矿的硫酸化焙烧和氧化焙烧的工艺、基本原理;讲授造锍熔炼的基本原理;讲授冰铜吹炼、粗铜的火法精炼、电解精炼的工艺、基本原理;讲授连续炼铜的工艺、基本原理。
简单介绍湿法炼铜部分。
本部分的重点和难点:硫化铜精矿的硫酸化焙烧和氧化焙烧的工艺、基本原理;造锍熔炼的基本原理;冰铜吹炼、粗铜的火法精炼、电解精炼的工艺、基本原理。