2019版一轮化学(鲁科版)练习:第3章 第9讲 铝及其重要化合物
- 格式:doc
- 大小:197.00 KB
- 文档页数:8


【鲁科版】2019年高考化学一轮复习:配套训练汇编目录2019年高考化学一轮复习训练(含答案):课时分层训练1 钠及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练2 氯及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练3 物质的量气体摩尔体积鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练4 物质的量在化学实验中的应用鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练5 元素与物质的分类鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练6 电解质鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练7 氧化剂和还原剂鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练8 铁及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练9 碳的多样性鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练10 氮的循环鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练11 硫的转化鲁科版2019年高考化学一轮复习训练含答案:课时分层训练12海水中的元素绿色化学与环境保护鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练13 硅无机非金属材料鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练14 铝及其化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练15 金属材料复合材料鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练16 原子结构核外电子排布鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练17 元素周期律和元素周期表鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练18 化学键鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练19 化学反应的热效应鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练20 电能转化为化学能——电解鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练21 化学能转化为电能——电池鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练22 化学反应的方向、限度鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练23 化学平衡状态和平衡移动鲁科版2019年高考化学一轮复习训练含答案:课时分层训练24 化学反应的速率化学反应条件鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练25 水溶液酸碱中和滴定鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练26 弱电解质的电离鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练27 盐类的水解鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练28 沉淀溶解平衡鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练29 认识有机化合物重要的烃鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练30 饮食中的有机化合物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练31 化学实验仪器和基本操作鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练32 物质的分离、提纯和检验鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练33 化学实验方案的设计与评价鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练34 有机物的结构、分类与命名鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练35 烃和卤代烃鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练36 烃的含氧衍生物鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练37 基本营养物质有机合成鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练38 原子结构鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练39 化学键与分子间作用力鲁科版2019年高考化学一轮复习训练(含答案):课时分层训练40 物质的聚集状态与物质性质鲁科版2019年高考化学一轮复习训练(含答案):专题突破训练(一)气体的制法及其性质探究鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(二)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(三)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(四)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(五)化学工艺流程试题的突破方略鲁科版2019年高考化学一轮复习训练含答案:专题突破训练(六)化学工艺流程试题的突破方略鲁科版专题突破训练(一) 气体的制法及其性质探究1.根据侯氏制碱原理制备少量NaHCO 3的实验,经过制取氨气、制取NaHCO 3、分离NaHCO 3、干燥NaHCO 3四个步骤。

4。
2《铝及其化合物》课时训练(时间:60分钟分值:100分)一、选择题(本大题共10小题,每小题5分,共50分)1.下列有关金属铝及其化合物的叙述正确的是( )A.铝在冷的浓H2SO4或浓HNO3中不发生化学反应B.铝既能与酸反应,又能与碱反应,因此铝是两性金属C.工业上制取铝是通过H2还原Al2O3得到D.铝粉在氧气中剧烈燃烧并产生耀眼的白光【答案】D2.在可以溶解氧化铝的溶液中,一定能大量共存的离子组是()A.NH错误!、Na+、S2-、SO错误!B.K+、[Al(OH)4]-、I-、SO错误!C.Ca2+、Fe2+、NO错误!、Br-D.Na+、K+、Cl-、SO错误!【解析】可以溶解氧化铝的溶液可能呈强碱性或强酸性。
A 项强碱性NH错误!不能存在,强酸性条件下S2-与SO错误!不能共存;B 项强酸性条件下[Al(OH)4]-不能大量存在;C项强酸性条件下Fe2+与NO-,3不能共存,强碱性条件下Ca2+、Fe2+不能存在。
【答案】D3.(2013届福建安溪、养正、惠安三校联考)在FeCl2和AlCl3的混合溶液中加入过量的Na2O2,直至溶液中沉淀的量不再改变为止。
过滤、洗涤,然后将所得沉淀干燥、灼烧,最终剩余固体的成分是( )A.Fe2O3、Al2O3B.Fe2O3C.Fe(OH)2、Al(OH)3D.Fe(OH)3、Al(OH)3【解析】因为Na2O2溶于水有氢氧化钠生成且Na2O2有强氧化性,所以最终生成的沉淀是Fe(OH)3,Fe(OH)3不稳定,灼烧时分解生成Fe2O3,故B项正确。
【答案】B4.下列各种物质既能与强酸溶液反应又能与强碱溶液反应的是()①Al②AlCl3③Na[Al(OH)4] ④Al(OH)3⑤Al2O3⑥NaHCO3A.①②③④⑤⑥B.①③④⑤C.④⑤D.①④⑤⑥【解析】“√”表示能反应,“×”表示不反应5.(2013届新泰一中质检)下列离子方程式正确的是( )A.铝与NaOH溶液反应:Al+6OH-===[Al(OH)4]-+H2↑B.向AlCl3溶液中滴入过量氨水:Al3++4NH3·H2O===[Al (OH)4]-+4NH错误!C.Al2O3与NaOH溶液反应:Al2O3+2OH-+3H2O===2[Al (OH)4]-D.Ba(OH)2溶液与明矾溶液反应至Al3+完全沉淀:Ba2++3OH -+Al3++SO错误!===Al(OH)3↓+BaSO4↓【解析】A中铝与NaOH溶液反应的离子方程式为:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑;B中AlCl3溶液与氨水反应后生成的Al(OH)3不溶于氨水;D中当Al3+完全沉淀时,离子方程式为:2Al3++3SO2-4+6OH-+3Ba2+===2Al(OH)3↓+3BaSO4↓。

课时规范练14铝及其重要化合物一、选择题(本大题包括10小题,每小题5分,共50分。
每小题只有一个选项符合题目要求)2.(2017湖北荆州测试)金属及其化合物转化关系是化学学习的重要内容之一。
下列各组物质的转化关系中不全部是通过一步反应即可完成的是()A.Na→NaOH→Na2CO3→NaClB.Fe→FeCl3→Fe(OH)3→Fe2O3C.Mg→MgCl2→Mg(OH)2→MgSO4D.Al→Al2O3→Al(OH)3→AlCl3〚导学号36730148〛3.下列叙述正确的是()A.向氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3·3H2O Al(OH)3↓+3N H4+B.存在于污水中的重金属离子,常用加入明矾等电解质的方法进行处理C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液D.依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O34.易拉罐的主要成分为铝合金,其中以铝铁合金和镁铝合金最为常见。
现取几小块易拉罐碎片进行5.(2017山东潍坊一中检测)用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭。
发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是()A.导致易拉罐变瘪的离子反应是CO2+OH-HC O3-B.导致易拉罐又鼓起来的反应是Al3++3HC O3-Al(OH)3↓+3CO2↑C.上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象6.(2017四川成都双流中学月考)下列说法中不正确的是(设N A表示阿伏加德罗常数的值)()A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解C.足量的Cu与含2 mol H2SO4的浓硫酸充分反应可生成N A个SO2分子D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性7.氧化亚铁粉末和铝粉配成铝热剂,分成两等份。
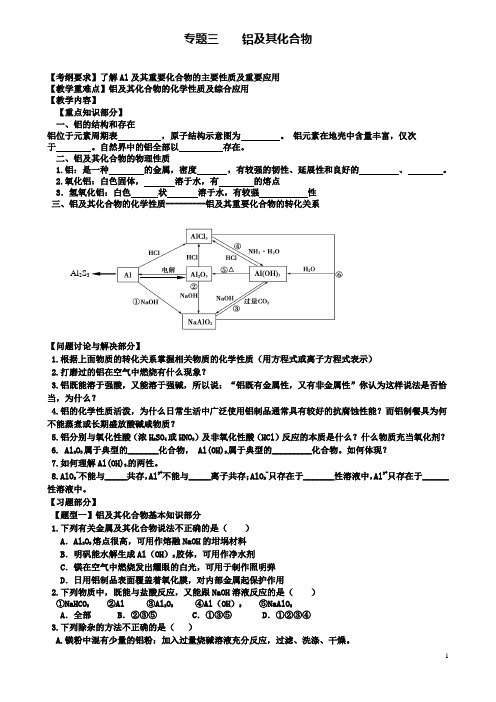
专题三铝及其化合物【考纲要求】了解Al及其重要化合物的主要性质及重要应用【教学重难点】铝及其化合物的化学性质及综合应用【教学内容】【重点知识部分】一、铝的结构和存在铝位于元素周期表,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于。
自然界中的铝全部以存在。
二、铝及其化合物的物理性质1.铝:是一种的金属,密度,有较强的韧性、延展性和良好的、。
2.氧化铝:白色固体,溶于水,有的熔点3.氢氧化铝:白色状溶于水,有较强性三、铝及其化合物的化学性质---------铝及其重要化合物的转化关系Al2S3【问题讨论与解决部分】1.根据上面物质的转化关系掌握相关物质的化学性质(用方程式或离子方程式表示)2.打磨过的铝在空气中燃烧有什么现象?3.铝既能溶于强酸,又能溶于强碱,所以说:“铝既有金属性,又有非金属性”你认为这样说法是否恰当,为什么?4.铝的化学性质活泼,为什么日常生活中广泛使用铝制品通常具有较好的抗腐蚀性能?而铝制餐具为何不能蒸煮或长期盛放酸碱咸物质?5.铝分别与氧化性酸(浓H2SO4或HNO3)及非氧化性酸(HCl)反应的本质是什么?什么物质充当氧化剂?6. Al2O3属于典型的_______化合物, Al(OH)3属于典型的_________化合物。
如何体现?7.如何理解Al(OH)3的两性。
8.AlO2-不能与_____共存,Al3+不能与_____离子共存;AlO2-只存在于_______性溶液中,Al3+只存在于______性溶液中。
【习题部分】【题型一】铝及其化合物基本知识部分1.下列有关金属及其化合物说法不正确的是()A.Al2O3熔点很高,可用作熔融NaOH的坩埚材料B.明矾能水解生成Al(OH)3胶体,可用作净水剂C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用2.下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的是()①NaHCO3 ②Al ③Al2O3④Al(OH)3⑤N aAlO2A.全部 B.②③⑤ C.①③⑤ D.①②③④3.下列除杂的方法不正确的是()A.镁粉中混有少量的铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥。

考点一 铝的性质及应用1.铝的原子结构与物理性质[注意] 铝是地壳中含量最高的金属元素。
2.铝的化学性质写出图中标号反应的化学方程式或离子方程式:④2Al +2OH -+6H 2O===2[Al(OH)4]-+3H 2 ⑤2Al +Fe 2O 3高温,2Fe +Al 2O 3(铝热反应)3.铝的制备及用途4.铝与酸或碱反应生成H 2的量的关系 (1)铝与酸或碱反应中的比例关系(2)铝与酸、碱反应的规律分析①等质量的铝与足量的盐酸、氢氧化钠溶液分别反应: a .生成H 2的物质的量之比为1∶1。
b .消耗H +、OH -的物质的量之比为n (H +)∶n (OH -)=3∶1。
②足量的铝分别与等物质的量的HCl 和NaOH 反应: a .生成H 2的物质的量之比为1∶3。
b .消耗Al 的物质的量之比为1∶3。
③一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应: 若产生氢气的体积比为13<V HCl (H 2)V NaOH (H 2)<1,则必定a .铝与盐酸反应时,铝过量而HCl 不足。
b .铝与氢氧化钠溶液反应时,铝不足而NaOH 过量。
[题点全练]题点(一) 铝的性质及应用1.常温下可用铝质容器储运的试剂是( ) A .浓硝酸 B .食醋 C .石灰水D .稀盐酸解析:选A 常温下,Al 和浓硝酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,所以可以用铝制容器储运浓硝酸,故A 正确;食醋显酸性能与铝质容器反应,故B 错误;石灰水呈碱性,Al 能溶于强碱溶液,所以不能盛放石灰水,故C 错误;Al 和稀盐酸反应生成氯化铝和氢气,所以不能盛放稀盐酸,故D错误。
2.下列说法正确的是()A.用坩埚钳夹住一小块经砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来B.Al、盐酸、NaOH溶液三者之间两两均能发生反应C.铝与Fe2O3发生铝热反应后固体物质增重D.常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完解析:选B加热时,因为铝箔表面生成Al2O3,且Al2O3的熔点很高,把熔化的液态铝包裹在里面,不会滴落下来,A错误;Al既能与强酸反应又能与强碱反应,B正确;铝与Fe2O3发生铝热反应生成Al2O3和铁,固体质量不会增加,C错误;常温下,铝在浓HNO3中“钝化”,D错误。
2020版导与练高考化学一轮复习习题:第三章金属及其化合物第9讲铝、镁及其重要化合物附答案解析2020版导与练高考化学一轮复习习题第9讲铝、镁及其重要化合物课时集训测控导航表知识点镁、铝的性质及用途铝的重要化合物的性质铝三角及图像分析基础1,2,534能力67,98,10挑战12111.(2019·山东临沂月考)近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。
假如铝作为一种普遍使用的新型能源开发利用,关于其有利因素的说法错误的是( D )A.铝质轻,便于运输、贮存,且安全B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制C.在地球上,铝矿资源比较丰富D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础解析:作为新能源,要求含量丰富(铝元素在地壳中含量占第三位),便于运输、贮存,且安全,燃烧放出能量高,能重复使用,对环境污染小,因此A、B、C 说法正确,电解铝消耗大量的电能,故选项D说法错误。
2.(2019·山东临沂月考)镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。
工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO、③2Ar、④H、⑤N,其中可作为冷却气体的是( C )2 2A.①和②B.②和③C.③和④D.④和⑤解析:点燃或高温条件下Mg与O、CO、N均反应,故不能在这些气体中冷却,2 2 2故选C。
3.下列有关说法中不正确的是( C )A.Al(OH)在用于治疗胃酸过多类疾病时表现出弱碱性3B.明矾溶于水后可得到少量的有强吸附性的Al(OH),故明矾可作净水剂3C.Al(OH)可用于中和馒头制作过程(如发酵阶段)中产生的酸3D.Al O可用于制作耐火材料而Al(OH)不能2 3 3解析:治疗胃酸过多时要消耗胃中的酸,因此Al(OH)表现弱碱性,A 项正3确;Al(OH) 有强吸附性,能吸附水中悬浮的杂质并最终转化为沉淀而使水变3澄清,B项正确;馒头制作过程中加小苏打用于发泡和中和酸,不用Al(OH),C3项不正确;耐火材料本身应对热稳定且熔点很高,而Al(OH)受热易分解,D项3正确。
第9讲 铝、镁及其重要化合物考纲要求 1.掌握铝、镁及其重要化合物的主要性质及其应用。
2.了解铝、镁及其重要化合物的制备方法。
考点一 铝、镁的性质及应用1.铝的结构和存在铝位于元素周期表第3周期ⅢA 族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
④________________________________________________________________________。
答案 ①4Al +3O 2=====△2Al 2O 3 ②2Al +Fe 2O 3=====高温2Fe +Al 2O 3 ③2Al +6H +===2Al 3++3H 2↑④2Al +2OH -+6H 2O===2[Al(OH)4]-+3H 2↑4.铝热实验中的有关问题5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
6.对比记忆镁的化学性质(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)冶炼铝时常用焦炭做还原剂()(4)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()(5)相同质量的镁条分别在足量的CO2和O2中完全燃烧,所得固体的质量相同()(6)工业上制造镁粉时,可将镁蒸气在N2中冷却()答案(1)×(2)×(3)×(4)×(5)×(6)×1.依据Al单质的性质,思考回答下列问题:(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较强的抗腐蚀性能?(2)Al既能溶于强酸,又能溶于强碱,有人说“Al既有金属性,又有非金属性”,你认为这种说法是否恰当?为什么?(3)铝与氢氧化钠溶液反应时,反应机理是怎样的?请用双线桥法标出该反应电子转移的方向与数目。
(通用版)2019版高考化学微一轮复习 第9讲 铝及其重要的化合物微课时练一、选择题1.下列有关铝的化合物的说法正确的是( )A .氧化铝坩埚可用于熔融NaOH 实验B .工业上利用电解熔融氯化铝冶炼铝C .氢氧化铝能中和胃酸,可用于治疗胃酸过多D .明矾可用于自来水的消毒解析:氧化铝能与NaOH 反应,氧化铝坩埚不能用于熔融NaOH 实验,A 错误;工业上利用电解熔融氧化铝冶炼铝,B 错误;明矾用于自来水的净化而不能用于自来水的消毒,D 错误。
答案:C2.下列各组物质的稀溶液相互反应,无论是前者滴入后者还是后者滴入前者,反应现象相同的是( )A .AlCl 3和NaOHB .硫酸铝和浓氨水C .NaAlO 2和H 2SO 4D .氨水和AgNO 3溶液解析:AlCl 3溶液滴入NaOH 溶液中,起始无沉淀,后有沉淀产生,反之起始有沉淀产生后沉淀溶解;硫酸铝溶液滴入氨水与氨水滴入硫酸铝溶液中现象一样,均为产生沉淀;NaAlO 2 溶液滴入H 2SO 4中起始无沉淀,后有沉淀产生,反之起始有沉淀产生后沉淀溶解;AgNO 3溶液滴入氨水中,起始无沉淀,后有沉淀产生,反之起始有沉淀产生后沉淀溶解。
答案:B3.(2018·黑龙江哈尔滨统考)如图是铝热反应(2Al +Fe 2O 3=====高温Al 2O 3+2Fe)的实验装置,有关该反应的下列说法中正确的是( )A .a 为镁条B .b 为氧化铁与铝粉混合物C .2 mol 氧化剂参与反应转移电子6N A 个D .还原剂与氧化产物的物质的量之比为1∶2解析:a为镁条,起引燃作用,A正确;b为KClO3,B错误;该反应中氧化剂是Fe2O3,2 mol Fe2O3参与反应转移电子12N A个,C错误;该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,D错误。
答案:A4.(2018·甘肃一诊)下列各组物质相互反应后,最终没有白色沉淀生成的是( )A.过量Ba(OH)2溶液加入明矾溶液B.过氧化钠投入FeCl2溶液中C.向NaAlO2溶液中通入过量CO2D.向饱和Na2CO3溶液中通入过量CO2解析:A中最终只有白色BaSO4沉淀;B中Na2O2投入FeCl2溶液中最终生成红褐色的Fe(OH)3沉淀;C中生成白色 Al(OH)3沉淀;D中向饱和Na2CO3溶液中通入过量CO2,发生反应Na2CO3+H2O+CO2===2NaHCO3,有NaHCO3析出。
课时作业
1.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是()
A.稀硝酸B.稀盐酸
C.硝酸铜D.氢氧化钠
答案:C
2.下列关于铝及其化合物的叙述正确的是()
A.铝罐可久盛食醋
B.铝与Fe2O3发生铝热反应,反应后固体物质增重
C.氢氧化铝可作胃酸的中和剂
D.明矾用作净水剂不涉及化学变化
解析:食醋中含有醋酸,能与铝及氧化铝反应,因此铝罐不可久盛食醋,A错误;铝与氧化铁发生铝热反应生成氧化铝和铁,根据质量守恒定律可知反应后固体质量不变,B错误;氢氧化铝能与盐酸反应,可作胃酸的中和剂,C正确;明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,用于净水,涉及化学变化,D错误。
答案:C
3.下列物质的制备方法正确的是()
A.氯化铝溶液和硫化钠溶液反应制备Al2S3
B.用镁粉和空气反应制备Mg3N2
C.用铝粉和MnO2制得锰
D.用电解熔融氯化铝的方法制得单质铝
解析:硫化钠和氯化铝溶液反应,硫离子和铝离子发生双水解反应生成氢氧化铝沉淀和硫化氢,A错误;镁粉在空气中和氧气也反应,会生成氧化镁,B错误;铝热法可冶炼锰,C正确;氯化铝属于分子晶体,熔融状态下不导电,工业上常用电解熔融的氧化铝来冶炼铝,D错误。
答案:C
4.某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是()
A.K+、Na+、HCO-3、NO-3
B.Na+、SO2-4、Cl-、S2-
C.NH+4、Mg2+、SO2-4、NO-3
D.H+、K+、Cl-、Na+
解析:能溶解Al(OH)3和Al,而不能溶解Fe的溶液只能是强碱溶液,A项中的HCO-3,C项中的NH+4、Mg2+,D项中的H+都不能在强碱溶液中大量存在。
答案:B
5.(2017·河北武邑中学二调)在铝制易拉罐中收集满CO2,加入过量的NaOH溶液,立即封口并振荡,可以发现易拉罐先咔咔作响,变瘪,然后再次鼓起来,其过程中没有涉及的化学反应是()
A.Al(OH)3分解B.CO2+OH-
C.Al+OH-+H2O D.Al2O3+OH-
解析:NaOH溶液先与CO2反应,气压减小,易拉罐变瘪;再与铝表面的Al2O3反应,最后与Al反应,生成H2,易拉罐变鼓。
综上所述,应选A。
答案:A
6.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
() ①加盐酸溶解②加烧碱溶液溶解③过滤④通入过量CO2生成Al(OH)3沉淀⑤加入盐酸生成Al (OH)3沉淀⑥加入过量烧碱溶液
A.①⑥⑤③B.②③④③
C.②③⑤③D.①③⑤③
解析:若先用盐酸溶解,Mg、Al均溶解,制取Al(OH)3的步骤较多;从NaAlO2制备Al(OH)3,若加盐酸不容易控制量的多少。
故B项操作步骤为最佳顺序。
答案:B
7.相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是()
A.Al B.Al(OH)3
C.AlCl3D.Al2O3。