基础化学实验技术绿色化教程(林宝凤等编著)思维导图
- 格式:xmin
- 大小:6.81 KB
- 文档页数:1


====Word 行业资料分享--可编辑版本--双击可删====
源-于-网-络-收-集
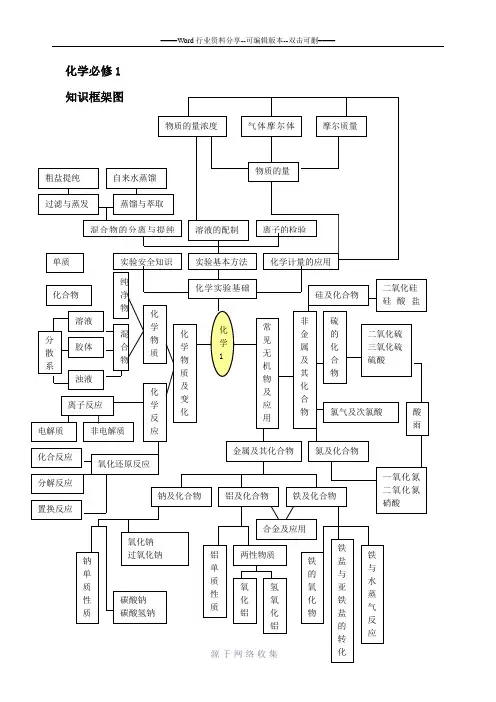
化学必修1 知识框架图
化学1
化学实验基础
实验基本方法 实验安全知识 化学计量的应用
溶液的配制
混合物的分离与提纯离子的检验
过滤与蒸发
蒸馏与萃取
粗盐提纯 自来水蒸馏 物质的量浓度
气体摩尔体
物质的量
摩尔质量
化学物质及变化
常见无机物及 应用
金属及其化合物
非金属及其化合物
钠及化合物
铝及化合物 铁及化合物
合金及应用
钠单质性质
氧化钠 过氧化钠
碳酸钠 碳酸氢钠
铝单质性质
两性物质
氧化铝
氢氧化铝
铁的氧化物
铁盐与亚铁盐的转化
铁与水蒸气反应
化学物质
化学反应
纯净物 混合物
单质 化合物
溶液
胶体
浊液 分散系
离子反应
氧化还原反应
电解质 非电解质
化合反应 分解反应
置换反应
二氧化硅 硅酸盐
硅及化合物 硫的化合物
氮及化合物
二氧化硫 三氧化硫 硫酸
一氧化氮二氧化氮硝酸
氯气及次氯酸
酸雨。

高中化学基础知识网络图完整版Revised on November 25, 2020高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)和化学平衡第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。




初中化学各单元课标要求及思维导图第一单元:走进化学世界本单元主要介绍化学变化的基本特征和化学反应的本质,以及基本的实验操作和化学品的使用意识。
化学是一门研究物质变化的科学,化学变化的基本特征包括原子结构的改变、化学键的断裂和形成、能量的释放或吸收等。
化学反应的本质是物质的转化,不同的反应会产生不同的物质,如酸碱反应、氧化还原反应等。
在实验操作中,学生需要学会简单的仪器使用和连接、加热等基本操作,并能在教师的指导下选择实验药品和仪器,并安全操作。
同时,也需要形成正确、合理地使用化学品的意识,保障自身和他人的安全。
第二单元:我们周围的空气本单元主要介绍空气的主要成分、氧气的性质和用途,以及大气、水、土壤污染物的来源和危害等。
空气是由氮气、氧气、二氧化碳等多种气体组成的,其中氧气是人类生命活动必需的气体。
氧气能跟许多物质发生氧化反应,如燃烧、腐蚀等。
在实验中,可以通过模仿操作来制取氧气。
此外,本单元还介绍了催化剂对化学反应的重要作用,以及常见的化合反应、分解反应、置换反应和复分解反应等。
学生需要能够利用这些反应解释日常生活中的一些化学现象。
同时,本单元也介绍了典型的大气、水、土壤污染物的来源及危害,以及化学在环境监测与环境保护中的重要作用。
学生需要形成保护环境的意识,为环境保护贡献自己的力量。
第三单元:物质构成的奥秘本单元主要介绍物质的微粒性和构成物质的微粒,以及原子、分子、离子等的性质和作用。
物质是由微粒构成的,其中分子、原子、离子等都是构成物质的微粒。
学生需要能够用微粒的观点解释某些常见的现象,并了解原子是由原子核和核外电子构成的,核外电子在化学反应中的作用等。
此外,本单元还介绍了氢、碳、氧、氮等与人类关系密切的常见元素,以及元素的分类和周期表等。
学生需要能够根据原子序数在元素周期表中找到指定的元素,并形成“化学变化过程中元素不变”的观念。
第四单元:自然界的水本单元主要介绍水的组成、净化方法、水对生命活动的重要意义,以及保护水资源和节约用水的意识。
初中化学知识点导图课 题初中化学思维导图法教学目的1、 了解初中化学的知识框架。
教学内容一、基本概念•元素溶液基本概念与原理 元 素 化学用语物质性质物质变化化学式的计算化学方程式的计算溶液的计算初中知识模块 化学计算化学实验常用仪器的使用实验基本操作 气体的制取物质的鉴别常见化学物质物质的分类 空 气氧 气 水氢 气 铁碳及其化合物初中知识模块地壳中元素的质量分数一、基本概念•化学用语构成构成分成宏观描述 微观描述元 素 单 质物 质化合物分子是保持物质化学性质的一种微粒 原子是化学变化中的最小微粒离子是带电荷的原子或原子团一、基本概念•溶液决定按热效应分按物种变化分按得氧失氧分氧化反应还原反应吸热反应放热反应化合反应分解反应置换反应复分解反应物质性质物理性质化学性质 物质变化物理变化化学变化 (化学反应) 一、基本概念•物质性质与变化化学用语相对原子质量以C12原子质量的1/12为标准,求得的比值 元素符号 表示一种元素 表示一种原子离子符号 Na +、Mg 2+、Al 3+、OH 、SO 42、NO 3式量化学式中各原子相对原子质量之和 化学式用元素符号表示物质组成的式子 化学方程式用化学式表示化学反应的式子化合价一个原子得失电子或形成共用电子对的数目书写化学式氧化还原反应 置换反应化合反应分解反应复分解反应氧化还原反应与二、常见化学物质•物质的分类按溶质多少分按一定条件下能否再溶分不饱和溶液 饱和溶液 浓溶液稀溶液溶解度气体溶解度固体溶解度(S ) S=()()m m 溶质溶剂×100% 结晶溶解晶体潮解结晶水合物风化分类溶质溶剂组成特征:均一性、稳定性溶液酸碱度的表示方法溶质质量百分数体积比浓度组成的表示方法溶 液无机物氧化物酸碱盐金属氧化物非金属氧化物酸性氧化物碱性氧化物含氧酸无氧酸一元酸二元酸三元酸可溶性碱难溶性碱一元碱二元碱三元碱含氧酸盐无氧酸盐正盐酸式盐碱式盐物质的分类纯净物由一种物质组成或由同种分子组成混合物由多种物质组成或由不同种分子组成单质同种元素组成的纯净物化合物不同种元素组成的纯净物金属单质非金属单质稀有气体单质根据含碳元素的情况有机物无机物二、常见化学物质•空气和氧气二、常见化学物质•水和氢气氧气的制法实验室制法工业制法:空气−−−→液化分离氧气 原理:2KClO 3 加 热 2KCl+3O 2↑2KMnO 4 加 热 K 2MnO 4+MnO 2+O 2↑制气装置收集方法检验:带火星木条伸入集气瓶内,木条复燃验满:带火星木条接近集气瓶口检验固体∆−−→气体液化蒸发存在空气 成分 大气污染物 防治大气污染氧气物理性质化学性质用途制法氧化反应缓慢氧化剧烈氧化平静燃烧急速燃烧自燃氢气H2性质制法化学性质可燃性:2H2+O2点燃2H2O还原性:H2+CuO加热Cu+H2O物理性质工业制法:(水煤气法)C+H2O高温H2+CO实验室制法原理:Zn+H2SO4=ZnSO4+H2↑Zn+2HCl=ZnCl2+H2↑收集方法:1、排水法2、向下排空气法用途用时先验纯,防止点燃爆炸决定决定水H2O水和人类的关系水的污染源:工业三废、生活污水、农药、化肥流入江河物理性质水的电解节水、爱水防治水污染2H2O通电2H2+O2↑一个水分子是由两个氢原子和一个氧原子组成水是由氢氧两种元素组成结论原理通电点燃用途二、常见化学物质•碳二、常见化学物质•金属活动顺序CO 2制法用途:灭火、工业原料实验室制法: CaCO 3+2HCl = CaCl 2+CO 2↑+H 2O工业制法:CaCO 3高温CaO+CO 2↑碳酸钙阴离子 阳离子 OH NO 3 Cl SO 42 CO 32 PO 43 H + 溶、挥 溶、挥 溶 溶、挥 溶 NH 4+ 溶、挥 溶 溶 溶 溶 溶 K +溶 溶 溶 溶 溶 溶 Na + 溶 溶 溶 溶 溶 溶 Ba 2+ 溶 溶 溶 不 不 不 Ca 2+ 微 溶 溶 微 不 不 Mg 2+ 不 溶 溶 溶 微 不 Al 3+ 不 溶 溶 溶 — 不 Mn 2+ 不 溶 溶 溶 不 不 Zn 2+ 不 溶 溶 溶 不 不 Fe 2+ 不 溶 溶 溶 不 不 Fe 3+ 不 溶 溶 溶 — 不 Cu 2+ 不 溶 溶 溶 不 不 Hg 2+ — 溶 溶 溶 不 不 Ag +—溶不微不不新碱和新盐新碱和新盐两种新盐盐和水盐新金属和新盐盐和氢气∆−−−→分解金属非金属碱性 氧化物酸性 氧化物碱酸盐盐O 2 水O 2水二、常见化学物质•酸碱盐部分酸、碱、盐的溶解性表化学实验对比记忆O 2:带火星木条复燃H 2:点燃,干冷烧杯罩在火焰上方,有无色液滴生成 CO 2:澄清石灰水变浑浊碳酸盐:与稀盐酸产生无色气体,气体通入澄清石灰水变混浊酸溶液:紫色石蕊变红,酚酞不变色,pH<7; 碱溶液:紫色石蕊变蓝,酚酞变红,pH>7;盐酸:与AgNO 3溶液反应,白色沉淀;硫酸:与BaCl 2溶液反应,白色沉淀;沉淀均不溶于稀硝酸。
化学·必修2(人教版)1.短周期金属元素甲~戊在元素周期表中的相对位置如右图所示:下面判断正确的是( )A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙解析:同周期从左到右原子半径逐渐减小,金属性逐渐减弱,其氢氧化物碱性逐渐减弱,故A项错,C项正确;同主族从上到下金属性逐渐增强,故B项错;同周期最外层电子数逐渐增大,故D项错。
答案:C2.(双选题)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应解析:甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,该氢化物应为NH3,则乙是N,甲是H;甲、乙、丙、丁的原子序数依次增大,且都是短周期元素,甲和丙同主族,则丙为Na,丁的最外层电子数和电子层数相等,则丁为Al。
综上所述B错,单质的还原性:丙>丁>甲;C错,丙的氧化物是氧化钠和过氧化钠,它们都是离子化合物。
答案:AD3.下表是元素周期表的一部分,有关说法正确的是( )A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:周期表中主要从金属性和非金属性递变推及到物质性质的递变。
答案:D4.(2018·广东高考)(双选题)元素R、X、T、Z、Q在元素周期表中的相对位置如下图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是( )A.非金属性:Z<T<XB.R与Q的电子数相差26C.气态氢化物稳定性:R<T<QD.最高价氧化物的水化物的酸性:T>Q解析:R单质在暗处与H2A项错,非金属性Cl>S,而且Ar是稀有气体,没有非金属性;B项错,F跟Br原子核外电子数相差18;C项错,气态氢化物HF>HCl>HBr;D项正确,Cl非金属性比Br强。