初三化学溶解度曲线
- 格式:docx
- 大小:1.03 MB
- 文档页数:8


1点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的方法。
3交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐;极少数物质溶解度随温度升高反而减小,如氢氧化钙。
查看更多本站专题
百科词条:初三化学化学知识点溶解度
相关推荐
备考2012:溶液、溶解度、溶质知识初中化学溶液知识点汇总大全初三化学:溶液、溶解度知识点梳理名师总结中考化学《溶液》三大考点全面初中化学基础知识总结:物质的溶解性2010中考化学复习高效课堂第5讲溶初三化学溶液浓稀的表示2 精品教案初三化学沪教版溶液组成表示基础练习题初三化学溶液浓稀的表示4精品教案初三化学溶液浓稀的表示3精品教案
分享到:
qq空间
新浪微博
百度搜藏
人人网
·课件教案
·电子教材下载
·2012中考试题
·历年中考成绩查询
·中考作文点评
·中考满分作文
·高分经验交流
·历年中考分数线。


期末冲刺易错点:溶解度曲线一、教师期末备考建议溶解度曲线这个知识点是考试中的热点,经常以选择题、填空题或者信息阅读题的形式出现,分值一般是2~6分,而考查的内容主要是对于溶解度曲线的应用。
溶解度曲线的信息量非常大,想要熟练掌握溶解度曲线的应用,就必须先熟练掌握溶解度的概念,了解溶解度曲线的意义。
此外,溶解度曲线的应用主要是在以下的几个方面:(1)查找某种物质某一温度下的溶解度(2)比较不同固体物质在同一温度下的溶解度的大小(3)确定温度对于溶解度的影响状况(4)根据溶解度曲线确定如何配制饱和溶液(5)确定混合物的分离、提纯的方法。
所以在复习的时候可以重点从这几个方面着手,勤加练习,加深理解,熟练掌握。
二、期末易错知识点1.溶解度曲线的意义溶解度曲线表示的是某一物质溶解度随温度变化的情况。
曲线上的点代表在该物质在某温度下的溶解度,其溶液必然是饱和溶液,曲线下方的点代表不饱和溶液,而在曲线上方的点,则代表有未溶解固体的饱和溶液。
当有多条曲线时,出现交叉点,则表示这些溶质在同一温度下具有相同的溶解度。
2.溶解度坐标内点的移动基本原则:温度升高向右平移,温度下降向左平移,浓度上升向上平移,浓度下降向下平移。
如坐标图中初始溶液在a点,从T2降温至T1,a点向左平移至a’点,a’点与T1温度时溶解度曲线纵坐标差可衡量溶液中析出固体的质量。
溶液初始在a点,在温度T2恒温蒸发溶剂,a点向上平移至a”点,a”点与T2温度时溶解度曲线纵坐标差可衡量溶液中析出固体的质量。
3.物质的提纯溶解度随温度变化剧烈上升的物质称为“陡升型物质”,溶解度随着温度变化缓慢上升的物质称为“缓升型物质”。
若要提纯陡升型物质(如KNO3中混有NaCl)常采用加热浓缩降温结晶而后过滤的方式提纯。
若要提纯缓升型物质(如NaCl中混有KNO3)常采用加热浓缩恒温蒸发溶剂结晶而后过滤的方式提纯。
三、期末易错典型例题例1.(2017南京溧水月考)如图是a、b、c三种物质的溶解度曲线.由如图所示判断下列说法中不正确的是()A.c的溶解度随温度的升高而减少℃时,a的溶解度等于b的溶解度B.在t℃降温至t1℃时变为不饱和溶液C.a的饱和溶液从tD.t1℃时,a的饱和溶液60g中含有溶剂50g例2.(2017南京清水亭学校月考)如图是A、B、C三种物质的溶解度曲线。

溶解度曲线知识归纳
一、点的意义
1.溶解度曲线上的点表示某物质在该点所对应温度下的溶解度,溶液所处的状态是饱和状态。
2.溶解度曲线以下区域内的任一点,表示溶液所处的状态是不饱
和状态,依其数据配制的溶液为对应温度时的不饱和溶液。
3.溶解度曲线以上区域内的任一点,表示溶液所处的状态是饱和
状态,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有
剩余。
4.两条溶解度曲线的交点,表示在该点所对应温度下两种物质的
溶解度相等。
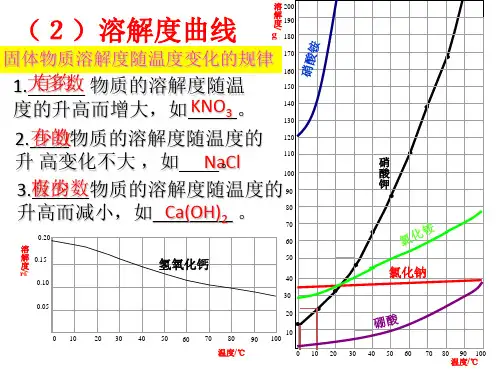
二、变化规律
1.大多数固体物质的溶解度随温度的升高而增大,曲线为“陡升
型”,如硝酸钾。
2.少数固体物质的溶解度受温度的影响很小,曲线为“缓升型”,如氯化钠。
3.极少数固体物质的溶解度随温度的升高而减小,曲线为“下降
型”,如氢氧化钙。
4.气体物质的溶解度均随温度的升高而减小(横坐标表示温度,纵坐标表示体积),曲线为“下降型”如氧气;气体物质的溶解
度均随压强的增大而增大,如二氧化碳,曲线为“上升型”。
三、应用
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质
结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。
1∕1。

中考复习专题——溶解度曲线及溶质质量分数计算一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
1、点① 曲线上的点:表示对应温度下该物质的溶解度。
曲线下方的点:表示在对应温度下该物质的不饱和溶液,可以通过加溶质或者降温的方法使其达到饱和状态。
②曲线交点:表示在对应温度下不同物质的溶解度相同。
2、线如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。
如KNO 3等大多数固体物质:图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”,如NaCl 等少数固体物质。
图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、掌握溶解度曲线的应用1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2. 可以比较在同一温度下不同物质溶解度的相对大小。
3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
练习:溶解度/g1.NaCl和KNO3的溶解度如下,请回答下列问题。
(1)60 ℃时,KNO3的溶解度是________;(2)20 ℃时,将50g NaCl固体加入盛有100 g水的烧杯中,充分溶解形成溶液的溶质质量分数是________;(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法是________________________;(4)将60 ℃等质量的KNO3的饱和溶液和NaCl的饱和溶液降温到20 ℃,分别得到溶液甲和乙。

2019-2020年中考化学复习专题(三)溶解度曲线及其应用一、溶解度曲线的意义1.溶解度曲线上的每个点表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度。
2.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
3.两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
4.在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液。
二、溶解度曲线的应用1.溶解度曲线上的点有三个方面的作用:(1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.如果要使不饱和溶液(曲线下方的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
类型1 溶解度曲线的意义例1 (xx·潍坊)甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法正确的是( )A.把a1℃时甲、乙的饱和溶液升温到a2℃仍是饱和溶液B.a2℃时,丙的溶液的质量分数大于乙的溶液的质量分数C.三种物质的溶解度都随温度的升高而增大D.a3℃时,三种物质的溶解度大小关系:甲>丙>乙思路点拨:根据甲、乙、丙三种固体物质的溶解度曲线可知,a1℃时甲、乙的饱和溶液升温到a2℃都为不饱和溶液;a2℃时,乙和丙的溶液是否达到饱和都无法确定,所以无法比较其溶液中溶质质量分数的大小;丙物质的溶解度随温度的升高而减小。


溶解度/gt/℃21Om 3m 4 m 1m 2 Bca b A 溶解度曲线一、溶解度曲线的涵义 1.涵义:物质的溶解度受温度影响,温度变化溶解度也变化。
如果在直角坐标系中,用横坐标表示温度,纵坐标表示溶解度,根据物质在不同温度下的溶解度,我们可以得到一系的点,将这些点以光滑的曲线连贯起来就得到了溶解度曲线。
溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。
根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。
2.说明 (1)点① 曲线上的点:表示对应温度下该物质的溶解度。
如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。
曲线上方的点:表示在对应温度下该物质的饱和溶液中存在 不能继续溶解的溶质。
如:图中b 表示在t 1℃时,A 的饱和溶液中有 (m 2-m 1)g 未溶解的溶质。
曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不同物质的溶解度相同。
如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。
(2)线○1如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。
如KNO 3等大多数固体物质:○2图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”,如NaCl 等少数固体物质。
○3图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。
二、溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2.可以比较在同一温度下不同物质溶解度的相对大小。
3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。
并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。
某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4.从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5.利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
溶解度/gCB A O知识点一:溶解度曲线“点”的涵义例1.如图是A 、B 、C 三种物质在水中的溶解度曲线,请回答: (1)M 点的含义是 。
(2)当温度为t 1ºC,三种物质溶解度由小到大依次为 ,当为t 3ºC 时,溶解度最大的是 。
知识点二:溶解度曲线上的“线”例2.下图是A.B 两种物质的溶解度曲线,试回答下列问题(1)t 1ºC 时,A 的溶解度 B 的溶解度。
(填< > 或=) (2)等质量水中溶解A 、B 两物质达到饱和时,溶液中溶质的质量 相等,此时温度是 C 。
(3)当A 、B 两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、 降低温度的方法可以达到饱和的是 物质的溶液。
解析:溶解度曲线上曲线的走向反应了溶解度随温度变化的规律。
曲线上升,说明温度升高,溶解度增大。
能用降低温度的方法达到饱和,说明温度降低时,溶解度减小。
知识点三:溶解度曲线综合应用例3.右图是a 、b 、c 、d 四种固体物质的溶解度曲线; 下表是这些固体物质在部分温度时的溶解度。
根据图表信息判断下列说法正确的是( ) A.图中a 曲线表示KNO 3的溶解度曲线 B.b 的溶解度小于a 的溶解度C.要从a 与d 的混合物中得到a ,通常采用蒸发溶剂使其结晶的方法D.KCl 的不饱和溶液由60℃降温至10℃时变成饱和溶液例4.甲、乙两种固体的溶解度曲线如右图所示。
下列说法中,不正确的是( )A.20℃时,100g 甲溶液中溶质的质量一定等于100g 乙溶液 中溶质的质量B.40℃时,分别在100 g 水中加入40 g 甲、乙, 所得溶液的质量相等C.40℃时,分别在100 g 水中加入30 g 甲、乙, 同时降温至20℃,甲、乙溶液均为饱和溶液D.20℃时,分别在100 g 水中加入40 g 甲、乙,加热到40℃时,乙溶液为饱和溶液 例5.a ,b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )A. 将t 1℃时b 的饱和溶液加水可变为不饱和溶液 B . 将t 2℃时a 的饱和溶液降温至t 1℃,溶液质量不变 C . t 2℃时,两种物质的饱和溶液中溶质质量分数a >bD . 将t 2℃时a 、b 的饱和溶液分别降温至t 1℃,两溶液的溶质质量分数相等【基础演练】1.右图分别表示A 、B 、C 三种物质的溶解度曲线,则t 20C 时,其溶解度由大小的顺序是( ) A.A 、B 、CB.B 、A 、CC.B 、C 、AD.C 、A 、B2.根据右图的X 和Y 溶解度曲线,下列说法正确的是( ) A .X 的溶解度比Y 大。
B .Y 的溶解度比X 大。
C .随温度升高,X 和Y 的溶解度 增大的数值一样。
D .在X 和Y 溶解度曲线中,只有一个温度,X 与Y 溶解度相等。
3.如图是甲、乙两种物质(不含结晶水)的溶解度曲线,下列 说法正确的是( ) A.甲的溶解度大于乙的溶解度B.t 1℃时,50g 甲的饱和溶液中有15g 甲C.t 2℃时,甲的饱和溶液降温至t 1℃变为不饱和溶液D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲4.右图为甲、乙两种固体物质在水中的溶解度曲线。
下列说法错误的()A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.乙的不饱和溶液通过降温可变成饱和溶液5.甲、乙两种固体物质的溶解度曲线如图所示。
现有两烧杯分别盛有60 ℃甲的饱和溶液和乙的饱和溶液,且两烧杯中均有未溶解的固体,现将温度从60 ℃降到20 ℃。
下列说法正确的是()A.甲乙溶液中溶质质量分数都减少B.甲乙溶解度随温度降低而减小C.烧杯中甲固体质量增加,乙固体质量减少D.甲溶液质量减少,乙溶液质量变大且一定是饱和溶液【巩固提高】1. 1.下图是甲、乙两种固体物质的溶解度曲线。
下列说法中正确的是()A.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大B.30℃时,100g甲的饱和溶液中溶质质量为30gC.甲的溶解度大于乙的溶解度D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲2.(多选)下图为A物质的溶解度曲线。
M、N两点分别表示A物质的两种溶液。
下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)()A.从N→M:先向N中加入适量固体A再降温B.从N→M:先将N降温再加入适量固体AC.从M→N:先将M降温再将其升温D.从M→N:先将M升温再将其蒸发掉部分水3.下图是a、b两种固体物质的溶解度曲线,下列说法正确的是()A.10 ℃时,a的溶解度大于b的溶解度B.t℃时,等质量a 、b 两种饱和溶液的溶质质量相同C.随着温度的升高,溶解度变化较大的物质是bD.将b 溶液由10 ℃升温至30 ℃时变为饱和溶液4.甲、乙、丙三种固体物质溶解度曲线如下图所示,请回答:(1)右图中M点表示 。
(2)若要从甲的饱和溶液中获得甲晶体, 常采用 的方法。
(3)丙的不饱和溶液转化成饱和溶液可采用的方法: 。
(4)把相同质量的甲、乙、丙三种饱和溶液从t 2℃降到t 1 ℃析出晶体最多的是 ,没有晶体析出的是 。
(5)t 2℃时,将等质量的上述三种物质分别加入到100g 水中,充分搅拌,如果得到的溶液只有一种是饱和溶液,则该饱和溶液中的溶质是 。
1.甲、乙两物质的溶解度曲线如图所示,下列说法正确的是( ) A.甲和乙的饱和溶液,从t 1℃升温到t 2℃,仍是饱和溶液 B.t 1℃时,甲和乙的溶解度相等C.t 1℃时,甲和乙各30g 分别加入80g 水中,均能恰好完全溶解D.t 2℃时,在100g 水中放入60g 甲,形成不饱和溶液 2.右图是a 、b 两种固体物质的溶解度曲线。
从图中可获得的信息是( )A.固体物质的溶解度均随温度升高而增大B.t ℃,相同质量的a 、b 溶解时放出热量相同C.升高温度,可使a 或b 的饱和溶液变为不饱和溶液D.将相同质量的a 、b 分别加入100g 水中,所得溶液质量分数相同 3.右图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( ) A.甲的溶解度大于乙的溶解度 B.乙的不饱和溶液降温可变成饱和溶液 C.20oC 时,甲、乙两种物质的溶解度相等 D.50o C 时,甲的饱和溶液中溶质的质量分数为40%4.右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确的是( ) A.b 的溶解度大于a 的溶解度B.t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发等质量的水, 析出晶体的质量一定相等50- 40- 30- 20- 10-甲乙温度/℃tt 0溶解度/g甲乙C.将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数5.右图是a、b两种固体物质的溶解度曲线,下列说法中正确的是()A.a的溶解度大于b的溶解度B.在20℃时,a、b的溶液中溶质的质量分数相同C.a、b的溶解度都随温度升高而增大D.a、b都属于易溶物质6.t2℃时往盛有100g水的烧杯中先后加入a g M和a g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。
将混合物的温度降低到t1℃,下列说法正确的是()A.t2℃时,得到M的饱和溶液B.t2℃时,得到N的不饱和溶液C.温度降低到t1℃时,M、N的溶质质量分数相等,得到M、N的不饱和溶液D.温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液7.右图是a、b、c三种固体物质的溶解度曲线,下列叙述正确的是()A.将a、b、c三种物质t1℃时的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是a>b>cB.t2℃时30g物质a加入到50g水中不断搅拌,形成80g溶液C.t1℃时a、b、c三种物质的饱和溶液中含有溶质质量按由小到大的顺序排列是b>a=cD.若a中混有少量c,可以采用冷却热饱和溶液的方法提纯a8.甲、乙两种物质的溶解度曲线如右图所示。
70℃时,将等质量的甲、乙两种固体(不含结晶水)分别加入到各盛100g水的两个烧杯中,充分搅拌后固体均完全溶解,降温到50℃,观察到甲的溶液中有固体析出。
下列说法正确的是A.降温到50℃时,乙的溶液中不一定有固体析出B.70℃时所得甲和乙的溶液一定都是不饱和溶液C.若从50℃再降温到30℃,甲和乙的溶液均继续析出固体D.降温到30℃后,两溶液中溶质的质量分数相等1.两种不含结晶水的固体物质a、b的溶解度曲线如右图,下列说法正确的是()A.b的溶解度小于a的溶解度B.分别将t2℃时a、b两种物质的溶液降温至t1℃,肯定都有晶体析出C.要从含有少量a的b溶液中得到较多的b晶体,通常可采用降温结晶的方法D.在t2℃时,用a、b两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水温度/℃12bag2.右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。