第三章 第三节 第2课时
- 格式:docx
- 大小:643.63 KB
- 文档页数:13


第2课时乙酸1.会写乙酸的分子式、结构式、结构简式,知道乙酸的官能团是—COOH。
2.知道乙酸具有酸的通性,并知道乙酸的酸性比碳酸强,会写乙酸与Na、NaOH、Na2CO3、NaHCO3反应的化学方程式。
3.了解酯化反应的概念,会写乙酸与乙醇发生酯化反应的化学方程式。
4.知道乙酸与乙醇发生酯化反应时是乙酸脱去—OH、乙醇脱去—OH上的H原子而结合成水,其余部分结合成乙酸乙酯。
知识点一乙酸的组成、结构和酸性[学生用书P56]阅读教材P75,思考并填空。
1.乙酸的组成和结构2.乙酸的物理性质3.乙酸的酸性(1)弱酸性:乙酸在水中的电离方程式为CH3COOH CH3COO-+H+,是一元弱酸,具有酸的通性。
(2)醋酸与碳酸酸性强弱的比较实验1.判断正误(1)乙酸的最简式是CH2O。
()(2)乙酸和乙醇分子中都含“”结构。
()(3)冰醋酸是混合物。
()(4)乙酸是食醋的主要成分,其官能团是羧基。
()(5)用乙酸除水垢的离子反应为CaCO3+2H+===Ca2++CO2↑+H2O。
()答案:(1)√(2)×(3)×(4)√(5)×2.写出乙酸与下列物质反应的化学方程式。
(1)Na:_____________________________________________________。
(2)Na2O:_________________________________________。
(3)KOH:__________________________________________________。
(4)NaClO:_____________________________________________________。
答案:(1)2Na+2CH3COOH―→2CH3COONa+H2↑(2)Na2O+2CH3COOH―→2CH3COONa+H2O(3)KOH+CH3COOH―→CH3COOK+H2O(4)NaClO+CH3COOH―→CH3COONa+HClO3.可以说明CH3COOH是弱酸的事实是()A.CH3COOH与水能以任意比互溶B.CH3COOH能与Na2CO3溶液反应,产生CO2C.0.1 mol·L-1的CH3COOH溶液中c(H+)=0.001 mol·L-1D.1 mol·L-1的CH3COOH溶液能使紫色石蕊溶液变红解析:选C。

第二课时乙酸——————————————————————————————————————[课标要求]1.了解乙酸的主要用途。
2.掌握乙酸的组成与主要性质。
3.学会分析官能团与物质性质关系的方法。
1.乙酸俗名醋酸,其结构简式为CH3COOH,官能团为羧基(COOH)。
2.乙酸具有弱酸性,能发生酯化反应,其与乙醇反应生成乙酸乙酯。
3.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸和乙醇。
4.必记两反应:(1)2CH3COOH+Na2CO3―→2CH3COONa+H2O+CO2↑。
(2)CH3COOH+CH3CH2OH浓硫酸△CH3COOCH2CH3+H2O。
乙酸1.分子结构分子式结构式结构简式官能团比例模型C2H4O2CH3COOH 羧基:—COOH俗名颜色状态气味溶解性挥发性醋酸无色液体强烈刺激性气味易溶于水易挥发3.化学性质(1)断键位置与性质(2)弱酸性乙酸是一元弱酸,具有酸的通性。
在水中部分电离,电离方程式为CH3COOH CH3COO -+H+,其酸性比碳酸的酸性强。
根据如下转化关系,写出相应的化学方程式①2CH3COOH+2Na―→2CH3COONa+H2↑;②CH3COOH+NaHCO3―→CH3COONa+CO2↑+H2O;③2CH3COOH+Na2O―→2CH3COONa+H2O;④CH3COOH+NaOH―→CH3COONa+H2O。
(3)酯化反应概念酸和醇反应生成酯和水的反应反应特点反应可逆且比较缓慢化学方程式(以乙醇与乙酸反应为例)把反应混合物用导管通到饱和碳酸钠溶液的液面上,液面反应现象上有透明的油状液体,且能闻到香味CH3COOH是一种常见的有机弱酸,其酸性强于H2CO3,可通过向NaHCO3溶液中滴加醋酸溶液,能产生使澄清石灰水变浑浊的气体的方法进行验证。
1.乙酸具有什么结构特点?其官能团是什么?提示:乙酸可认为是甲烷分子中的一个氢原子被羧基取代后的产物,其官能团是羧基(—COOH)。


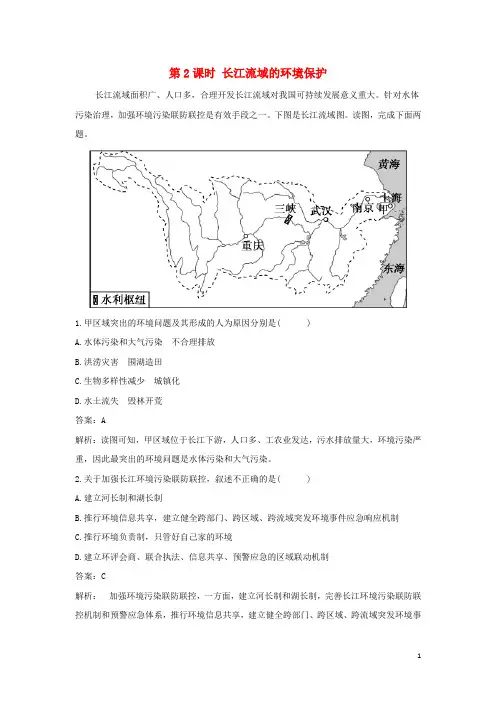
第2课时长江流域的环境保护长江流域面积广、人口多,合理开发长江流域对我国可持续发展意义重大。
针对水体污染治理,加强环境污染联防联控是有效手段之一。
下图是长江流域图。
读图,完成下面两题。
1.甲区域突出的环境问题及其形成的人为原因分别是( )A.水体污染和大气污染不合理排放B.洪涝灾害围湖造田C.生物多样性减少城镇化D.水土流失毁林开荒答案:A解析:读图可知,甲区域位于长江下游,人口多、工农业发达,污水排放量大,环境污染严重,因此最突出的环境问题是水体污染和大气污染。
2.关于加强长江环境污染联防联控,叙述不正确的是( )A.建立河长制和湖长制B.推行环境信息共享,建立健全跨部门、跨区域、跨流域突发环境事件应急响应机制C.推行环境负责制,只管好自己家的环境D.建立环评会商、联合执法、信息共享、预警应急的区域联动机制答案:C解析:加强环境污染联防联控,一方面,建立河长制和湖长制,完善长江环境污染联防联控机制和预警应急体系,推行环境信息共享,建立健全跨部门、跨区域、跨流域突发环境事件应急响应机制;另一方面,建立环评会商、联合执法、信息共享、预警应急的区域联动机制,研究建立生态修复、环境保护、绿色发展的指标体系。
清江是长江中游南岸的重要支流,流域面积近17 000平方千米,流经鄂西山地,总落差1 500米,历史上多洪涝灾害。
现在清江上已建有高坝洲、隔河岩、水布垭等水利工程,对流域内的开发建设有积极意义。
据此回答下面两题。
3.清江流域洪涝灾害多发的主要原因是( )A.支流少,流域面积广B.降水多,季节变化大C.地势低平,排水不畅D.落差大,多曲流答案:B解析:一般洪涝灾害多发的原因包括来水量大、落差小,导致排水不畅等,而材料中显示该河落差大,故可从来水量大角度分析。
该地位于长江中游,属于亚热带季风气候,降水较多,且季节变化大,雨季易出现洪涝灾害。
4.清江流域的综合开发方向是( )A.实行梯级开发,实现全流域通航B.修建水利工程,为工业发展提供原料C.扩大灌溉面积,发展河谷农业D.发展旅游业,促进区域产业结构调整答案:D解析:大型水利工程建设本身就是重要的旅游资源,可以发展以山水、大坝、水库为景点的旅游业,促进区域产业结构调整。

第2课时盐类水解的影响因素及应用[明确学习目标] 1.掌握影响盐类水解平衡移动的外界因素以及水解程度的变化。
2.了解盐类水解在生产、生活中的应用。
一、影响盐类水解的因素因素对盐类水解程度的影响内因盐组成中对应的酸或碱越弱,水解程度越□01大外界条件温度升高温度能够□02促进水解浓度盐溶液浓度越小,水解程度越□03大外加酸碱水解显酸性的盐溶液,加碱会□04促进水解,加酸会□05抑制水解;水解显碱性的盐溶液,加酸会□06促进水解,加碱会□07抑制水解外加盐加入酸碱性不同的盐会□08促进盐的水解二、盐类水解的应用1.盐溶液的配制:配制FeCl3溶液时,可加入少量盐酸,目的是□01抑制Fe3+的水解。
2.热碱去油污:用纯碱溶液清洗油污时,加热可增强其去污能力。
3.盐类作净水剂:铝盐、铁盐等部分盐类水解生成胶体,有较强的□02吸附性,常用作净水剂。
如明矾可以用来净水,其反应的离子方程式为□03Al3++3H2O Al(OH)3(胶体)+3H+。
4.制备物质(1)用TiCl4制取TiO2发生反应的化学方程式为□04TiCl4+(x+2)H2O(过量)TiO2·x H2O↓+4HCl;TiO2·x H2O=====△TiO2+x H2O。
(2)利用盐的水解可以制备纳米材料。
1.NH4Cl溶液加水稀释,水解程度增大,酸性增强,对吗?提示:不对。
加水稀释,水解程度增大,水解产生的n(H+)增大,但盐溶液的体积也增大,且体积增大对溶液酸性的影响比n(H+)增大对酸性的影响大。
所以加水稀释,NH4Cl溶液的酸性减弱。
2.加热蒸干FeCl3溶液,得到的固体是FeCl3吗?提示:Fe3+在溶液中水解,离子方程式为Fe3++3H2O Fe(OH)3+3H+,加热蒸干后,产物中的HCl气体离开平衡体系,结果使FeCl3完全水解,所得固体为Fe(OH)3而不是FeCl3。
一、影响盐类水解的因素1.内因主要因素是盐本身的性质,组成盐的酸根对应的酸越弱,或阳离子对应的碱越弱,水解程度越大(越弱越水解)。


第2课时乙酸[学习目标定位] 1.会写乙酸的分子式、结构式、结构简式,知道乙酸的官能团是—COOH。
2.知道乙酸具有酸的通性,并知道乙酸的酸性比碳酸强,会写乙酸与Na、NaOH、Na2CO3、NaHCO3反应的化学方程式。
3.了解酯化反应的概念,会写乙酸与乙醇发生酯化反应的化学方程式。
4.知道乙酸与乙醇发生酯化反应时是乙酸脱去—OH、乙醇脱去—OH上的H而结合成水,其余部分结合成乙酸乙酯。
一认识乙酸的酸性1.乙酸分子结构分子式:C2H4O2;结构式:;结构简式:CH3COOH;官能团:羧基(—COOH)。
2.乙酸又叫醋酸,是食醋的主要成分,是常用的酸味剂,具有酸的通性。
现通过以下两个实验来认识乙酸的酸性:①向试管中加入约2 mL稀醋酸溶液,加入紫色石蕊溶液,观察现象;②向试管中加入约2 mL稀醋酸溶液,滴加碳酸钠溶液,观察现象。
讨论下列问题:(1)上述实验可观察到什么现象?可得出什么结论?答案①加入石蕊溶液呈红色。
②滴加碳酸钠溶液有气泡生成。
以上实验说明乙酸具有酸性。
(2)设计一个实验装置,比较乙酸、碳酸和硅酸的酸性强弱,画出装置图并说出预期的实验现象和结论。
答案现象:碳酸钠溶液中出现气泡,硅酸钠溶液中有白色沉淀生成。
结论:酸性:乙酸>碳酸>硅酸。
归纳总结羧基、醇羟基及水中氢原子活泼性比较1.可以说明CH3COOH是弱酸的事实是()A.CH3COOH与水能以任何比互溶B.CH3COOH能与Na2CO3溶液反应,产生CO2C.0.1 mol·L-1的CH3COOH溶液中c(H+)=0.001 mol·L-1D.1 mol·L-1的CH3COOH溶液能使紫色石蕊溶液变红答案 C解析排除法。
选项A只说明CH3COOH易溶于水;选项B说明CH3COOH的酸性比碳酸强;选项D说明CH3COOH显酸性。
(选项C中的数据说明CH3COOH没能完全电离,即说明CH3COOH是弱酸——尚未学到)。
2.用食醋浸泡有水垢(主要成分CaCO3)的暖瓶或水壶,可以清除其中的水垢。
这是利用了醋酸的什么性质?通过这个事实你能比较出醋酸与碳酸的酸性强弱吗?答案利用食醋清除水垢是利用了醋酸的酸性,它之所以能清除水垢是因为CH3COOH能与CaCO3发生反应:2CH3COOH+CaCO3―→(CH3COO)2Ca+H2O+CO2↑;该反应的发生可以说明CH3COOH的酸性比H2CO3的酸性强。
二乙酸的酯化反应在一支试管中加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸,按下图装置进行实验(产生的蒸气经导管通到饱和Na2CO3溶液的液面上),观察右边试管中的现象并闻气味。
1.右边试管中可观察到什么现象并闻到什么气味?答案饱和Na2CO3溶液的液面上有油状液体,且能闻到香味。
2.做对照实验:右边试管中不盛放饱和Na2CO3溶液而是浸在盛有冷水的烧杯中,其他装置和操作相同。
(1)实验结束后闻到香味了吗?可能的原因是什么?答案没有闻到香味;乙酸乙酯的香味被挥发出来的乙酸的强烈刺激性气味掩盖了。
(2)由此可见饱和碳酸钠溶液的作用是什么?答案①降低乙酸乙酯的溶解度,便于分层,得到酯;②中和挥发出来的乙酸;③溶解挥发出来的乙醇。
(3)乙酸和乙醇在浓硫酸作用下加热生成乙酸乙酯,化学方程式为CH3COOCH2CH3+H2OCH3COOH+HOCH2CH3浓H2SO4△该反应中的水是由氢原子和羟基结合而得,试猜想该反应的历程,并提出验证猜想的方法。
答案反应的历程是酸去羟基醇去氢。
酯化反应的反应机理可用示踪原子法来证明:若用含18O的乙醇和不含18O的乙酸反应,可以发现所生成的乙酸乙酯分子里含有18O原子,而水分子中不含18O原子,这说明酯化反应的一般过程是羧酸分子中的—OH与醇分子中—OH上的氢原子结合生成水,其余部分结合生成酯:。
(4)该反应中浓H2SO4起什么作用?答案①催化剂——加快反应速率;②吸水剂——提高CH3COOH、CH3CH2OH的转化率。
归纳总结酯化反应概念:酸与醇反应生成酯和水的反应。
3.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是()A.均采用水浴加热B.制备乙酸丁酯时正丁醇过量C.均采用边反应边蒸馏的方法D.制备乙酸乙酯时乙醇过量答案 D解析制备乙酸丁酯和乙酸乙酯均是采取用酒精灯直接加热法制取,A项错误;制备乙酸丁酯时采用容易获得的乙酸过量,以提高丁醇的利用率的做法,B项错误;制备乙酸乙酯采取边反应边蒸馏的方法、制备乙酸丁酯则采取直接回流的方法,待反应后再提取产物,C项错误;制备乙酸乙酯时,为提高乙酸的利用率,采取乙醇过量的方法,D项正确。
4.下列说法正确的是()A.酯化反应也属于加成反应B.酯化反应中羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子生成水C.浓硫酸在酯化反应中只起催化剂的作用D.欲使酯化反应生成的酯分离并提纯,可以将酯蒸气通过导管伸入饱和碳酸钠溶液的液面下,再用分液漏斗分离答案 B1.下列关于乙酸性质的叙述中,错误的是()A .乙酸的酸性比碳酸强,所以它可以与碳酸盐反应,产生CO 2气体B .乙酸能与醇类物质发生酯化反应C .乙酸分子中含有碳氧双键,所以它能使溴水褪色D .乙酸在温度低于16.6 ℃时,就凝结成冰状晶体 答案 C2.如图是某种有机物的简易球棍模型,该有机物中只含有C 、H 、O 三种元素。
下列有关于该有机物的说法中不正确的是( ) A .分子式是C 3H 6O 2 B .不能和NaOH 溶液反应 C .能发生酯化反应 D .能使紫色石蕊溶液变红答案 B解析 该有机物的结构简式为能和NaOH 溶液反应。
3.具有一个羟基的化合物A 10 g ,与乙酸反应生成乙酸某酯11.85 g ,并回收了未反应的A 1.3 g ,则A 的相对分子质量为( ) A .98 B .116 C .158 D .278 答案 B解析 设化合物A 为R —OH ,相对分子质量为M r ,则发生的酯化反应方程式为 CH 3COOH +HO —R 浓硫酸△CH 3COOR +H 2OM r M r +60-18 (10-1.3)g 11.85 gM r(10-1.3)g=M r +60-1811.85 g ,解得M r =116。
4.实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊溶液1 mL ,发现紫色石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管)。
下列有关该实验的描述,不正确的是( )A .制备的乙酸乙酯中混有乙酸和乙醇杂质B .该实验中浓硫酸的作用是催化和吸水C .饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸D.石蕊层为三环,由上而下是蓝、紫、红答案 D解析A项,在乙酸乙酯挥发过程中,乙酸、乙醇也挥发,A正确;B项,浓硫酸起催化作用,同时吸收生成的水,使反应平衡正向移动,B正确;C项,饱和碳酸钠溶液的作用是吸收乙酸、乙醇,降低乙酸乙酯的溶解度,有利于分层分离,C正确;D项,由于乙酸乙酯密度小于水,三层顺序为乙酸乙酯、石蕊、饱和碳酸钠溶液,乙酸乙酯中有乙酸使石蕊变红,碳酸钠水解显碱性使紫色石蕊溶液变蓝,从上到下颜色为红、紫、蓝,D错误。
5.回答下列问题:Ⅰ.断①键发生________反应,乙酸能使石蕊溶液变________色,其酸性比碳酸强。
(1)与钠反应的离子方程式:________________________________________________________________________。
(2)与氢氧化钠溶液反应的离子方程式:________________________________________________________________________。
(3)与氧化铜反应的离子方程式:________________________________________________________________________。
(4)与碳酸钙反应的离子方程式:________________________________________________________________________。
Ⅱ.断②键发生________反应,与CH3CH2OH反应的化学方程式:________________________________________________________________________________________________________________________________________________。
答案Ⅰ.取代红(1)2CH3COOH+2Na―→2CH3COO-+H2↑+2Na+(2)CH3COOH+OH-―→CH3COO-+H2O(3)2CH3COOH+CuO―→2CH3COO-+Cu2++H2O(4)2CH3COOH+CaCO3―→2CH3COO-+Ca2++H2O+CO2↑Ⅱ.酯化或取代40分钟课时作业[经典基础题]一、乙酸的分子结构和性质1.乙酸分子的结构式为下列反应及断键部位正确的是( )①乙酸的电离,是①键断裂②乙酸与乙醇发生酯化反应,是②键断裂 ③在红磷存在时,Br 2与CH 3COOH 的反应:CH 3COOH +Br 2――→红磷CH 2Br —COOH +HBr ,是③键断裂 ④乙酸变成乙酸酐的反应:是①②键断裂A .①②③B .①②③④C .②③④D .①③④答案 B解析 乙酸电离出H +时,断裂①键;在酯化反应时酸脱羟基,断裂②键;与Br 2的反应,取代了甲基上的氢,断裂③键;生成乙酸酐的反应,一个乙酸分子断①键,另一个分子断②键,所以B 正确。
2.下列有关乙酸性质的叙述错误的是( )A .乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇B .乙酸的沸点比乙醇高C .乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应D .在发生酯化反应时,乙酸分子羧基中的氢原子跟醇分子中的羟基结合成水 答案 D解析 乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇,含有一个羧基属于一元酸,酸性强于碳酸,沸点高于乙醇,发生酯化反应时乙酸分子脱羟基。
3.下列物质都能与金属钠反应放出H 2,产生H 2的速率排序正确的是( ) ①C 2H 5OH ②NaOH 溶液 ③醋酸溶液 A .①>②>③ B .②>①>③ C .③>②>① D .③>①>② 答案 C解析金属钠与NaOH溶液反应,实质上是与其中的水反应。
已知钠与水反应的速率比乙醇快;醋酸溶液中氢离子浓度更大,与钠反应速率更快。