测定1摩尔气体体积
- 格式:ppt
- 大小:1.74 MB
- 文档页数:12
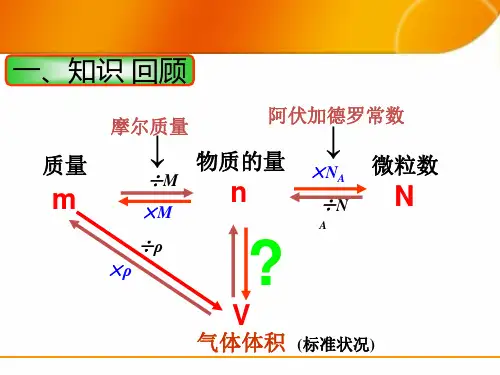


测定1mol气体的体积我们知道,1mol 任何气体的体积在同温、同压下是相同的,在0℃、101.3kP时约为22.4L;而1mol气体的质量各不相同。
要测定1mol气体的体积,如取氢气作试样,则要测定2.016g氢气(氢的摩尔质量为1.008g/mol)所占的体积;如取二氧化碳作试样,则是测定44.0g二氧化碳所占的体积。
测定1mol气体体积的方法化学实验室中,可以直接取一定体积(V)的某种气体,称出它的质量(m),或称取一定质量(m)的某种气体,量出它的体积(V),再根据这种气体的摩尔质量,计算出1mol气体的体积:然而,直接测定气体的体积和质量,操作上比较繁复,我们可以设想能否用称量固体的质量、量出液体的体积,间接地得到气体的质量和体积。
气体摩尔体积测定装置(如图)由三部分组成,左边是气体发生器,中间是储液瓶,右边是液体量瓶。
储液瓶上的刻度线标明了容积约200mL的位置,液体量瓶的容积约130mL,量瓶瓶颈上有110—130mL刻度线,可正确读出进入量瓶的液体的体积。
全部装置固定在专用底座上。
底座放置气体发生器、液体量瓶的位置下有螺旋,能作高低的微调。
如要测定1mol氢气的体积,则取一定质量的镁带跟稀硫酸在气体发生器中完全反应,产生的氢气把储液瓶中液体(品红溶液)压入液体量瓶,读出液体数据转换成氢气的体积,进行计算推算出实验温度时1mo l氢气的体积。
实验步骤:1、记录实验室的温度和压强。
2、装配好气体摩尔体积测定装置,做好气密性检查。
3、用砂皮擦去镁带表面的氧化物,然后称取0.120—0.140g镁带(精确至0.001g),把准确数值记录于表格。
4、将镁带用纸舟投入到气体发生器的底部,用橡皮塞塞紧。
注意:不要使镁带贴附在瓶壁上。
5、用针筒吸取10mL 2mol/L H2SO4溶液,用针头扎进橡皮塞,将硫酸注入气体发生器,注如后要迅速拔出针筒(注意要捏住针头拔出,不要使针头和针筒脱离),观察现象。




1mol理想气体的体积
1mol理想气体的体积是多少?
理想气体是一种理论模型,它假设气体分子之间没有相互作用力,体
积可以忽略不计。
因此,1mol理想气体的体积可以通过理想气体状态方程来计算。
理想气体状态方程为PV=nRT,其中P为气体压强,V为气体体积,n 为气体摩尔数,R为气体常数,T为气体温度。
将摩尔数n取为1mol,常数R取为8.31J/(mol·K),温度T取为标准温度273.15K,代入方程中,可得1mol理想气体的体积为:
V = nRT/P = (1mol) × (8.31J/(mol·K)) × (273.15K) / (1atm) = 22.4L
因此,1mol理想气体的体积为22.4升。
这个结果是在标准温度下、
标准大气压下得出的。
如果气体的温度或压强不同,那么1mol理想
气体的体积也会不同。
需要注意的是,理想气体状态方程只适用于理想气体,而实际气体往
往会受到分子间相互作用力的影响,因此其体积不一定符合理想气体
状态方程的计算结果。
此外,理想气体状态方程也只适用于温度和压强在一定范围内的气体,当温度或压强过高时,气体分子之间的相互作用力会变得非常强,理想气体状态方程就不再适用。
总之,1mol理想气体的体积是22.4升,这个结果是通过理想气体状态方程计算得出的。
但需要注意的是,这个结果只适用于标准温度和压强下的理想气体,实际气体的体积可能会受到分子间相互作用力的影响。




定量实验:测定1mol气体的体积教材梳理一、问题分解化学实验室中,可以直接取一定体积(V)的某种气体,称出它的质量(m),或称取一定质量(m)的某种气体,量出它的体积(V),再根据这种气体的摩尔质量,计算出1mol气体的体积:1 mol气体的体积=V(L)/m(g)×M(g/mol)然而,直接测定气体的体积和质量,操作上比较繁复,我们可以设想能否用称量固体的质量、量出液体的体积,间接地得到气体的质量和体积。
二、问题讨论1.测定气体的体积,为什么要标明温度和压强?2.常温、常压(假设为101kPa)时,1 mol气体的体积比标准状况下的22.4 L大还是小?3.怎样检查装置的气密性?三、实验原理利用一定质量的金属与酸反应,根据金属的质量计算出产生气体的质量,测量生成气体的体积1 mol气体的体积=V(L)/m(g)×M(g/mol),式中V表示测量出的气体体积、m为计算出的气体质量、M表示该气体的摩尔质量。
四、实验过程1.装配好气体摩尔体积测定装置,做好气密性检查。
2.用砂皮擦去镁带表面的氧化物,然后称取0.100~0.110 g镁带(精确至0.001 g),把准确数值记录于表格中。
备注:该处称取0.100g~0.110g原因:测量体积的范围在110~130mL,除去H2SO4体积后为100~120mL,以标准状况下H2的体积换算得到Mg所需质量为0.107~0.129g,考虑到温度、压强、Mg中可能含杂质等方面影响,,称取0.100~0.110g的镁带较合适。
如镁带过多,产生气体体积超出量程,则需重做。
3.在A瓶出气口处拆下胶管,使A倾斜,取下加料口橡皮塞,用小烧杯加入约20mL水于A瓶中,再把已称量的镁带加到A瓶底部,塞紧加料口。
备注:加水稀释酸的浓度,防止反应过于剧烈。
4.用注射器在A瓶加料口抽气,使B瓶导管内液面和导管外液面持平,注意要捏住针头拔出,不要使针头和针筒脱离。
一、定量测定的方法和过程分析高中阶段主要需要掌握的定量分析方法分为三种:重量法,气体法,滴定法(容量法)。
1.重量法(1)概念:通过称量反应前后物质的质量差分析组成。
(2)操作步骤流程:(3)常见问题①如何检验沉淀是否完全?②沉淀如何洗涤?如何检验沉淀是否洗涤干净? 2.气体法(1)概念:通过测量反应生成气体的体积分析物质组成。
(2)操作步骤流程:定量实验专题知识梳理(3)量气装置的设计:下列装置中,A是常规的量气装置,B、C是改进后的装置A B C(4)常见问题:①装置的密封性决定实验是否成功的关键,如何检查装置的气密性?【答案】A装置:关闭左边导管,塞上储液瓶瓶塞,长导管会形成一段液柱,且一段时间不会变化。
B装置:关闭左边导管,上下移动右边长导管,左右两边会形成液面差,且一段时间液面差不发生变化。
C装置:用手或热毛巾捂住左边反应装置,导管口有气泡产生,停止热源,导管口有一段液柱回流②读取气体体积之前,如何调整装置确保装置内外压强平衡?【答案】A装置:读数前,如长导管上内有一段液柱,需用注射器将气体抽出,使导管内液面与储液瓶内液面保持持平,气体体积=读数+抽出的气体体积B装置:读数前,上下移动右边长导管,使左右两边液面持平。
(如右边液面高,则往上移动直到两边液面持平)C装置:读数前,上下移动量筒,使量筒内液面与水槽内液面持平。
(如量筒内液面偏高,则往下移动量筒,使量筒内液面与水槽内液面持平)3.滴定法(容量法)(1)概念:通过标准酸(碱)溶液滴定未知碱(酸)溶液或盐溶液测定未知溶液的浓度。
(2)操作步骤流程:(3)常见问题①如何判断终点?②如何读数二、基础定量实验回顾(一)测定1mol 气体的体积1.实验原理:222m 2V(H )V(H )V(H )M(Mg)V n(Mg)m(Mg)n(H )⋅===2.实验装置:气体摩尔体积测定装置由三部分组成:A 是_______________,B 是_________________,C 是_________________。
测定1mol气体体积实验误差的原因分析[设计思想]任何定量测定的方法,得到的数据都有一定的精确范围,或者说存在一定的误差。
定量实验必须尽可能减小实验误差,提高实验精确度。
本节课的教学围绕实验中如何实现这一要求?展开教学讨论,让学生认识实验误差的来源:一是仪器装置精密度和药品试剂的品质;二是操作的失误。
围绕着误差的来源,结合自己的实验,分析产生各种误差的原因,获得减小实验误差的方法。
在讨论减小实验误差,提高实验精确度的方法、措施时,从以下几个方面展开:(1)根据实验要求和条件精选精度比较高的计量仪器(如量体积时,尽可能用滴定管或移液管);(2)进行重复测量。
计算时取两次(或多次)可测量值之间的平均值;(3)准确规范操作。
如读数液体体积时,视线应该与管中的凹液面最低处相切等。
最后让学生归纳出:定量实验存在误差是一定的、允许的,重要的是误差要控制在合理的范围内,本实验误差值在-2—+2%。
一.教学目标1.知识与技能(1)实验误差分析(B)。
(2)实验报告的书写(B)。
2.过程与方法(1)通过实验反思,认识重复测量、数据处理等科学方法。
(2)明白实验操作不当引起实验误差的方法。
3.情感态度与价值观(1)通过实验报告的交流,同学间的倾听,体验相互学习、尊重他人的价值。
(2)通过对实验的反思,体验实事求是、严肃认真科学精神的意义。
二.教学重点与难点1.教学重点实验报告的书写。
2.教学难点分析操作不当引起实验误差。
三.教学用品媒体:电脑、投影仪等四.教学流程1.流程图2.流程说明引入:我们做了测定1摩尔氢气的体积的实验,下面请交流你们的实验报告。
学生交流:交流实验报告。
教师点评:根据报告与实验中观察获得的信息,对学生的实验作点评与评价。
师生交流:因操作不当而造成的误差。
如:(1)没有进行装置的气密性检查,(2)镁带表面氧化镁没有擦除或没有除尽等等学生练习:工业上测量SO2、N2、O2混合气体中SO2含量。
归纳小结:测定气体的质量或者体积一般有那些方法作业:教材上10.1五.教学案例1.教学过程教学内容教师活动学生活动说明测定气体摩尔体积的实验报告的[引入] 我们测定1摩尔氢气的体积。